이중결합
이중결합(double bond)은 분자 내 원자간의 화학결합에서 2개의 원자가 서로 2개의 원자가에 의해서 결합해 있는 화학결합이다. 보통의 이중결합은 2개의 공유결합으로 구성되어 있으며, 구조식은 C=C, C=O, C=N, N=O 등과 같이 2개의 선으로 나타낸다. 이 중에서 탄소이중결합, 즉 C=C를 특히 에틸렌결합이라고 한다. 에틸렌의 이중결합은 σ결합과 π결합에 의해 생긴다. 이 σ결합은, 결합에 관여하는 2개의 원자를 연결하는 축의 둘레에 주로 전자가 분포한다.
또 P8오비탈로 이루어진 π결합은 결합에 관여하는 2개의 원자를 포함하는 평면에 수직인 면 위에 전자가 분포한다. 일반적으로 단일결합에 비해서 결합간격이 작으며, 반응성이 풍부하다. 또, 몇 개의 이중결합이 서로의 단일결합에 의해서 결합한 것(예를 들면, -CH=CH-CH=CH-)을 짝이중결합이라고 한다.
상세[편집]
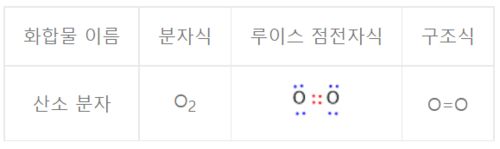
이중결합이란 서로 이웃한 두 원자 사이 '원자가 전자'들의 공유를 통해 이루어지는 화학 결합인 공유결합 중 하나로 두 원자가 공유하는 전자쌍이 2개인 결합을 가리킨다. 공유결합은 두 원자를 연결시키는 결합의 수를 나타내는 결합 차수(bond order)를 통해 또한 분류가 가능한데 이중결합은 곧 결합 차수가 2이다. 예를 들어 산소 분자(O₂)는 두 산소 원자가 자신의 2개 '원자가 전자'를 서로 공유하며, 따라서 공유 전자쌍이 2개인 이중 결합을 형성한다. 이산화 탄소(CO₂)도 중심 원자인 탄소는 이웃한 두 산소 원자와 각각 결합 차수가 2인 이중 결합(O=C=O)을 형성한다.
화합물의 구조를 나타내는 루이스 점전자식에서 이중 결합에 대한 표시는 공유 전자를 점으로 나타내어 두 원자 사이에 콜론 두 개를 나란히 붙여 놓은 형태(::)로 나타낼 수 있다. 아래 그림에서 빨간색으로 표시된 전자쌍이 산소 분자 내 공유 전자쌍이며 파란색으로 표시된 전자쌍은 산소 원자의 고립 전자쌍을 나타낸다. 화합물 구조에 대한 다른 표현 방법으로 공유 전자쌍 1개를 하나의 선으로 나타낼 수 있으며 이중 결합은 실선 두 개를 두 원소 기호 사이에서 두 원소 기호를 연결해주는 방식으로 그리면 된다.
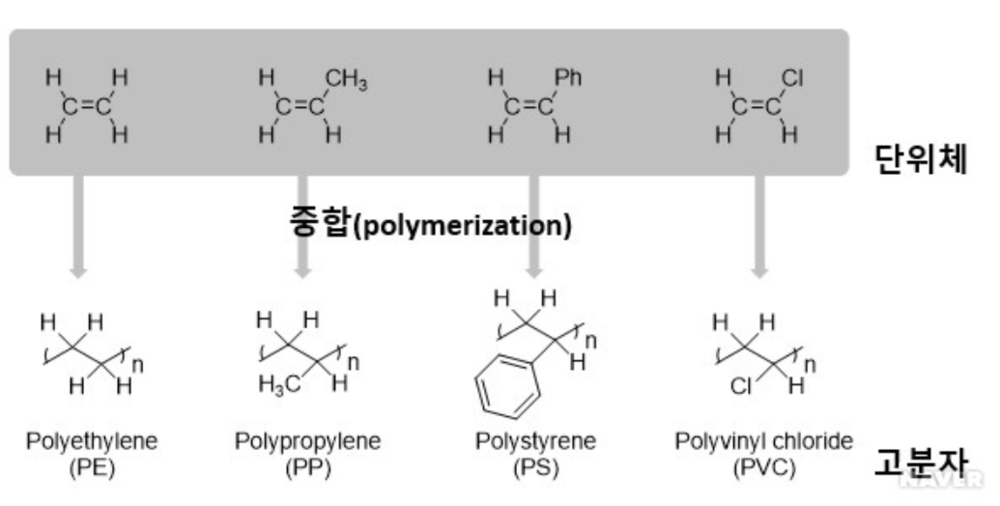
이중결합을 갖는 화합물의 중요한 예로 탄화수소(hydrocarbons) 화합물 중 하나인 에틸렌(C₂H₄)을 들 수 있다. 에틸렌의 이중결합을 활용하여 에틸렌 화합물 사이 반응을 통해 고분자(polymer)를 생성할 수 있으며 이를 폴리에틸렌이라 한다. 폴리에틸렌 합성을 위한 단위체(monomer)로 에틸렌을 사용하듯이 폴리프로필렌(polypropylene, PP), 폴리스타이렌(polystyrene, PS), 폴리염화비닐(polyvinyl chloride, PVC) 등의 고분자를 합성하기 위해서는 반드시 분자 내 이중 결합을 갖는 단위체를 활용해야 한다.
이중결합은 탄소=탄소 외에 질소=질소 사이에서도 가능한데 분자 내 이웃한 질소 원자 사이 이중 결합을 갖는 화합물을 통칭하여 아조 화합물(azo compound)이라 한다. 안정한 탄소=탄소 결합과 달리 질소=질소 이중 결합은 다소 불안정한데 이는 분자 내 C–O–O–C 결합을 갖는 과산화물(peroxide)이 산소 원자의 비공유 전자쌍의 반발로 인해 산소 원자 사이 단일 결합이 강하지 않아 안정하지 못한 현상과 비슷하게 이해할 수 있다. 산소 분자(O=O)의 이중 결합 또한 앞서 언급된 N=N 이중 결합과 비슷한 이유로 결합이 예상보다 강하지 않다. O–H의 평균 결합 해리 에너지는 467 kJ/mol인데 반하여 O=O의 결합 해리 에너지는 498 kJ/mol로써 큰 차이가 나지 않는다. 이처럼 예상보다 낮은 산소 분자의 결합 해리 에너지는 생명체의 호흡에서 결정적인데, 만약 O=O의 결합 해리 에너지가 800 kJ/mol 정도로 컸다면 이중 결합을 깨기가 어렵게 되고 그렇게 된다면 인류를 비롯한 생명체들은 호흡을 통해 얻은 산소 분자를 활용한 체내 산화 반응에서 얻어지는 에너지를 얻을 수 없어 생명을 유지할 수 없게 될 것이다. 안정한 탄소와 산소 사이의 이중 결합(C=O, 카보닐(carbonyl)이라 함)은 아미노산, 지방산, DNA의 염기 등 생체 화합물에서 매우 중요한 역할을 한다. 예컨대 DNA 이중 나선을 유지하는 염기쌍의 수소 결합에서 한 염기에 들어있는 –C=O의 산소 원자는 음의 부분 전하를 갖고, 이웃한 염기가 포함하는 –NH2의 수소 원자는 양의 부분 전하를 가져 둘 사이 쿨롱 힘(Coulomb force)에 의해 수소 결합이 이루어져 이중 나선 구조가 유지된다.
원자가 결합 이론(valence bond theory)을 통한 이중 결합의 이해[편집]
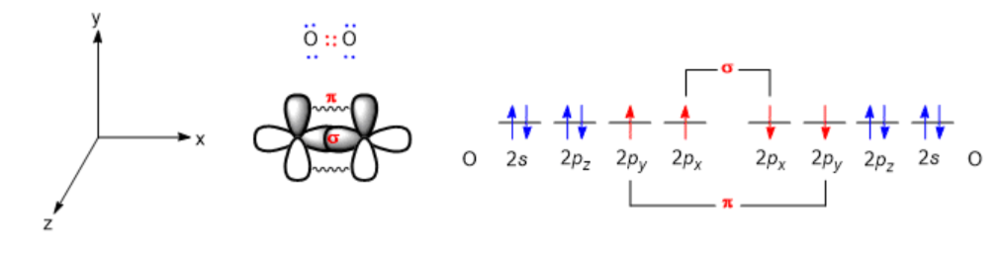
원자가 결합 이론에서 공유 결합이란 결합에 참여하는 두 원자 사이 홀전자 오비탈의 겹침으로 설명할 수 있으며, 이러한 홀전자 오비탈 사이 겹침은 크게 두 가지 방식이 있다. 하나는 시그마(σ) 결합이며 다른 하나가 파이(π) 결합으로 각 결합에 대한 좀 더 자세한 내용은 물리 화학 분야에서 설명하는 위키(원자가 결합 이론) 내용을 참고하도록 하자. 따라서 이중 결합은 곧 홀전자 간 오비탈 겹침 두 개를 의미하며 이때 홀전자 사이 오비탈 겹침에 따른 하나의 결합은 시그마 결합, 홀전자 사이 오비탈 겹침에 따른 또 다른 결합은 파이 결합이다. 산소 분자(O₂)를 예로 살펴보면 다음과 같다. 두 개의 산소 원자가 x 축 선상으로 서로 가까이 접근할 때, 산소 원자의 2px 홀전자 오비탈 사이 겹침을 통한 결합이 발생하며 이 결합은 시그마 결합이다. 이와 동시에 두 산소 원자의 2py 홀전자 오비탈 사이에서도 오비탈 겹침을 통한 결합이 발생하는데 이 결합은 파이 결합이다. 이처럼 모든 이중 결합은 하나의 시그마 결합과 하나의 파이 결합으로 이루어진다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원