질산
질산(窒酸, nitric acid, HNO₃)은 무색의 액체로, 부식성과 발연성이 있는 산성 물질 중 하나로, 염산, 황산과 더불어 인지도가 가장 높은 3대 강산이다. 유기 화합물의 나이트로화에 쓰인다. 수용액 상에서 질산의 비율이 86%를 넘을 경우 발연질산(發煙窒酸)이라고 부른다.
질산은 비료, 염료 매개체, 폭발물 및 다양한 유기 화학 물질을 위한 무기 및 유기 질산염 및 니트로 화합물의 제조에 사용된다. 질산 증기에 지속적으로 노출되면 만성 기관지염이 발생할 수 있고 화학적 폐렴이 발생할 수 있다.
목차
역사[편집]
질산은 익명의 유럽 연금술사의 De Inventione Veritatis에서 처음 언급되었다. 여기서 초석, 백반, 파란 비트리올의 혼합물을 하소하여 얻는다고 되어 있다. 다시 13세기에는 알베르투스 마그누스가 초석과 흙을 가열함으로써 이를 마련한 뒤, 이것을 강수라고 부른 라몬 유이(Ramon Lull)가 이를 다시 언급하였다.
글로버(Glauber)는 진한 황산을 초석과 함께 가열함으로써 오늘날에 쓰이는 질산을 얻는 과정을 고안하였다. 여기에 산소가 포함되어 있음을 증명한 앙투안 라부아지에가 1776년에 결정한 것이 실체였고 1785년 헨리 캐번디시가 이에 대한 구성을 결정하여 습기찬 공기를 통해 전기 불꽃을 내보내며 합성하는 것을 입증하였다.
또한 질산은 구리나 은과도 반응할 정도로 산화력이 강하다는 점을 유용하게 써서 에칭과 같은 기법을 만들었지만, 이것이 악용되어 김영삼 질산테러 사건과 같은 테러에 쓰이기도 했다. 질산은 햇빛에 의해 분해 되므로 갈색병에 보관한다.
분자구조[편집]
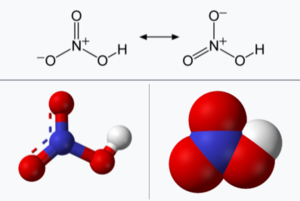
분자의 화학적 구조는 원자의 배열과 각 해당 원자들 간의 화학결합으로 결정된다. 질산 분자는 1 개의 수소 원자, 1 개의 질소 원자 그리고 3 개의 산소 원자로 구성되어 총 5 개의 원자로 형성된다. 질산 분자에는 총 4개의 화학결합이 있으며, 이는 3 개의 비수소결합, 2 개의 다중결합, 2 개의 이중결합 그리고 1 개의 수산기로 구성되어 있다.
특성[편집]
질산은 황산(H₂SO₄), 염산(HCl) 등과 함께 무기산(inorganic acid)으로 분류되는 강한 산이다. 순수한 질산은 무색이지만, 시간이 지나면서 질소 산화물과 물로 분해되어 노란색을 보이는 액체로 변한다. 질산의 질소 원자는 최대로 산화된 상태여서 산의 역할 뿐만 아니라 다른 물질을 산화시키는 산화제로 작용하기도 한다. 금속에 대해 강한 부식성을 보인다.
일반적으로 질산은 68% 수용액으로 판매되며, 질산 원액과 비율에 따라 물리적인 성질이 달라진다. 예를 들어 68% 수용액은 밀도 1.40 g/cm³이다. (98% 진한 질산의 경우 1.51 g/cm3)
질산은 열이나 빛에 의해 비교적 쉽게 물과 이산화 질소와 산소로 분해되는 성질을 가지고 있기 때문에, 보통의 경우 빛을 차단하는 갈색 병에 보관한다.
이때 발생하는 이산화 질소는 질산에 잘 녹고, 질산이 투명한 노란색을 갖도록 하며, 높은 온도에서는 적갈색을 보이도록 한다. 이는 발연 질산과 연결되는 질산의 성질이다.
4 HNO₃ + hv(자외선) → 4 NO₂ (g) + 2 H₂O + O₂
금속과의 반응[편집]
금속과 반응하면 수소 기체(H₂)와 질산염(NO₃⁻)을 형성한다.
마그네슘과의 반응[편집]
Mg + 2 HNO₃ → 2 Mg(NO₃)₂ + H₂ (g)
망가니즈와의 반응[편집]
Mn + 2 HNO₃ → 2 Mn(NO₃)2 + H₂ (g)
구리와의 반응[편집]
3 Cu + 8 HNO₃ → 3 Cu²⁺ + 2 NO + 4 H₂O + 6 NO₃⁻
제법[편집]
실험실에서는 질산 나트륨이나 초석(질산 칼륨)에 진한 황산을 가한 뒤 가열하여 얻는다.
2 NaNO₃ + H₂SO₄ → 2HNO₃ + Na₂SO₄
2 KNO₃ + H₂SO₄ → 2HNO₃ + K₂SO₄
공업적으로는 암모니아를 백금 촉매와 함께 산화시킨 후 물과 반응시켜 얻는다(오스트발트법 또는 암모니아 산화법).
4NH₃+ 5O₂ → 4NO + 6H₂O
2NO + O₂ → 2NO₂
3NO₂ + H₂O → 2HNO₃ + NO
질산 취급 시 주의사항[편집]
질산은 강한 산인 동시에 부식성이 있고, 매우 강한 산화제이기 때문에 취급시 매우 주의를 해야한다. 가장 직접적인 질산에 의한 피해는 피부 화상이며, 단백질과 지질 등을 모두 가수분해하여 손상시키기 때문에 노출되었을 때는 즉시 다량의 물로 충분히 씻어주어야 한다. 화상의 부위가 번지지 않도록 최소 10분 이상 지속적으로 씻어주어야 하며, 의사의 진찰을 받아야 한다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원