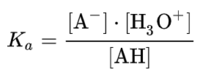"산 (화학)"의 두 판 사이의 차이
잔글 (→같이 보기) |
|||
| (같은 사용자의 중간 판 하나는 보이지 않습니다) | |||
| 113번째 줄: | 113번째 줄: | ||
* [[염산]] | * [[염산]] | ||
* [[화합물]] | * [[화합물]] | ||
| + | * [[산]] | ||
| − | {{ | + | {{화합물|검토 필요}} |
2022년 1월 30일 (일) 21:58 기준 최신판
산(酸, Acid)은 일반적으로 물에 녹았을 때에 pH가 7보다 낮은 물질을 말한다. 화학적으로는, 물에 녹았을 때 이온화하여 수소 이온 H⁺ 을 내놓는 물질을 말한다. 산은 전해질이고 일반적으로 신맛이 나며, 염기와 중화반응을 한다. 또한 수소보다 이온화 경향이 높은 금속과 반응하여 수소기체를 발생한다. 산의 대표적인 예로는, 강산인 염산(HCl), 황산(H₂SO₄), 질산(HNO₃), 약산인 아세트산(CH₃COOH), 탄산(H₂CO₃)이 있다.
개요[편집]
일반적으로 수용액 중에서 해리하여 수소이온을 생성하고 염기(鹽基)와 중화하여 염(鹽)을 만드는 물질이다. 예를 들면 염화 수소(HCl)을 물에 녹이면 해리하여 오늄 이온인 하이드로늄(옥소늄) 이온(H₃O⁺)을 생성하고 산이 되는 것을 뜻한다. 신맛의 원인이 바로 수소 이온/하이드로늄(옥소늄) 이온이다.
산에 대한 이러한 정의는 1903년 노벨화학상 수상자인 스반테 아레니우스가 내린 산의 정의이다. 이해하기 쉽다는 장점은 있지만, 범위가 확장되면 적용될 수 없다.
이와 같이 산에 대한 정의는 화학에 대한 연구가 진행되며 수정되고 범위가 계속 확장되어 왔다. 아래는 각각의 정의이고, 아래쪽으로 갈수록 최신 정의이다.
- 아레니우스 산염기: 일반적으로 알려진 산/염기 개념이다. 산이란 물에 용해되어 H⁺를 내는 화학종이다.
- 브뢴스테드-로우리 산염기 (1923년): 산이란 수소 이온을 잃는 화학종이다.
- 루이스 산염기 (1923년): 산은 전자쌍 받개이다. (경계 궤도함수 이론을 적용하면 HOMO와 LUMO를 적용하여 쓸 수도 있다.)
- 용매계 개념 (1950년대): 산이란 용매의 양이온을 형성하는 물질이다.
좁은 의미로는, 카복실기가 있는 화합물만을 뜻하기도 한다(접미사가 -산(-acid)이다). 이 경우 액성과는 무관하다.
물질을 잘 녹이는 성질이 있기 때문인지, 여러 매체에선 상당히 위험하거나 뭐든지 녹여버리는 만능 물질로 나오는 등 과장된 감이 있긴 하지만 위험하긴 하다. 약산이라도 질질 흘리고 다니면 어딘가를 부식시키니, 꼭 장갑을 끼고 퓸 후드 안에서 취급해야 한다.
그런데 인식과는 다르게 강염기가 강산보단 생명체한테는 훨씬 위험하다. 이유는 염기(화학) 문서 참조.
산이 인체에 닿게 되면 강한 탈수반응을 일으키는데, 대부분의 탈수반응은 발열을 동반하고, 이 때문에 화상을 입게 된다. 이 외에도 단백질의 수소와 산소를 물분자 형태로 흡수하면서 단백질 구조를 망가뜨리므로 2차적인 피해도 생길 수 있다. 더 나아가 불산 같은 경우는 더 깊숙히 침투해 뼈까지 녹일 수 있다.
산(Acid)라는 단어의 어원은 아랍의 연금술사 아부 바르크 알-라지가 금속을 녹이는 액체들을 'Acqua Acuta(날카로운 물)'이라고 지칭한 것에서 유래되었다.
화학적 성질[편집]
산 AH가 물에 녹으면서 반응하여 다음과 같이 이온화한다.
AH + H₂O ⇌ A⁻ +H₃O⁺
이때 산 해리상수는 이 반응의 평형 상태에서 정의된다.
강한 산일수록 큰 Ka 값을 가진다. 예를 들어 염산(HCl)의 Ka 값은 10⁷이다. 반대로 약산일 경우에는 작은 값을 가진다. 아세트산의 Ka 값은 1.8 × 10⁻⁵이다.
정의[편집]
아레니우스의 정의[편집]
1884년, 스웨덴의 화학자 스반테 아레니우스는 물에 녹였을 때 H⁺를 내놓는 물질을 산(acid)이라고 정의하였다. 하지만 산이 물에 녹을 때 물은 염기로 작용하여 양성자와 결합하기 때문에 물에서 하이드로늄 이온(H₃O⁺)을 형성하는 물질을 아레니우스 산의 더 나은 표현이라고 할 수 있다.
예;
HBr(aq) + H₂O(l) → H₃O⁺(aq) + Br⁻(aq)(이때 HBr은 아레니우스 산)
아레니우스 산염기 정의의 한계
- 수용액에서 일어나는 반응에서만 적용 가능하다.
- 수소이온은 수용액에서 홀로 존재하지 않는다. (물과 결합하여 하이드로늄 이온 H₃O⁺로 존재한다)
- 수용액에서 수소이온이나 수산화 이온을 내놓지 않는 물질에서는 적용할 수 없다.(염기성 물질인 암모니아를 물에 녹이면, 물에서 수소이온을 빼앗으므로 간접적으로 수산화 이온의 농도가 증가한다. 암모니아는 직접적으로 수산화 이온을 내어놓지 않는다. 아레니우스 정의에 의하면 암모니아는 염기가 아니다.)
브뢴스테드-로우리 정의[편집]
- 브뢴스테드-로우리 산과 염기
1932년 덴마크 화학자 브뢴스테드(Johannes Bronsted)가 제시한 방법으로 수소이온 H⁺를 내놓는 물질은 산, 수소이온 H⁺ 를 받는 물질을 염기라 정의하였다. 이때, 전자를 양성자 주개(proton donor) 후자를 양성자 받개(proton acceptor)라 부른다. 예컨대 아래와 같은 식의 경우 HA를 산, B를 염기라 한다. 마지막으로 이때 산과 염기의 관계를 짝산 짝염기 관계라고 하는데 이는 '짝산 ↔ 짝염기 + H⁺'의 관계를 가지는 물질이라고 말할 수 있으며 이 경우 HA와 B의 관계이다.
HA+B→HB+A
- 브뢴스테드-로우리 산과 염기가 제시된 배경
아레니우스 정의가 효율적이라 할지라도 그 범위 내에서는 정의할 수 없는 경우들이 있다. 아래와 같은 경우가 있다.
CH₃COOH + H₂O→CH₃COO⁻ + H₃O⁺
CH₃COOH + NH₃→CH₃COO⁻ + NH₄⁺
첫번째 경우 아레니우스 산 염기 정의로도 브뢴스테드-로우리 염기 정의 모두로 아세트산이 산임을 쉽게 알 수 있다. 하지만 두 번째 경우를 보면, 반응을 통해 하이드로늄 이온(hydronium ion)이 발생하지 않았으므로 이를 아레니우스 산이라 부를 수는 없다. 이와 같이 비 수용성 용액에서의 반응이나 기체상에서 나타나는 반응에 대해서는 아레니우스 산 염기 정의를 통해 설명할 수 없다. 따라서 브뢴스테드-로우리 산 염기 정의를 도입하여 위와 같은 문제를 해결하였다.
루이스의 정의[편집]
1923년, 미국의 화학자 길버트 뉴턴 루이스는 양성자(H⁺)와 수산이온(OH⁻)의 반응을 새로운 관점으로 바라볼 것을 주장하였다. 수산이온은 비공유 전자쌍 3쌍을 가지고 있는데, 양성자는 전자쌍 한쌍을 받으며 수산이온과 결합을 한다. 루이스는 이렇게 결합을 하기 위해 전자쌍을 받는 물질을 산이라 정의하였다. 이 정의는 수소이온이 들어있지 않은 다른 반응에서도 쓰일 수 있다.
이때 루이스 산과 루이스 염기가 형성하는 결합을 배위 결합 또는 배위 공유결합이라고한다. 배위 공유결합이란 두 원자가 공유 결합을 할 때, 공유전자쌍이 한 쪽의 원자에서 유래하여 결합된 경우를 말한다.
BF₃ + NH₃
한편 금속이온은 전자가 부족하며, 원자가 오비탈이 비어있기에 대게 루이스 산으로 작용한다. 이때 금속이온(루이스 산)과 루이스 염기가 결합하여 착이온을 형성한다.
양성자의 유무가 산의 정의에 핵심적인 요소였던 아레니우스 정의와, 브뢴스테드-로우리 정의와 달리, 루이스 정의는 반응 과정 중 전자쌍을 받는 모든 물질을 산이라 정의하여 산의 범위를 한층 넓혔다.
산 염기 정의 번호 산 염기 Arrhenius 수용액 상에서 H⁺를 내놓는 물질 수용액 상에서 OH⁻를 내놓는 물질 Brønsted–Lowry H⁺를 내놓는 물질 H⁺를 받는 물질 Lewis e⁻를 받는 물질 e⁻를 내놓는 물질
산의 성질[편집]
- 산을 영어로는 acid라 말하는데 이는 시큼하다는 라틴어 단어인 'acidus'을 어원으로 한다. 이와 같이 시큼한 맛이 나는 음식에는 산이 들어 있다. 예컨대 레몬, 귤, 석류 등의 과일에는 구연산(citric acid)이 들어있으며, 식초에는 아세트산이 들어있으며. 탄산음료에는 탄산이 들어 있어 있어 시큼한 맛을 낸다.
- 산은 금속들과 반응하여 수소 기체를 발생시키며 탄산염 물질과 반응하여 이산화 탄소를 발생시킨다. 대표적인 반응식은 다음과 같다.
- 2HCl(aq)+Mg(S)→MgCl₂(aq)+H₂(g)
- 2HCl(aq)+CaCO₃(S)→CaCl₂(aq)+H₂O(l)+C0₂(g)
- 산은 금속의 녹과 부식을 제거한다. 위와 같은 과정은 자동차 전지의 베터리의 전해질로 사용되기도 한다.
- 산은 방부제 역할을 하기도 하는데, 그 예로는 식초에 들어 있는 아세트산이나 피클에 들어있는 구연산등이 있다,
- 산은 염기성 물질과 반응하여 염을 생성하고 수용성 산 용액에서 산은 전해질로서 작용해 전기를 통하게 한다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원