|
|
| (다른 사용자 한 명의 중간 판 하나는 보이지 않습니다) |
| 1번째 줄: |
1번째 줄: |
| − | [[파일:염화수소의 화학구조.jpg|썸네일|300픽셀|염화수소의 화학구조]] | + | [[파일:염화수소 화학구조.jpg|썸네일|300픽셀|염화수소의 화학구조]] |
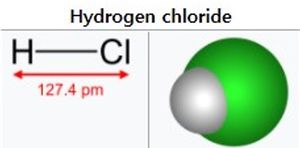
| | '''염화수소'''(hydrogen chloride, 화학식: HCl)는 상온, 상압에서 자극적인 냄새가 나는 무색의 유독 [[기체]]이다. 염화수소 [[수용액]]은 [[염산]]이며 가장 널리 이용되는 강한 산(酸) 중의 하나이다. | | '''염화수소'''(hydrogen chloride, 화학식: HCl)는 상온, 상압에서 자극적인 냄새가 나는 무색의 유독 [[기체]]이다. 염화수소 [[수용액]]은 [[염산]]이며 가장 널리 이용되는 강한 산(酸) 중의 하나이다. |
| | | | |
| 43번째 줄: |
43번째 줄: |
| | * 〈[https://namu.wiki/w/%EC%97%BC%EC%82%B0 염산]〉, 《나무위키》 | | * 〈[https://namu.wiki/w/%EC%97%BC%EC%82%B0 염산]〉, 《나무위키》 |
| | == 같이 보기 == | | == 같이 보기 == |
| − | *[[염산]] | + | * [[염소]] |
| | + | * [[수소]] |
| | + | * [[염산]] |
| | | | |
| − | | + | {{화합물|검토 필요}} |
| − | {{소재|검토 필요}} | |
2022년 1월 30일 (일) 22:13 기준 최신판
염화수소(hydrogen chloride, 화학식: HCl)는 상온, 상압에서 자극적인 냄새가 나는 무색의 유독 기체이다. 염화수소 수용액은 염산이며 가장 널리 이용되는 강한 산(酸) 중의 하나이다.
물리적 성질[편집]
- 화학식: HCl
- 분자량: 36.46g/mol
- 녹는점: -114℃
- 끓는점: -84℃
- 비중: 1.268 (기체)
- 비열용량: 0.7981J/(g·K)
- 용해도: 720g/L (20℃)
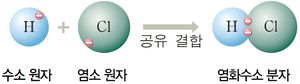
염화수소는 염소 원자와 수소 원자가 공유 결합한 화합물이다. 염소 원자의 전기음성도는 수소보다 훨씬 크기에 염화수소 분자는 강한 극성을 띄게 된다.
염화수소는 물에 잘 용해되며 부피로 500배, 무게로는 100g(20°C)의 물에 72g 녹는다. 알코올·에테르·벤젠 등 유기용매에도 잘 녹는다.
염화수소는 산의 특성을 강하게 지니므로, 인체에 매우 유해하며 습한 환경에서는 습기에 염화수소가 녹아 염산이 생성될 수 있으므로 주의해야 한다.
공업적으로는 염소와 수소를 반응시켜 만들며, 각종 탄화수소를 염소화할 때 부산물로도 얻고 있다. 실험실에서는 진한 황산에 진한 염산을 떨어뜨려 발생시키거나, 식염과 진한 황산을 반응시켜서 만든다.
만하임 공법: 염화나트륨과 진한 황산을 반응시켜서 만드는 방법이다.
2NaCl + H₂SO₄ → Na₂SO₄ + 2HCl
직접 반응: 염화나트륨 수용액을 전기분해하여 수소와 염소를 생성한 다음 이를 직접 반응시켜서 염화수소를 생성하는 방법이다.
H₂ + Cl₂ = 2HCl
유기적 합성: 테플론, 프레온, PVC 등 염소가 들어있는 유기화합물을 이용해서 염산을 제조하는 방법이다.
고순도 HCl[편집]
고순도 HCl은 반도체 웨이퍼를 세정하거나 웨이퍼를 깎는 식각 공정에서 식각액으로 사용되는 소재이다. 삼성전자가 한국 내 HCl 수요의 약 80%를 소비할 정도로 반도체 산업 사용량이 압도적이다.
그러나 고순도 HCl은 대부분 해외에 의존하며 일본 화학업체 토아고세이와 독일 산업 가스 전문업체 린데가 과점 공급했다.
국산화 필요성이 커지고 일본의 반도체·디스플레이 소재 수출 규제 이후 공급망 재편이 화두로 떠오르면서 삼성전자와 백광산업 협력이 빠르게 진행되여, 생산 준비까지 끝낸 상황이다. [1]
액상 염화수소 무수물은 염화비닐의 원료나 염산으로 사용된다.
참고자료[편집]
같이 보기[편집]
|
  이 염화수소 문서는 원소에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요. 이 염화수소 문서는 원소에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요.
|
| 산업 : 산업, 산업혁명, 기술, 제조, 기계, 전자제품, 정보통신, 반도체, 화학, 바이오, 건설, 유통, 서비스, 에너지, 전기, 소재, 원소 □■⊕, 환경, 직업, 화폐, 금융, 금융사, 부동산, 부동산 거래, 부동산 정책, 아파트, 건물, 토지
|
|
|
| 원소
|
갈륨 • 경수소 • 구리 • 규소 • 금 • 금속 • 금속이온 • 나트륨(소듐) • 나트륨이온 • 납 • 네오디뮴 • 네온 • 니켈 • 동소체 • 동위원소 • 라돈 • 라듐 • 란타넘 • 란타넘족 • 루비듐 • 루테늄 • 리튬 • 리튬메탈 • 리튬이온 • 마그네슘 • 망가니즈(망간) • 바나듐 • 바나듐이온 • 방사성 동위원소 • 백금 • 베릴륨 • 붕소 • 브로민 • 비소 • 비철금속 • 사마륨 • 산소 • 삼중수소 • 세슘 • 셀레늄 • 수소 • 수소이온 • 수은 • 스칸듐 • 아르곤 • 아연 • 아연이온 • 아이오딘(요오드) • 악티늄 • 악티늄족 • 안정 동위원소 • 알루미늄 • 염소 • 오가네손 • 우라늄 • 원소 • 원자 • 은 • 인 • 저마늄(게르마늄) • 전이금속 • 전이후금속 • 제논 • 족 • 주기 • 주기율표 • 주석 • 준금속 • 중금속 • 중수소 • 지르코늄 • 질소 • 철 • 초우라늄 • 카드뮴 • 칼륨(포타슘) • 칼슘 • 코발트 • 코페르니슘 • 크로뮴(크롬) • 크립톤 • 타이타늄(티타늄) • 탄소 • 탄소-14 • 텅스텐 • 토륨 • 팔라듐 • 플루오린 • 플루토늄 • 할로젠(할로겐) • 핵종 • 헬륨 • 헬륨3 • 황
|
|
|
| 화합물
|
LNO • pH • 갈륨비소 • 강 • 강철 • 경수 • 고분자 • 공유결합 • 과산화수소 • 과산화은 • 그래핀 • 금속결합 • 금속산화물 • 뉴세라믹 • 단백질 • 단일결합 • 두랄루민 • 디메틸 카보네이트 • 리튬 니켈 산화물 • 리튬산화물 • 리튬인산철 • 리튬 코발트 산화물 • 리튬 티타늄 산화물 • 메탄올 • 메탈실리콘 • 메테인 • 무기화합물 • 무쇠(주철) • 무수수산화리튬 • 물 • 반응식 • 벤젠 • 분자 • 분자량 • 분자식 • 불소 • 불화리튬(플루오린화 리튬) • 불화수소 • 붕산리튬 • 뷰텐(부틸렌) • 비금속 • 산 • 산성 • 산화물 • 산화은 • 산화제 • 산화철 • 산화칼슘 • 산화코발트 • 삼중결합 • 삼중수 • 선철 • 설탕 • 세라믹 • 셀룰로이드 • 소금 • 수산화나트륨 • 수산화니켈 • 수산화리튬 • 수산화물 • 수산화아연 • 수산화이온 • 수산화칼륨 • 수산화칼슘 • 수산화코발트 • 수증기 • 순물질 • 순철 • 실리카(이산화규소) • 실리콘 (규소) • 실험식 • 아미노산 • 아세테이트 • 아세트산 • 아세틸렌 • 아이소프렌(이소프렌) • 아크릴로나이트릴 • 알칼리 • 알칼리성 • 알코올 • 암모니아 • 얼음 • 에탄올 • 에테인 • 에틸렌 • 에틸렌 카보네이트 • 연철 • 염 • 염기 • 염기성 • 염산 • 염화나트륨 • 염화마그네슘 • 염화비닐라이덴 • 염화수소 • 염화칼륨 • 염화칼슘 • 올레핀 • 옹스트롬 • 요소 • 요소수 • 유기화합물 • 유리탄소 (free carbon) • 유리탄소 (glassy carbon) • 이산화망가니즈 • 이산화탄소 • 이산화티타늄 • 이소부틸렌(아이소뷰텐) • 이오노머 • 이온결합 • 이중결합 • 인산 • 인산리튬 • 인산염 • 인산철 • 인조흑연 • 일산화탄소 • 전기화학반응 • 중수 • 증류수 • 질산 • 질산나트륨 • 질산염 • 질산칼륨 • 질화리튬 • 질화물 • 천연흑연 • 청동 • 초분자 • 카르빈 • 카보네이트(탄산염) • 카본블랙 • 탄산 • 탄산나트륨 • 탄산리튬 • 탄산에틸렌 • 탄산이온 • 탄산칼륨 • 탄산칼슘 • 탄소강 • 탄소나노튜브 • 탄소화합물 • 탄화규소 • 탄화수소 • 특수강 • 페놀 • 페라이트 • 페로브스카이트 • 폴리부틸렌 • 폴리아미드 • 풀러렌 • 프로포폴 • 프로필렌 • 하이니켈 • 합금 • 홑원소물질 • 화학 • 화학결합 • 화학반응 • 화학반응식 • 화학식 • 화합물 • 환원제 • 황동 • 황산 • 황산니켈 • 황산망간 • 황산코발트 • 황화리튬 • 황화물 • 흑린 • 흑연
|
|
|
| 위키 : 자동차, 교통, 지역, 지도, 산업, 기업, 단체, 업무, 생활, 쇼핑, 블록체인, 암호화폐, 인공지능, 개발, 인물, 행사, 일반
|
|

 위키원
위키원