"라듐"의 두 판 사이의 차이
(새 문서: 썸네일|300픽셀|'''라듐'''(Radium) 파일:라듐의 전자껍질 (2, 8, 18, 32, 18, 8, 2).png|썸네일|300픽셀|준위별 전자 수(2, 8, 18, 32, 18,...) |
잔글 (→같이 보기) |
||
| (다른 사용자 한 명의 중간 판 하나는 보이지 않습니다) | |||
| 53번째 줄: | 53번째 줄: | ||
* [[삼중수소]] | * [[삼중수소]] | ||
| − | {{ | + | {{원소|검토 필요}} |
2022년 2월 9일 (수) 00:06 기준 최신판
라듐(Radium)은 화학 원소로 원소기호는 Ra, 원자번호는 88이다. 알칼리 토금속에 속하는 원소 중에서 가장 무거운 원소이고 안정동위체는 존재하지 않는다.(천연상태에서는 4종류의 동위체가 존재한다.) 은과 같은 흰색 계통 금속으로 방사성이 매우 강하다. 26개 이상의 동위원소가 있는데, 모두 방사성을 띤다. 라듐은 주로 우라늄과 토륨 광석에 미량 들어 있다. 프랑스의 물리학자인 퀴리 부부와 공동 연구자인 G. 베몽이 1898년에 우라늄 광석인 피치블렌드에서 라듐을 발견했다. 질량수는 226.025u, 녹는점 973K(700°C, 1292°F), 끓는점 2000K(1737°C, 3159°F), 밀도는 실온에서 약 5.5g/cm³이다. 덧붙여 라듐 224, 226, 228은 WHO의 하부기관 IARC에서 발암성이 있다고(Type1) 권고되고 있다.
목차
개요[편집]
7주기의 알칼리-토금속 원소인 라듐은 은백색의 고체 금속으로, 같은 족에서는 가장 무거우며, 동위원소는 방사성이 매우 강하다. 그중 가장 안정한 ²²⁶Ra은 1600년의 반감기를 가진다. 라듐이 붕괴할 때, 이온화된 라돈(Rn) 기체가 주 생성물로 발생하며, 이 기체는 형광을 띠는 화학 물질을 자극하여 방사성을 유발할 수 있다. 라듐은 주로 우라늄과 토륨 광석에 미량 포함되어 있는데 특히 우라늄 광석 1톤에 7g 정도 포함되어 있을 정도로 지구상에서 매우 희귀한 금속이다. 소량의 라듐은 액체 상태 염화 라듐(RaCl₂)의 전기 분해를 통해 제조할 수 있다. 방사능 및 화학 반응성으로 인하여 인체에 매우 유해하며, 몸에 흡수되면 칼슘처럼 뼈에 쌓인다. 이로 인해 방출하는 방사선은 뼈의 골수에 충격을 주고 적혈구를 만드는 조직을 파괴하며 뼈에 암세포를 만들기도 한다. 라듐을 발견한 마리 퀴리 부인의 사망도 실험 과정에서 쬔 방사선에 의한 피복이 주된 원인이었다.
라듐의 발견과 분리 및 IUPAC 원소 이름과 기호[편집]
라듐은 1898년 12월 21일에 염화 라듐(RaCl₂)의 형태로 퀴리 부부에 의해 발견되었다. 그들은 피치블렌드라고도 불리는 우라늄 광석(uraninite)을 이용하여 연구하던 중 우라늄을 제거하고 남아있는 물질이 여전히 방사선을 방출한다는 것을 관찰하였다. 그 이후 퀴리 부부는 두 가지 성분으로 구성된 방사성 혼합물을 분리하였는데, 분리해낸 방사성 화합물의 특성이 바륨 화합물과 비교하여 용해도가 더 좋지 않다는 것을 제외하고는 다른 성질이 매우 유사하다는 것을 발견하였다. 이것은 그들이 방사성 화합물을 분리하고 그 화합물 내에 포함된 새로운 원소인 라듐을 발견하게 되는 계기가 되었다. 결과적으로 퀴리 부부는 피치블렌드 10톤으로부터 극소량의 라듐 화합물을 추출하고 5일 후인 1898년 12월 26일에 프랑스 과학 한림원(French Academy of Sciences)에 그 발견을 보고하였다.
라듐 발견 4년 후인 1902년에 피에르 퀴리가 불의의 사고로 사망했지만, 마리 퀴리는 라듐에 대한 연구를 계속 진행하였으며, 순수한 라듐은 1910년 9월 그들의 제자 드비에르느(André-Louis Debierne,)에 의해 발견되었다. 그는 수은 음극을 이용하여 염화 라듐 수용액을 전기 분해해서 라듐-수은 아말감(amalgam)을 제조한 후, 수소 기체 하에서 가열하여 수은을 제거하여 라듐을 순수하게 얻었다. 같은 해에 올러(E. Eoler)는 아자이드화 라듐(Ra(N3)2)을 열분해하여 순수한 라듐을 분리하기도 했다.
20세기 초반 벨기에의 광물 회사(Union Minière du Haut Katanga, UMHK) 자회사인 비라코(Biraco)에서 순수한 라듐이 산업적으로 처음 생산되었다. 이 원소는 어두운 곳에서 푸른 빛을 발광했기 때문에 '빛을 발산한다'라는 뜻의 라틴어 'Radius'에서 유래하여' Radium'으로 명명하였으며, 그 원소 기호는 'Ra'이다.
라듐의 동위원소[편집]
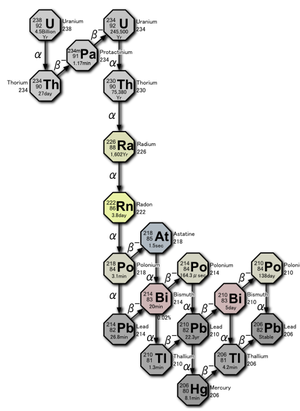
라듐은 대기 중에 극소량 존재하기에 평상 시에는 위험할 정도의 양을 흡수할 일은 거의 없으며 우라늄의 방사성 붕괴로 인하여 자연에서 끊임없이 생성된다. 라듐은 원자량 202~234 사이의 33개 동위원소를 가지고 있으며, 모두 방사성 원소이다. 우라늄의 동위원소 중에서 가장 무거운 ²³⁸U의 방사성 붕괴가 일어나는 동안 알파 및 베타 입자 그리고 감마선의 형태로 방사선이 나오게 되는데, 이 과정에서 ²³⁸U은 ²³⁴U가 되고 이는 다시 ²³⁰Th으로 알파 붕괴하여 ²²⁶Ra으로 바뀐다. ²²⁶Ra은 연속적으로 알파 입자를 방출하면서 ²²²Rn과 ²¹⁸Po을 거쳐서 납으로 바뀌게 된다. 그 이후 계속적인 알파 및 베타 붕괴를 통하여 다양한 원소로 변하는 과정을 거치게 된다.
라듐의 동위원소 중에서 ²²³Ra는 11.4일, ²²⁴Ra는 3.64일, ²²⁶Ra는 1600년, ²²⁸Ra는 5.75년의 반감기를 각각 가진다. 자연에 존재하는 라듐은 계속해서 붕괴하기 때문에 비교적 농도가 낮다. 특히 라듐의 동위원소 중에서 가장 안정한 원소인 ²²⁶Ra는 알파 붕괴하여 라돈이 되었다가 최종적으로 안정한 납의 동위원소로 된다. 2013년 ²²⁴Ra의 핵은 배 모양의 비대칭 형태로서는 첫 번째 발견이었다.
라듐의 물리 화학적 성질[편집]
라듐은 은과 유사한 흰색 계통의 무른 금속이다. 밀도는 상온에서 약 5.5g/cm³이며, 녹는점은 700℃, 끓는점은 1737℃이다. 바륨 및 다른 2족 원소와 마찬가지로 표준 상태에서 체심 입방 결정 구조를 형성하며, 이때 구조 내 라듐 원자간 거리는 5.15 Å이다.
라듐은 같은 족에 속하는 바륨과 유사하게 반응성이 높으며 항상 +2의 산화 상태를 가진다. Ra²⁺은 수용액에서 무색이고 염기성을 나타내며, 대부분의 라듐 화합물은 이온 결합성 화합물이다. 강력한 방사선을 내놓기 때문에 위험한 원소이며 인체에 매우 해롭다. 산소로부터 표면을 보호하는 얇은 산화물층으로 덮여 있으며, 이 층은 마그네슘의 산화물층보다 얇다. 공기 중에서의 반응성은 마그네슘보다 크며, 공기 중에 노출되면 산소보다 질소와 쉽게 반응하여 질화 라듐(Radium nitride, Ra₃N₂)의 검은색 표면층을 형성한다. 또한 분홍색의 불꽃을 내며 연소한다.
라듐의 용도와 방사 화학[편집]
라듐은 1900년대 중반 손목시계와 괘종시계의 시곗바늘과 숫자의 도색용 페인트로 사용되었다. 이 페인트는 라듐 화합물과 인광체로 구성되어 있어서 어두운 곳에서 빛을 냈다. 1950년대 중반까지 암 치료 등의 핵의학 분야에서 널리 사용되었고, 앞서 언급하였듯이 시계나 측정 기기의 눈금판이나 문자판에 쓰이는 형광 페인트의 주요 성분이었다. 그러나 흡입이나 섭취 또는 신체 노출 시, 암과 다른 병들의 원인이 된다는 것이 알려져, 현재는 의료 부문과 공업적으로 라듐 대신 ⁶⁰Co 과 ¹³⁷Cs와 같은 더 안전하고 값싼 방사성 물질을 사용하고 있다. 또한 산업적 용도로써 라듐은 결함이 있는 금속 부품을 검사하기 위한 방사선 촬영 장치의 방사선원으로도 사용되고 있다.
방사 화학(radiation chemistry) 분야에서도 방사성의 라듐이 활발하게 이용되었다. 특히, 마리 퀴리는 라듐을 암 연구와 치료 등에 활용하는 목적으로 하는 '라듐 연구소(Radium Institute)'의 설립을 준비하던 중 제1차 세계대전이 발발하자, X-선 장비와 라듐의 방사성 붕괴에서 나오는 라돈 기체를 이용하여 부상병 치료에 사용하였다. 그 이후, 그녀는 1932년에 자신의 고향인 폴란드 바르샤바에도 라듐 연구소를 설립하였는데, 이 연구소는 현재 폴란드의 암 연구 및 치료 분야에서 주도적인 역할을 하고 있다. 또한, 1919년 전쟁이 끝난 후 파리 대학과 파스퇴르 연구소는 공동으로 '퀴리 연구소(Curie Institute)'를 설립하여 현재까지도 생물리학, 세포 생물학, 종양학 연구를 계속 수행하고 있으며, 방사성 암 치료 병원을 운영하고 있다.
라듐으로 인한 피해 사례[편집]
라듐을 오용하다가 피해를 입은 사람들이 차차 늘어났고 그들은 퀴리 부부에게 자신들의 사연을 호소했다. 피에르 퀴리는 마차 사고로 죽었지만, 그 이전에 이미 라듐이 해로운지 아닌지를 증명하려고 자신의 팔에 라듐 결정을 끈으로 묶어 고정시켜 피부에 궤양이 생기는 것을 확인하기도 했다. 마리 퀴리 또한 위에도 나오다시피 방사선 장애로 인한 병으로 죽었다. 또, 이 두 사람의 스승인 앙리 베크렐은 퀴리 부부로부터 받은 정제된 피치블렌드 광석을 윗 옷 앞주머니에 기념품처럼 가지고 다니다가 역시 종양으로 죽었다. 피에르가 자신의 몸에 실험한 것도 이 사건 이후의 이야기다. 이러니 앞서 말한 라듐 웰빙 유행은 지금 생각하면 정말 경악하고도 남을 일이다.
라듐이 인체에 악영향을 끼친다는 것이 본격적으로 사회에 알려진 것은 1925년 시계의 도장 공장에서 일어난 라듐 소녀들 사건에서부터였다. 라듐은 예전에 시계의 야광도료용으로 쓰였기 때문에 도장공들은 라듐에 항상 노출되어 있었고, 특히 문자판의 작은 점이나 선을 그리기 위해 붓을 핥아서 가늘게 만들어 수작업으로 도포하는 것이 보통이었다. 그래서 젊은 여성들로 구성된 도장공들이 차례차례 암에 걸리는 사건이 일어났다. '라듐 걸즈'라 불리던 그들은 기업에 소송을 제기했고, 이에 라듐의 위험성이 주목을 받게 되었다. 1939년 재판 결과, 1명에 10,000달러를 지불하기로 합의가 되었고 그들은 승소했다. 하지만 대부분의 원고는 소송한 보람도 없이 차례차례 방사능 후유증으로 사망했다고 한다. 이 사건 이후 작업 환경은 대폭 개선되었으며, 현재 이 분야의 야광도료는 삼중수소로 완전히 대체되었고, 축광식 야광 기술이 발달한 뒤로 라듐 야광도료는 사실상 사장되었다.
그리고, 위의 라듐 함유 생수 중 '라디돌(RADITHOR)' 이라고 써 있는 것은 실제 많은 양의 라듐과 토륨이 함유되어 있었고,이중 발암 유발제 비싼 값에 만병통치제로 팔려 나갔다.
에벤 바이어스 라는 부유한 사업가는 1927년 기차의 침대에서 떨어져 부상당한 후 의사의 권유에 의해 하루에 라디톨을 세 잔씩 마셨다. 이후 라디톨을 중단하기까지 약 3년의 시간이 걸렸는데 아래턱이 썩어 떨어져 나가고[16] 두개골에 구멍이 뚫렸으며 뇌종양이 생긴 후였다. 그 당시 '방사능 중독'으로 소개되었으나 실제로는 급성 방사능 중독은 아니고 암으로 인한 것이라 한다. 어찌됐건 라디톨에 포함된 라듐의 영향인 셈은 맞다. 1932년 3월 결국 숨을 거뒀으며 그 시신은 납으로 된 관에 담겨 매장되었다.
그런데 의외로 성황리에 운영되는 온천 중에도 물에 지각의 미량의 라듐 또는 라돈이 섞여서 약한 방사능이 나오는 온천이 있는데 이를 라듐천 (방사능천)이라고 한다. 한국에서는 수안보온천, 유성온천, 덕산온천, 해운대온천 등이 라듐천. 이게 무슨 미친 짓인가 하겠지만 소량의 스트레스는 몸에 좋을 수도 있다고 한다(소수 학설). 식물에 약간의 방사선을 쬐어 주면 오히려 잘 자란다거나 하는 연구 결과들이 있긴 하지만, 정설은 아니므로 너무 신뢰하지는 말 것. 어차피 저런 온천에 포함된 라듐은 미량이기 때문에 탕에 하루 종일 몇 년간 하루도 빠짐없이 들어가 있는 정도만 아니라면 걱정할 수준은 아니라고 한다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원