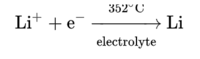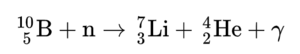"리튬"의 두 판 사이의 차이
잔글 |
잔글 (→참고자료) |
||
| (사용자 2명의 중간 판 7개는 보이지 않습니다) | |||
| 11번째 줄: | 11번째 줄: | ||
다른 알칼리 금속과 마찬가지로 칼로도 쉽게 잘릴 정도로 무르고 공기와 물과 잘 반응하며 공기 중 수분과도 반응한다. 그래서 금속 리튬은 석유에 담가서 보관해야 하는데 가벼워서 석유에도 뜨므로 끈끈한 바셀린 따위에 보관한다. 또는 아르곤 따위의 비활성 기체 속에 보관하기도 한다. 그래서 리튬 배터리를 삼키면 물과 반응해 몸 속에서 고열을 낼 수 있어 매우 위험하므로 얼른 응급실로 가야 한다. | 다른 알칼리 금속과 마찬가지로 칼로도 쉽게 잘릴 정도로 무르고 공기와 물과 잘 반응하며 공기 중 수분과도 반응한다. 그래서 금속 리튬은 석유에 담가서 보관해야 하는데 가벼워서 석유에도 뜨므로 끈끈한 바셀린 따위에 보관한다. 또는 아르곤 따위의 비활성 기체 속에 보관하기도 한다. 그래서 리튬 배터리를 삼키면 물과 반응해 몸 속에서 고열을 낼 수 있어 매우 위험하므로 얼른 응급실로 가야 한다. | ||
| − | + | ||
== 역사 == | == 역사 == | ||
리튬이 포함된 엽장석(葉長石, petalite)은 브라질의 학자인 조제 보니파시우 데 안드라다 에 시우바(José Bonifácio de Andrada e Silva)가 18세기 말에 발견하였다. 1817년, 스웨덴의 요한 아우구스트 아르프벳손(Johan August Arfwedson)은 우퇴 섬(Utö)에서 발견한 리튬휘석(spodumene, (LiAl[(SiO₃)₂])과 운모(雲母, K(Li,Al)₃[(Al,Si)₄O₁₀](F,OH)₂)를 분석하던 중 리튬의 존재를 확인하게 되었다. 1818년, 독일의 화학자 크리스티안 고틀로프 그멜린(Christian Gottlob Gmelin)은 리튬 염들을 가열하면 화염이 붉은 색으로 변한다는 것을 알아내었다. 이후 아르프벳손과 그멜린은 리튬을 광석에서 유리시키려는 시도를 했지만 성공하지 못했고, 대신 같은 해에 영국에서 윌리엄 토머스 브란드(William Thomas Brande)와 험프리 데이비(Sir Humphry Davy)가 산화 리튬(Li₂O)의 전기 분해를 통해 순수한 리튬을 얻는 데에 성공했다. | 리튬이 포함된 엽장석(葉長石, petalite)은 브라질의 학자인 조제 보니파시우 데 안드라다 에 시우바(José Bonifácio de Andrada e Silva)가 18세기 말에 발견하였다. 1817년, 스웨덴의 요한 아우구스트 아르프벳손(Johan August Arfwedson)은 우퇴 섬(Utö)에서 발견한 리튬휘석(spodumene, (LiAl[(SiO₃)₂])과 운모(雲母, K(Li,Al)₃[(Al,Si)₄O₁₀](F,OH)₂)를 분석하던 중 리튬의 존재를 확인하게 되었다. 1818년, 독일의 화학자 크리스티안 고틀로프 그멜린(Christian Gottlob Gmelin)은 리튬 염들을 가열하면 화염이 붉은 색으로 변한다는 것을 알아내었다. 이후 아르프벳손과 그멜린은 리튬을 광석에서 유리시키려는 시도를 했지만 성공하지 못했고, 대신 같은 해에 영국에서 윌리엄 토머스 브란드(William Thomas Brande)와 험프리 데이비(Sir Humphry Davy)가 산화 리튬(Li₂O)의 전기 분해를 통해 순수한 리튬을 얻는 데에 성공했다. | ||
| 56번째 줄: | 56번째 줄: | ||
또는 미지의 입자가 붕괴하면서 빅뱅 핵합성 시점의 온도나 중성자 농도를 바꾸었다는 가설도 있으며 미지의 입자가 원자핵과 속박된 상태를 만들면서 핵반응 단면적을 변화시켰다거나 비활성 중성미자가 관여했다는 가설도 있다. | 또는 미지의 입자가 붕괴하면서 빅뱅 핵합성 시점의 온도나 중성자 농도를 바꾸었다는 가설도 있으며 미지의 입자가 원자핵과 속박된 상태를 만들면서 핵반응 단면적을 변화시켰다거나 비활성 중성미자가 관여했다는 가설도 있다. | ||
| − | + | ||
== 리튬의 추출 == | == 리튬의 추출 == | ||
리튬을 포함하는 소금물에서 물을 증발시키고 탄산 나트륨을 첨가해 탄산 리튬을 얻는다. 이때 소금물을 리튬 함유량이 0.5%를 초과할 때까지 농축하며, 물에 잘 녹지 않는 탄산 리튬을 건져낸다. | 리튬을 포함하는 소금물에서 물을 증발시키고 탄산 나트륨을 첨가해 탄산 리튬을 얻는다. 이때 소금물을 리튬 함유량이 0.5%를 초과할 때까지 농축하며, 물에 잘 녹지 않는 탄산 리튬을 건져낸다. | ||
| 70번째 줄: | 70번째 줄: | ||
소금물은 부식성이 매우 강하기 때문에, 염화 리튬을 얻을 때 쓰는 도구들은 특수한 강철이나 니켈로 만들어진 것이어야 한다. 352 °C에서 녹게 되는 52%가 염화 리튬, 48%가 염화 칼륨으로 이루어진 공융(共融) 혼합물(eutectic mixture)을 물 대신 녹은 설탕을 전해물로 사용한 전기 분해로 순수 리튬을 유리한다. | 소금물은 부식성이 매우 강하기 때문에, 염화 리튬을 얻을 때 쓰는 도구들은 특수한 강철이나 니켈로 만들어진 것이어야 한다. 352 °C에서 녹게 되는 52%가 염화 리튬, 48%가 염화 칼륨으로 이루어진 공융(共融) 혼합물(eutectic mixture)을 물 대신 녹은 설탕을 전해물로 사용한 전기 분해로 순수 리튬을 유리한다. | ||
| − | [[파일:리튬추출.png|썸네일|200픽셀| | + | [[파일:리튬추출.png|썸네일|200픽셀|가운데|]] |
| + | |||
또는: | 또는: | ||
| − | [[파일:리튬추출2.png|썸네일|200픽셀| | + | |
| + | [[파일:리튬추출2.png|썸네일|200픽셀|가운데|]] | ||
전극전위가 더 높은 칼륨은 여기서 같이 분리되지 않으나, 미량의 나트륨이 섞이게 되며, 이는 리튬을 강한 반응제로 만든다. 이런 리튬은 유기화학용으로는 도움이 되나 리튬 전지용으로는 질이 떨어진다. 전해질의 표면에 모이는 액체 리튬은 전해전지에서 내보내기가 비교적 수월하다. 이외에도 염화 리튬을 피리딘 속에서 전기 분해하는 방법이 있으며, 실험실에서 시험하기에 적당하다. | 전극전위가 더 높은 칼륨은 여기서 같이 분리되지 않으나, 미량의 나트륨이 섞이게 되며, 이는 리튬을 강한 반응제로 만든다. 이런 리튬은 유기화학용으로는 도움이 되나 리튬 전지용으로는 질이 떨어진다. 전해질의 표면에 모이는 액체 리튬은 전해전지에서 내보내기가 비교적 수월하다. 이외에도 염화 리튬을 피리딘 속에서 전기 분해하는 방법이 있으며, 실험실에서 시험하기에 적당하다. | ||
== 속성 == | == 속성 == | ||
| + | === 물리적 속성 === | ||
| + | [[파일:리튬의 결정 구조, a=310 pm.png|썸네일|200픽셀|오른쪽|리튬의 결정 구조, a=310 pm]] | ||
| + | 리튬은 상온 상태에서는 가장 가벼운 [[고체]](밀도: 0,534 g/cm3)로 -260 °C에서 고체를 형성하는 수소만이 더 가볍다(밀도: 0,0763 g/cm3). 리튬은 다른 알칼리 금속과 마찬가지로 결정체로는 [[입방정계]] 형식의 구슬 모양을 이룬다. 알칼리 금속 중에서는 녹는점과 끓는점이 가장 높고, 제일 단단하기도 하지만, 모스 경도 0.6으로 자르는 것이 여전히 용이하다. 리튬 조각은 나이프로 쉽게 절단할 수 있다. 절단면은 은백색의 금속 광택을 가지나 곧 공기중의 산소와 수증기 따위에 의해 산화되며 검은색으로 변한다. 전도율과 열전도율은 높은 편이다(전도율: 구리의 18% 정도). | ||
| + | |||
| + | 리튬에는 마그네슘과 비슷한 점이 있다. 마그네슘은 6각형으로, 리튬은 정육면체 형태로 조합할 때 가장 조밀하지만, 어느 한도까지는 둘을 섞은 고용체(固溶體)를 만들 수 있다. 이런 고용체 내에서는 두 원소 중 수가 더 많은 쪽이 자신의 결정 격자(格子)를 관철시킨다. | ||
| + | |||
| + | 리튬 이온은 -520kJ/mol로 알칼리 메탈 중에서 가장 높은 수화 [[엔탈피]]를 가지고 있으며, 이로 인해 물 속에선 완전히 수화물이 되어 물 분자를 강하게 끌어들인다. 이때 리튬 이온은 주위에 두 개의 H2O 분자층을 형성하는데, 가까운 층은 4개의 물 분자로 이루어지고, 이 분자층은 수소 결합을 통해 바깥쪽의 다른 분자들과 다시 연결된다. 이렇게 수소화한 리튬 이온의 지름은 질량은 더 높지만, 수소 분자를 이만큼 세게 끌어당기지 않는 루비듐이나 세슘의 수소화 이온보다도 더 커진다. | ||
| + | |||
| + | 리튬 원소는 독자적으로 기체 형태로 변할 수 있고, 두 원자가 결합해 이중 리튬(Li₂) 형태의 기체를 이룰 수도 있다. 이중 리튬의 결합 길이는 267.3pm이며, 결합 에너지는 101 kJ/mol이다. 기체 상태의 리튬은 질량의 1% 정도가 이중 리튬을 형성한다. | ||
| + | |||
| + | === 화학적 속성 === | ||
| + | 리튬은 알칼리 금속 중에서 반응률이 가장 낮음에도 불구하고 여전히 매우 쉽게 반응하고, 열을 발산하면서 다종의 다른 원소들과 화합물을 이룬다. 상온 상태의 완전히 건조한 공기 내에서는 비교적 안정된 편이지만, 습도가 높으면 급격히 수산화 리튬(LiOH) 층을 형성하며, 상온 상태의 건조한 공기 내에서도 다른 알칼리 금속과는 달리 천천히 질소와 반응해 질화 리튬(Li₃N)을 형성한다. 물과 접촉하면 급격히 산화한다. | ||
| + | |||
| + | [[파일:리튱의 화학적 속성.png|썸네일|200픽셀|가운데|]] | ||
| + | |||
| + | Li⁺ 이온의 높은 전하 밀도와 그에 비례해 역시 높은 질화 리튬의 격자 에너지에 의해 이 반응이 가능하다. 리튬은 표준 환원 전위는 −3,04 V이며, 이는 모든 원소 중의 최저치를 기록한다. | ||
| + | |||
| + | 다른 알칼리 금속과 마찬가지로 공기를 구성하는 산소나 질소와의 반응을 막기 위해 등유 또는 파라핀유에 담구어 보관한다. 유리 앰플 안에 넣어 진공 또는 아르곤 대기 하에 보존할 수 있다. 그러나 다른 알칼리 금속 처럼 유리 앰플 안에서 용융시켜 보존할 수 없는데 리튬이 유리를 침식하기 때문이다. | ||
| + | |||
| + | 리튬과 마그네슘은 대각 방향 관계(diagonal relationship)를 이루며, 이들의 화합물 들에서도 역시 유사한 점을 발견할 수 있다. Li⁺와 Mg²⁺ 이온의 지름은 비슷하다. | ||
| + | |||
| + | 리튬은 나트륨과는 달리 부틸 리튬이나 메틸 리튬 등의 여 러 유기 금속 화합물을 이룰 수 있다. 거의 모든 유기리튬화합물은 대기와 격렬히 반응한다. 베릴륨과 알루미늄, 붕소와 규소 사이의 관계도 이와 유사하다. | ||
| + | |||
| + | == 동위 원소 == | ||
| + | 자연적으로는 안정된 원자인 ⁶Li(7.6%)와 ⁷Li(92.4%)가 존재하며, 반감기가 밀리초(ms) 범위에 드는 방사성의 다른 동위 원소는 인위적으로만 생산할 수 있다. | ||
| + | |||
| + | ⁶Li는 원자로에서 중수소와의 융합에 필요한 삼중수소의 원료로 쓰인다. 삼중수소는 원자로용 블랭킷(blanket)에서나 또는 수소 폭탄 내에서 헬륨이나 ⁶Li이 중성자로 쏘여 만들어진다. | ||
| + | |||
| + | [[파일:동위원소1.png|썸네일|300픽셀|가운데|]] | ||
| + | |||
| + | 이 외에도 | ||
| + | |||
| + | [[파일:동위원소2.png|썸네일|300픽셀|가운데|]] | ||
| + | |||
| + | ⁷Li을 이용한 핵반응도 가능하지만, 에너지 한도가 높은 탓으로 안전성 보장이 어려워지기 때문에 주로 쓰이지는 않는다. | ||
| + | |||
| + | ⁶Li는 리튬을 추출할 때부터 이미 핵융합용으로 따로 모으므로, 시중에서 구할 수 있는 리튬은 거의 순수한 ⁷Li이다. 두 동위 원소의 분리는 용해된 리튬 화합물(예로서 에탄올에 용해된 염화 리튬)과 리튬 아말감의 동위 원소 교환을 통해 이룰 수 있다. 이 분리를 통해 얻을 수 있는 ⁶Li의 양은 약 50% 정도이다. | ||
| + | |||
| + | 3단계 수소 폭탄 내에 ⁶Li뿐만 아니라 ⁷Li도 포함되어 있을 경우, 이는 핵융합에서 생기는 빠른 중성자들과 반응한다. 이때 ⁷Li는 에너지를 소비하지만, 동시에 만들어지는 또다른 중성자들과 헬륨, 삼중수소 등의 핵융합과 우라늄 핵분열의 증가로 인해 전체적으로 방출하는 에너지는 오히려 높아진다. 이는 1954년, ⁷Li를 포함한 캐슬 브라보(Castle Bravo)의 폭발력이 예상치의 2.5배에 달했던 것에서 볼 수 있었는데, 이 예상치는 원래 ⁷Li가 중성자와 반응을 일으키지 않을 경우를 가정한 수치였다. | ||
| + | |||
| + | ⁷Li는 원자력 발전소에서 붕소의 동위 원소 중 하나인 10B와 중성자의 핵반응을 통해서도 소량이 생산된다. | ||
| + | [[파일:동위원소3.png|썸네일|300픽셀|가운데|]] | ||
| + | |||
| + | ⁶Li과 ⁷Li는 둘 다 차가운 양자 기체(quantum gas)를 이용한 실험에 사용된다. 보스-아인슈타인 응축은 보손 동위 원소 ⁷Li로도 생성할 수 있다. | ||
| + | |||
| + | ⁶Li은 페르미온이며, 근래에 이 동위 원소로 구성된 이중 리튬의 분자를 초유체로 변형하는 것에 성공했다. | ||
| + | |||
| + | == 용도 == | ||
| + | 리튬의 대표적인 이용법으로 리튬 이온 배터리가 있다. 1990년대 후반부터 PC 등의 전자기기의 [[경량화]]가 진행되어 전지도 이에 따라 가볍고 대용량의 것을 추구하게 되었다. 그래서 등장한 것이 리튬이온 배터리이다. 이 전지는 종래 사용되던 니카드 전지, 니켈 금속수소 전지에 비해 아주 가볍고 대용량이며 현재는 거의 모든 휴대용 제품에 사용되고 있다. 하지만 2008년 이래 몇 년간 발화사고가 잇따라 리튬이온 전지의 안전성 기준이 까다로워지고 있다. 특히 리튬 계열 전지 및 리튬 계열 전지를 탑재한 전자기기의 항공기 수속이 점점 까다로워지고 있는 추세다. 리튬산화금속 전극을 합성할 때 [[코발트]]를 쓰는 경우 고온에 약하기 때문에 발화 가능성이 높아지며, 이는 [[망가니즈]]를 포함한 구조로 치환하면 어느 정도 해소가 가능하다. | ||
| + | |||
| + | 하지만 산업적으로 리튬을 가장 많이 이용하는 것은 따로 있는데, 바로 유리 산업이다. 모래 등 실리카 성분을 녹여 유리나 도자기를 만들 때 플럭스 용제로 탄산 리튬을 첨가해 융해점을 낮추고 점도를 낮춘다. 그리고 알루미늄과 리튬의 합금은 기존 두랄루민을 대체할 항공우주 재료로 각광받고 있다. | ||
| + | |||
| + | 한편 탄산리튬은 조울증 치료에도 쓰인다. 리튬이 조울증에 탁월한 효과가 있다는 게 밝혀진 후 대책이 없던 우울증으로 고통받던 수많은 환자들이 리튬을 도움을 받아 정상적 생활을 회복하는 등 가히 기적의 약으로 불리었다. 정신병도 뇌의 화학적 문제이며 약으로 극적으로 개선될 수 있다는 걸 보여서 정신병에 대한 사회의 부정적 인식을 완화시키는 데도 도움을 주었다. 2의 리튬은 조울증 치료제로 쓰이는 리튬에서 따온 것이다. 또 조울증에 관한 것 때문인지 리튬이 자살율과 밀접한 관계가 있다는 주장도 있다. 리튬을 복용한 사람이 일반인보다 자살할 확률이 13~14배 적다고. 중반부참조 또 호수나 지하수 등 수원의 자연적 리튬 농도와 그 지역의 자살률이 상당한 관계가 있다는 연구도 있다. 그래서 마치 수돗물에 미량의 염소를 넣어 식중독을 방지하고 또한 미량의 플루오린[5]를 넣어 충치를 예방하듯이 수돗물에 미량의 리튬을 넣어서 우울증을 예방하고 자살을 줄이자는 주장도 있다. 하지만 이게 정신적으로 영향을 미치기도 하고, 리튬의 효능이 나타나는 양과 독성이 나타나는 양이 비슷해 위험할 수 있다. 또 리튬은 반응성이 강해 순도가 높은 물질의 생산이 어려우므로 비싸서 도입은 힘들다. | ||
| + | |||
| + | 리튬은 또한 체내 타우물질의 인산화를 막기 때문에 알츠하이머성 치매의 증상을 완화하고 예방하는 데에도 제한적으로 쓰인다. | ||
| + | |||
| + | 중수소라고도 하는 [[트리튬]]을 생산하는 데 재료가 되기도 한다. 현대의 열핵폭탄은 삼중수소와 중수소의 핵융합 반응을 이용하는데 삼중수소는 매우 생산하기 어렵고 비싼 물질인데다가 불안정하여 일정 시기마다 재충전을 해야 하고, 냉각도 해줘야 하며 이는 많은 비용을 발생시킨다. 그래서 핵폭발 시 나오는 중성자를 이용해 삼중수소를 만들기 위해 리튬을 사용한다. 우라늄 핵폭발에서 발생한 중성자를 중수소화리튬 화합물에 쪼이면 리튬이 삼중수소로 변하고 그 삼중수소가 중수소와 핵융합 반응을 일으키는 것이다. 즉 리튬은 현대적 열핵폭탄의 재료이기도 한다. 삼중수소는 산업용으로는 원자로에서 리튬에 중성자를 조사해 소량으로 생산한다. | ||
| + | |||
| + | 핵폭탄에도 쓰였다. 캐슬 브라보의 폭발장치에는 40% 농축된 리튬이 포함되어 있다. | ||
| + | |||
| + | 그리고 개인용 컴퓨터의 메인보드 안에 들어가 있는, 흔히 [[수은전지]]라고 말하는 조그마한 3볼트 전지도 알고 보면 [[리튬전지]]다. | ||
== 참고자료 == | == 참고자료 == | ||
* 〈[https://namu.wiki/w/%EB%A6%AC%ED%8A%AC 리튬]〉, 《나무위키》 | * 〈[https://namu.wiki/w/%EB%A6%AC%ED%8A%AC 리튬]〉, 《나무위키》 | ||
* 〈[https://ko.wikipedia.org/wiki/%EB%A6%AC%ED%8A%AC 리튬]〉, 《위키백과》 | * 〈[https://ko.wikipedia.org/wiki/%EB%A6%AC%ED%8A%AC 리튬]〉, 《위키백과》 | ||
| + | * 김우현 기자, 〈[https://www.mk.co.kr/news/business/view/2022/02/189612/?utm_source=naver&utm_medium=newsstand 배터리 필수품 '하얀 석유' 이름값 했다…올해 들어 몸값 70%↑]〉, 《매일경제》, 2022-02-28 | ||
== 같이 보기 == | == 같이 보기 == | ||
* [[리튬이온]] | * [[리튬이온]] | ||
* [[리튬이온 배터리]] | * [[리튬이온 배터리]] | ||
| + | * [[리튬전지]] | ||
| − | {{ | + | {{원소|검토 필요}} |
2022년 2월 28일 (월) 20:44 기준 최신판
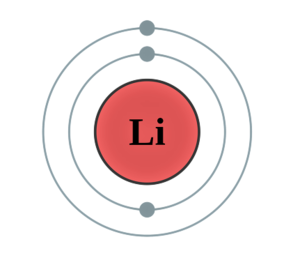
리튬(Lithium)은 알칼리 금속에 속하는 화학 원소로, 기호는 Li이고 원자 번호는 3이다. 돌을 뜻하는 그리스어 리토스(λίθος, líthos)에서 이름이 유래되었는데, 이유는 나트륨이나 칼륨과는 달리 광석에서 처음으로 발견했기 때문이다. 무르고 은백색이며 부식을 유발한다. 합금으로 열전달이나 전지 등에 사용할 수 있으며, 미네랄 오일에는 리튬 염의 형태로 첨가되어 있는 경우가 많다. 하얀 석유라고 불린다.
목차
개요[편집]
리튬은 가장 밀도가 낮은 금속 원소로, 원자번호 3번. 때문에 가장 가벼운 금속성 원소이다.
주기율표 제1족에 속하는 알칼리 금속의 하나로서, 원자량 6.941, 녹는점 180.54℃, 끓는점 1347℃, 비중 0.534을 갖는다. 알칼리 금속이기에 덩어리를 물에 넣으면 폭발적으로 반응한다.
1817년, 스웨덴의 화학자 아르프베드손은 페탈라이트(엽장석)의 화학분석에 의해 미지의 물질이 함유되어 있는 것을 발견했다. 그 후 불꽃 반응에 의해 새로운 원소 리튬의 존재가 명백해졌다. 리튬의 불꽃색은 짙은 빨간색이다.
다른 알칼리 금속과 마찬가지로 칼로도 쉽게 잘릴 정도로 무르고 공기와 물과 잘 반응하며 공기 중 수분과도 반응한다. 그래서 금속 리튬은 석유에 담가서 보관해야 하는데 가벼워서 석유에도 뜨므로 끈끈한 바셀린 따위에 보관한다. 또는 아르곤 따위의 비활성 기체 속에 보관하기도 한다. 그래서 리튬 배터리를 삼키면 물과 반응해 몸 속에서 고열을 낼 수 있어 매우 위험하므로 얼른 응급실로 가야 한다.
역사[편집]
리튬이 포함된 엽장석(葉長石, petalite)은 브라질의 학자인 조제 보니파시우 데 안드라다 에 시우바(José Bonifácio de Andrada e Silva)가 18세기 말에 발견하였다. 1817년, 스웨덴의 요한 아우구스트 아르프벳손(Johan August Arfwedson)은 우퇴 섬(Utö)에서 발견한 리튬휘석(spodumene, (LiAl[(SiO₃)₂])과 운모(雲母, K(Li,Al)₃[(Al,Si)₄O₁₀](F,OH)₂)를 분석하던 중 리튬의 존재를 확인하게 되었다. 1818년, 독일의 화학자 크리스티안 고틀로프 그멜린(Christian Gottlob Gmelin)은 리튬 염들을 가열하면 화염이 붉은 색으로 변한다는 것을 알아내었다. 이후 아르프벳손과 그멜린은 리튬을 광석에서 유리시키려는 시도를 했지만 성공하지 못했고, 대신 같은 해에 영국에서 윌리엄 토머스 브란드(William Thomas Brande)와 험프리 데이비(Sir Humphry Davy)가 산화 리튬(Li₂O)의 전기 분해를 통해 순수한 리튬을 얻는 데에 성공했다.
1855년, 로베르트 분젠(Robert Bunsen)과 오거스터스 매티슨(Augustus Matthiessen)은 염화 리튬(LiCl)의 전기 분해로 더 많은 양의 순수 리튬을 추출하는 방법을 터득했고, 1917년, 빌헬름 솅크(Wilhelm Schenk)는 유기 수은 화합물에서 최초의 유기 리튬 화합물을 합성했다. 1923년에는 독일 금속회사(Deutsche Metallgesellschaft, 오늘날의 GEA Group)가 염화 리튬과 염화 칼륨(KCl)의 용액을 전기 분해하는 방법을 사용해 리튬의 상업적 생산을 시작했다.
2차대전 직후까지 리튬은 대부분 윤활제로나 유리 공업에서만 쓰였는데, 미국이 리튬을 통해 획득할 수 있는 삼중수소를 수소 폭탄의 제조에 필요로 하게 되자 상황이 급변했다. 산출량은 급격히 증가했고, 노스캐롤라이나주의 킹스 마운튼(Kings Mountain)이 특히 중요한 산출 지역이 되었다. 삼중수소의 짧은 반감기를 의식했기 때문에 1953년부터 1963년까지 리튬은 대량으로 비축되었고, 이는 냉전이 끝난 1993년부터 시장으로 유통되기 시작했다.
2007년부터는 리튬 전지의 제조가 가장 중요한 용도로 정착되었으며[3], 소금물의 비교적 저렴한 생산이나 채광업에도 역시 중요한 역할을 한다.
존재[편집]
지각에서 리튬이 차지하는 비율은 0.0017%으로, 아연·구리·텅스텐·코발트보다는 적고 주석·납보다는 조금 더 많다. 주 생산국은 미국, 칠레, 호주, 캐나다, 중국 등인데, 볼리비아의 우유니 사막에 540만 톤이 매장되어 있다는 사실이 알려져 전세계의 관심이 집중되었다. 2010년에 치러진 2011 수능 화학 2에 문제로 출제되었다.
2010년대 초반 각축 끝에 한국에서 개발권을 따내는 데 성공했으나 계약 조건에 대한 이견으로 결국 무산되었다. 에보 모랄레스 볼리비아 대통령이 한 번 방한해서 국빈 대접을 받으며 개발 양해각서를 체결했다. 그런데 리튬을 생산하는 일은 볼리비아 정부에서 직접 하고, 외국 기업은 가공품인 리튬 전지 생산만을 허용할 거라고 한다. 게다가, 볼리비아는 내륙국가다. 볼리비아 정부는 처음부터 리튬채굴권을 외국에 넘겨줄 의사가 없다는 것을 명백히 밝혔는데, MB정부에서 된다고 무작정 밀어 붙였던 것으로 나타났다. 결국 계약 기간 종료로 자연스레 무산되고, 대신 중국이 참여하게 되었다.
한편, 체코에서는 2017년에 유럽 최대의 리튬광산이 폐광 지역이었던 치노벡에서 발견되어 세계 5위의 리튬 생산국이 될 예정이라고 한다.
2020년이면 지표상에 매장된 리튬이 고갈된다고 한다. 안 그래도 줄어들 예정인 리튬 생산량 중 20%만이 2차전지의 재료인 수산화리튬이라고 하여 2차전지의 수요가 갈수록 증가해가는 현실에 리튬을 대체할 신소재의 개발이 시급하다고 한다. 그래서 같은 족인 나트륨으로 전지를 만드려는 시도를 하고 있다. 또한 해수의 이온 중에서 리튬을 뽑아 올리는 연구도 진행 중이다.
이에 대한 반론으로 USGS 2017년 보고서에 따르면 확인된 미국 내 리튬 매장량은 690만 톤이며 미국 외 전 세계 리튬 매장량은 약 4천만 톤으로 추정된다. 역시 같은 리포트에서는 2016년 세계 리튬 소비량을 37,800톤으로 추정하고 있으며 이 생산량은 수요 증가에 따라 전년도(33,300톤) 보다 증가한 수치이다. 따라서 위에 언급된 2020년 리튬 고갈에 대해서는 해당 보고서의 오역에서 비롯된 오해라는 주장이 있다.
2017년 상반기를 기준으로 리튬의 가격이 3년 만에 4배가 넘게 폭등했다. 전기자동차 시장이 활성화되며 배터리의 수요가 폭발적으로 늘어나는 데에 따른 것인데, 최근 업계에서는 리튬을 '하얀 석유'로 부르고 있다고 한다(골드만 삭스, 자동차가 석유가 아닌 리튬배터리로 달리는 것을 비유해서 한 말이다). 이런 추세에 따라 국내에서는 포스코에서 국내 최초로 리튬 생산 공장을 세워 LG화학과 삼성SDI 등에 리튬을 납품한다고 한다. 다만, 포스코의 국내 공장에서 생산하는 리튬은 폐 2차전지에서 추출하므로 생산량에 한계가 있어 LG화학과 삼성SDI에 충분히 공급하기에는 한참 모자랄 것이다. 그리고 포스코는 철광석 이외의 광석 생산으로 사업을 다각화 하는 목적에서 리튬 생산에 적극적이며 아르헨티나에 연 2만톤 규모의 생산 공장을 운영하려고 하고 있다. 그런데 PD수첩의 보도에 따르면 이 생산공장은 시작도 하지 않았다고 한다. 애초에 공장을 설립하려 한 염호 지역이 해발 4,000m의 문명과 동떨어진 극한지대여서 다른 의도로 투자를 한 것이 아닌가 하는 의혹이 불거지고 있다. 2017년 현재 세계 1, 2위 생산 업체는 중국 회사 Tianqi(티엔치)와 Ganfeng(간프엉)이며 이 회사는 연 3만 톤 규모로 생산 중이다.
리튬의 가격이 오르자 전 세계적으로 리튬을 캐기 위해 눈에 불을 켜고 뒤지고 있으며, 이에 매년 알려진 매장량이 급속도로 늘어 나고 있다. 불과 몇 년 전까지만 해도 호주가 최대 매장량이라고 알고 있었지만, 현재는 리튬 트라이앵글로 불리는 볼리비아 칠레 아르헨티나를 거점으로 하는 지대에 전세계 매장량의 70% 이상이 매장되어 있는 것으로 조사되고 있다. 다만 이들 나라는 리튬 생산을 전부 자국에서 하도록 강제하고 있다. 과거 석유 등 자원이 해외 기업들에게 빼앗긴 경험이 이들로 하여금 아주 보수적인 접근을 하게 만들고 있으며, 이에 따라 해외 국가의 진출이 쉽지 않다. 우리나라에도 리튬이 없는 것은 아니나 채산성이 없어서 생산하지 않는다고 한다.
그러나 2020년, 자동차 3.7억분의 리튬배터리를 만들 수 있는 양의 리튬이 2018년에 포스코가 찜해둔 아르헨티나의 한 호수에서 발견되었다고 한다.
전기차 생산 1위를 달리고 있는 테슬라의 경우 최대주주이자 CEO인 일론 머스크의 소유회사 스페이스 X와 보링컴퍼니의 협업을 통해 지구와 화성 사이의 소행성대에 존재하는 리튬을 굴착해 지구로 조달하는 프로젝트를 진행 중인 것으로 알려졌다. 소설 같은 이야기처럼 들리지만 2020년 6월 NASA와 계약을 마친 실제로 진행중인 프로젝트이다. 프로젝트의 세부적 일정은 발사 2022년 귀환 2026년이다.
생산 방식[편집]
- HardRock 방식: 흔히 알고 있는 광물 캐는 방식. 묻혀 있는 광석을 부수고 운반해서 정련(암석중 리튬 함량이 높은 것만 추려냄) 제련(리튬이 들어있는 암석을 순수한 리튬으로) 후 리튬을 생산. 땅만 파면 되기 때문에 초기 투자 비용이 낮으며, 생산 기간이 약 2주로 짧으나 생산 비용은 높은 편이다. 운반한 후 부수고 가루내서 화학 작용을 거쳐 정제련 후 생산해야 한다. 제철소의 그 복잡하게 생긴 설비들을 떠올리면 된다.
- Brine(브라인) 방식: 염호의 물을 끌어 올려 넒은 곳에 가두고 자연적으로 태양열에 의해 증발 시킨 후 가공해서 얻는 방식이다. 초기 투자 비용이 높고(넓은 수영장 같은 걸 만들어야 함), 생산 기간이 길지만(약 1년이 소요됨, 염전처럼 햇볕에 말림) 생산 비용은 상대적으로 낮다. 리튬 트라이앵글에 존재하는 리튬은 이러한 형태로 생산되고 있다. 물과 폭발적으로 반응하는 건 순수한 리튬이고 염호에 녹아있는 건 리튬 화합물이므로 말리든 물 같은 걸 끼얹든 상관없다. 그렇지만, 물에 녹아있는 상태에서 리튬을 추출하려면 온갖 강한 화학물질을 투여하고 플랜트를 돌려야 하는데, 이 과정에서 배출되는 오폐수를 정화하는 비용이 만만찮아서 염전 같은 방식으로 생산하는 것이 저렴하다고 한다.
우주 리튬 문제[편집]
우주론의 중요한 미해결 문제중 하나로 리튬의 양이 예측보다 적다는 문제가 있다. 리튬을 포함하여 일반적인 원소의 핵합성 과정은 빅뱅, 항성, 초신성으로 나누어 생각할 수 있다. 질량수 7이하의 원소인 수소, 헬륨, 리튬은 빅뱅 핵합성을 통해 생성되었고 리튬과 그 이후의 원소는 항성의 핵융합과 초신성의 s과정이나 r과정 그리고 기타 여러 반응등을 통해서 만들어진다.
리튬은 항성 내에서 생성되기도 하지만 핵반응을 통해 쉽게 다른 원소로 변환되기도 한다. 리튬이 항성에서 생성되거나 소멸되는 양은 천차만별[4]이기 때문에 과학자들은 리튬의 생성이나 소멸이 적은 별을 가지고 우주 초기의 리튬의 양을 추산한다. 측정된 우주 초기 리튬의 양은 계산으로 예측되는 양의 1/3에 불과하며, 과학자들은 아직까지 이에 대해 명쾌한 설명을 주지 못하고 있다.
리튬과 관련된 핵반응들은 많이 연구되었기 때문에 문제가 핵물리학적으로 해결될 가능성은 적다고 알려져 있다. 일례로 베릴륨 동위원소가 리튬으로 붕괴되는 양이 이론적 예측치보다 적기 때문이 아닌가 하는 가설이 있었으나, 오히려 2017년 일본의 대학졸업반 학생들의 실험 결과가 기존 가설을 부정해버려서 답은 더욱 오리무중인 상태다.
천체물리학적으로는 다양한 해결책이 제시되어 있다. 원시 리튬의 양은 오래된 별들에 대해서 리튬이온의 스펙트럼을 측정하여 추정을 하는데 그러한 별들의 표면온도와 리튬이 이온화되는 정도, 확산과 대류의 수준 등을 잘못 가정하여 리튬의 양을 잘못 추정했을 가능성이 있다. 또한 별들이 주계열성에 이르기 전에 이미 리튬을 소모했다는 가설도 있다.
또는 미지의 입자가 붕괴하면서 빅뱅 핵합성 시점의 온도나 중성자 농도를 바꾸었다는 가설도 있으며 미지의 입자가 원자핵과 속박된 상태를 만들면서 핵반응 단면적을 변화시켰다거나 비활성 중성미자가 관여했다는 가설도 있다.
리튬의 추출[편집]
리튬을 포함하는 소금물에서 물을 증발시키고 탄산 나트륨을 첨가해 탄산 리튬을 얻는다. 이때 소금물을 리튬 함유량이 0.5%를 초과할 때까지 농축하며, 물에 잘 녹지 않는 탄산 리튬을 건져낸다.
2LiCl + Na₂CO₃ → Li₂CO₃↓ +2NaCl
2008년 미국 이외의 곳에서는 27,400톤의 리튬 광물이 채광되었는데, 이의 대다수는 탄산 리튬이었으며, 약 12,000톤은 칠레에서, 7000톤 정도는 오스트레일리아의 광산에서 산출되었다.
리튬 금속을 합성하려면 탄산 리튬을 염산과 섞는다. 이산화 탄소는 기체로 흩어지고 염화 리튬이 용해된 상태로 남는다. 이 용액을 진공 증발기 내에서 염화물이 결정체가 될 때까지 농축한다.
Li₂CO₃ + 2H₃O⁺ + 2Cl- → 2Li⁺ + 2Cl- + CO₂↑ + 3H₂O
소금물은 부식성이 매우 강하기 때문에, 염화 리튬을 얻을 때 쓰는 도구들은 특수한 강철이나 니켈로 만들어진 것이어야 한다. 352 °C에서 녹게 되는 52%가 염화 리튬, 48%가 염화 칼륨으로 이루어진 공융(共融) 혼합물(eutectic mixture)을 물 대신 녹은 설탕을 전해물로 사용한 전기 분해로 순수 리튬을 유리한다.
또는:
전극전위가 더 높은 칼륨은 여기서 같이 분리되지 않으나, 미량의 나트륨이 섞이게 되며, 이는 리튬을 강한 반응제로 만든다. 이런 리튬은 유기화학용으로는 도움이 되나 리튬 전지용으로는 질이 떨어진다. 전해질의 표면에 모이는 액체 리튬은 전해전지에서 내보내기가 비교적 수월하다. 이외에도 염화 리튬을 피리딘 속에서 전기 분해하는 방법이 있으며, 실험실에서 시험하기에 적당하다.
속성[편집]
물리적 속성[편집]
리튬은 상온 상태에서는 가장 가벼운 고체(밀도: 0,534 g/cm3)로 -260 °C에서 고체를 형성하는 수소만이 더 가볍다(밀도: 0,0763 g/cm3). 리튬은 다른 알칼리 금속과 마찬가지로 결정체로는 입방정계 형식의 구슬 모양을 이룬다. 알칼리 금속 중에서는 녹는점과 끓는점이 가장 높고, 제일 단단하기도 하지만, 모스 경도 0.6으로 자르는 것이 여전히 용이하다. 리튬 조각은 나이프로 쉽게 절단할 수 있다. 절단면은 은백색의 금속 광택을 가지나 곧 공기중의 산소와 수증기 따위에 의해 산화되며 검은색으로 변한다. 전도율과 열전도율은 높은 편이다(전도율: 구리의 18% 정도).
리튬에는 마그네슘과 비슷한 점이 있다. 마그네슘은 6각형으로, 리튬은 정육면체 형태로 조합할 때 가장 조밀하지만, 어느 한도까지는 둘을 섞은 고용체(固溶體)를 만들 수 있다. 이런 고용체 내에서는 두 원소 중 수가 더 많은 쪽이 자신의 결정 격자(格子)를 관철시킨다.
리튬 이온은 -520kJ/mol로 알칼리 메탈 중에서 가장 높은 수화 엔탈피를 가지고 있으며, 이로 인해 물 속에선 완전히 수화물이 되어 물 분자를 강하게 끌어들인다. 이때 리튬 이온은 주위에 두 개의 H2O 분자층을 형성하는데, 가까운 층은 4개의 물 분자로 이루어지고, 이 분자층은 수소 결합을 통해 바깥쪽의 다른 분자들과 다시 연결된다. 이렇게 수소화한 리튬 이온의 지름은 질량은 더 높지만, 수소 분자를 이만큼 세게 끌어당기지 않는 루비듐이나 세슘의 수소화 이온보다도 더 커진다.
리튬 원소는 독자적으로 기체 형태로 변할 수 있고, 두 원자가 결합해 이중 리튬(Li₂) 형태의 기체를 이룰 수도 있다. 이중 리튬의 결합 길이는 267.3pm이며, 결합 에너지는 101 kJ/mol이다. 기체 상태의 리튬은 질량의 1% 정도가 이중 리튬을 형성한다.
화학적 속성[편집]
리튬은 알칼리 금속 중에서 반응률이 가장 낮음에도 불구하고 여전히 매우 쉽게 반응하고, 열을 발산하면서 다종의 다른 원소들과 화합물을 이룬다. 상온 상태의 완전히 건조한 공기 내에서는 비교적 안정된 편이지만, 습도가 높으면 급격히 수산화 리튬(LiOH) 층을 형성하며, 상온 상태의 건조한 공기 내에서도 다른 알칼리 금속과는 달리 천천히 질소와 반응해 질화 리튬(Li₃N)을 형성한다. 물과 접촉하면 급격히 산화한다.
Li⁺ 이온의 높은 전하 밀도와 그에 비례해 역시 높은 질화 리튬의 격자 에너지에 의해 이 반응이 가능하다. 리튬은 표준 환원 전위는 −3,04 V이며, 이는 모든 원소 중의 최저치를 기록한다.
다른 알칼리 금속과 마찬가지로 공기를 구성하는 산소나 질소와의 반응을 막기 위해 등유 또는 파라핀유에 담구어 보관한다. 유리 앰플 안에 넣어 진공 또는 아르곤 대기 하에 보존할 수 있다. 그러나 다른 알칼리 금속 처럼 유리 앰플 안에서 용융시켜 보존할 수 없는데 리튬이 유리를 침식하기 때문이다.
리튬과 마그네슘은 대각 방향 관계(diagonal relationship)를 이루며, 이들의 화합물 들에서도 역시 유사한 점을 발견할 수 있다. Li⁺와 Mg²⁺ 이온의 지름은 비슷하다.
리튬은 나트륨과는 달리 부틸 리튬이나 메틸 리튬 등의 여 러 유기 금속 화합물을 이룰 수 있다. 거의 모든 유기리튬화합물은 대기와 격렬히 반응한다. 베릴륨과 알루미늄, 붕소와 규소 사이의 관계도 이와 유사하다.
동위 원소[편집]
자연적으로는 안정된 원자인 ⁶Li(7.6%)와 ⁷Li(92.4%)가 존재하며, 반감기가 밀리초(ms) 범위에 드는 방사성의 다른 동위 원소는 인위적으로만 생산할 수 있다.
⁶Li는 원자로에서 중수소와의 융합에 필요한 삼중수소의 원료로 쓰인다. 삼중수소는 원자로용 블랭킷(blanket)에서나 또는 수소 폭탄 내에서 헬륨이나 ⁶Li이 중성자로 쏘여 만들어진다.
이 외에도
⁷Li을 이용한 핵반응도 가능하지만, 에너지 한도가 높은 탓으로 안전성 보장이 어려워지기 때문에 주로 쓰이지는 않는다.
⁶Li는 리튬을 추출할 때부터 이미 핵융합용으로 따로 모으므로, 시중에서 구할 수 있는 리튬은 거의 순수한 ⁷Li이다. 두 동위 원소의 분리는 용해된 리튬 화합물(예로서 에탄올에 용해된 염화 리튬)과 리튬 아말감의 동위 원소 교환을 통해 이룰 수 있다. 이 분리를 통해 얻을 수 있는 ⁶Li의 양은 약 50% 정도이다.
3단계 수소 폭탄 내에 ⁶Li뿐만 아니라 ⁷Li도 포함되어 있을 경우, 이는 핵융합에서 생기는 빠른 중성자들과 반응한다. 이때 ⁷Li는 에너지를 소비하지만, 동시에 만들어지는 또다른 중성자들과 헬륨, 삼중수소 등의 핵융합과 우라늄 핵분열의 증가로 인해 전체적으로 방출하는 에너지는 오히려 높아진다. 이는 1954년, ⁷Li를 포함한 캐슬 브라보(Castle Bravo)의 폭발력이 예상치의 2.5배에 달했던 것에서 볼 수 있었는데, 이 예상치는 원래 ⁷Li가 중성자와 반응을 일으키지 않을 경우를 가정한 수치였다.
⁷Li는 원자력 발전소에서 붕소의 동위 원소 중 하나인 10B와 중성자의 핵반응을 통해서도 소량이 생산된다.
⁶Li과 ⁷Li는 둘 다 차가운 양자 기체(quantum gas)를 이용한 실험에 사용된다. 보스-아인슈타인 응축은 보손 동위 원소 ⁷Li로도 생성할 수 있다.
⁶Li은 페르미온이며, 근래에 이 동위 원소로 구성된 이중 리튬의 분자를 초유체로 변형하는 것에 성공했다.
용도[편집]
리튬의 대표적인 이용법으로 리튬 이온 배터리가 있다. 1990년대 후반부터 PC 등의 전자기기의 경량화가 진행되어 전지도 이에 따라 가볍고 대용량의 것을 추구하게 되었다. 그래서 등장한 것이 리튬이온 배터리이다. 이 전지는 종래 사용되던 니카드 전지, 니켈 금속수소 전지에 비해 아주 가볍고 대용량이며 현재는 거의 모든 휴대용 제품에 사용되고 있다. 하지만 2008년 이래 몇 년간 발화사고가 잇따라 리튬이온 전지의 안전성 기준이 까다로워지고 있다. 특히 리튬 계열 전지 및 리튬 계열 전지를 탑재한 전자기기의 항공기 수속이 점점 까다로워지고 있는 추세다. 리튬산화금속 전극을 합성할 때 코발트를 쓰는 경우 고온에 약하기 때문에 발화 가능성이 높아지며, 이는 망가니즈를 포함한 구조로 치환하면 어느 정도 해소가 가능하다.
하지만 산업적으로 리튬을 가장 많이 이용하는 것은 따로 있는데, 바로 유리 산업이다. 모래 등 실리카 성분을 녹여 유리나 도자기를 만들 때 플럭스 용제로 탄산 리튬을 첨가해 융해점을 낮추고 점도를 낮춘다. 그리고 알루미늄과 리튬의 합금은 기존 두랄루민을 대체할 항공우주 재료로 각광받고 있다.
한편 탄산리튬은 조울증 치료에도 쓰인다. 리튬이 조울증에 탁월한 효과가 있다는 게 밝혀진 후 대책이 없던 우울증으로 고통받던 수많은 환자들이 리튬을 도움을 받아 정상적 생활을 회복하는 등 가히 기적의 약으로 불리었다. 정신병도 뇌의 화학적 문제이며 약으로 극적으로 개선될 수 있다는 걸 보여서 정신병에 대한 사회의 부정적 인식을 완화시키는 데도 도움을 주었다. 2의 리튬은 조울증 치료제로 쓰이는 리튬에서 따온 것이다. 또 조울증에 관한 것 때문인지 리튬이 자살율과 밀접한 관계가 있다는 주장도 있다. 리튬을 복용한 사람이 일반인보다 자살할 확률이 13~14배 적다고. 중반부참조 또 호수나 지하수 등 수원의 자연적 리튬 농도와 그 지역의 자살률이 상당한 관계가 있다는 연구도 있다. 그래서 마치 수돗물에 미량의 염소를 넣어 식중독을 방지하고 또한 미량의 플루오린[5]를 넣어 충치를 예방하듯이 수돗물에 미량의 리튬을 넣어서 우울증을 예방하고 자살을 줄이자는 주장도 있다. 하지만 이게 정신적으로 영향을 미치기도 하고, 리튬의 효능이 나타나는 양과 독성이 나타나는 양이 비슷해 위험할 수 있다. 또 리튬은 반응성이 강해 순도가 높은 물질의 생산이 어려우므로 비싸서 도입은 힘들다.
리튬은 또한 체내 타우물질의 인산화를 막기 때문에 알츠하이머성 치매의 증상을 완화하고 예방하는 데에도 제한적으로 쓰인다.
중수소라고도 하는 트리튬을 생산하는 데 재료가 되기도 한다. 현대의 열핵폭탄은 삼중수소와 중수소의 핵융합 반응을 이용하는데 삼중수소는 매우 생산하기 어렵고 비싼 물질인데다가 불안정하여 일정 시기마다 재충전을 해야 하고, 냉각도 해줘야 하며 이는 많은 비용을 발생시킨다. 그래서 핵폭발 시 나오는 중성자를 이용해 삼중수소를 만들기 위해 리튬을 사용한다. 우라늄 핵폭발에서 발생한 중성자를 중수소화리튬 화합물에 쪼이면 리튬이 삼중수소로 변하고 그 삼중수소가 중수소와 핵융합 반응을 일으키는 것이다. 즉 리튬은 현대적 열핵폭탄의 재료이기도 한다. 삼중수소는 산업용으로는 원자로에서 리튬에 중성자를 조사해 소량으로 생산한다.
핵폭탄에도 쓰였다. 캐슬 브라보의 폭발장치에는 40% 농축된 리튬이 포함되어 있다.
그리고 개인용 컴퓨터의 메인보드 안에 들어가 있는, 흔히 수은전지라고 말하는 조그마한 3볼트 전지도 알고 보면 리튬전지다.
참고자료[편집]
- 〈리튬〉, 《나무위키》
- 〈리튬〉, 《위키백과》
- 김우현 기자, 〈배터리 필수품 '하얀 석유' 이름값 했다…올해 들어 몸값 70%↑〉, 《매일경제》, 2022-02-28
같이 보기[편집]

 위키원
위키원