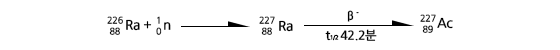"악티늄"의 두 판 사이의 차이
(새 문서: 썸네일|300픽셀|원자번호 89번 악티늄 파일:푸른빛으로 빛나는 악티늄.png|썸네일|300픽셀|푸른빛으로 빛...) |
잔글 (→같이 보기) |
||
| 84번째 줄: | 84번째 줄: | ||
* [[토륨]] | * [[토륨]] | ||
* [[넵투늄]] | * [[넵투늄]] | ||
| − | * [[ | + | * [[란타넘]] |
{{원소|검토 필요}} | {{원소|검토 필요}} | ||
2024년 5월 31일 (금) 14:08 기준 최신판
악티늄(actinium)은 주기율표 3족 악티늄계열에 속하는 방사성원소이다. 원소기호 Ac로 표시하고, 1899년 A. 드비에른이 발견했다. 그 화학적 성질은 희토류원소, 특히 란타넘과 비슷하다.
1889년에 발견되었다. 악티늄은 인공 원소이면서 방사능 원소인 원소 중 제일 먼저 단리된 원소이다. 폴로늄, 라듐, 라돈은 악티늄이 관측되기 전부터 발견되었지만, 1902년에서야 단리되었다. 악티늄부터 로렌슘까지 총 15개의 비슷한 원소들을 묶어 놓은 '악티늄족'의 이름은 악티늄의 이름에서 따왔다.
부드럽고, 은백색인 금속 악티늄은 공기 중에서 산소 및 수분과 급속히 결합하여 흰색 막의 산화악티늄을 형성하며, 이는 악티늄이 더 산화되는 것을 방지한다. 대부분의 란타넘족과 악티늄족과 같이, 악티늄은 거의 대부분의 화합물에서 대부분 +3의 산화수를 가진다. 악티늄은 오직 우라늄 광석에서 ²²⁷Ac 동위원소로만 발견되며, ²²⁷Ac는 21.772년의 반감기를 띤다. 1톤의 우라늄 광석에서는 0.2밀리그램 정도의 악티늄이 발견된다. 악티늄과 란타넘은 물리적·화학적 성질이 매우 비슷하기 때문에, 우라늄 광석에서 이 둘을 구분하는 것은 불가능하다. 그 대신, 원자로 안에서 226Ra에 중성자 선을 쬐였을 때 밀리그램의 양으로 악티늄을 추출해낼 수 있다. 악티늄의 양이 적고, 비싸며 방사성이 있기 때문에 악티늄은 상업적으로 잘 사용되지 않는다. 현재 악티늄은 중성자원을 포함하거나 신체 암세포의 표적을 설정하는 방사선 요법의 약품으로 활용된다.
목차
개요[편집]
악티늄(actinium)1)은 원자번호 89번의 원소로, 원소기호는 Ac(Ac는 화학에서 아세틸(CH₃CO)기를 나타낼 때도 사용되므로, 혼동하지 말 것)이다. 주기율표에서 스칸듐(Sc), 이트륨(Y), 란타넘(La)과 함께 3족(3B족)에 속하는데, 이들 원소의 원자들은 1개의 d전자와 맨 바깥 전자껍질에 2개의 s전자를 가지고 있다. 악티늄과 악티늄 다음에 있는 원자번호 90~103번 원소들을 묶어 악티늄족 원소(actinide 또는 actinoid)₂)라 부르고 이들을 원자번호 57~71의 란타넘족 원소들처럼 주기율표에서 아래에 따로 배치하는데, 이들의 성질은 모두 비슷하며, 란타넘족 원소들과도 비슷하다.
악티늄은 강한 방사선을 내는 무른 은백색 금속으로, 결정은 면심입방(fcc) 구조를 갖는다. 20℃에서의 밀도는 10.07g/cm³이며, 녹는점은 1050℃이고, 끓는점은 3200℃로 추정된다. 공기 중에서 산소, 수분과 빠르게 반응하여 산화악티늄 보호피막을 만들며 회백색으로 흐려진다. 대부분의 란타넘 및 악티늄족 원소들과 마찬가지로, 거의 모든 화합물에서 +3의 산화상태를 갖는다.
자연계에는 발견되는 악티늄은 주로 악티늄-227(²²⁷Ac)로, 이는 우라늄(U) 광석에 광석 1톤당 약 0.2mg의 비율로 들어있다. 지각에는 대략 0.0005ppt(1 ppt는1 part per trillion으로 1조(1012)분의 1)의 무게 비로 존재하는 것으로 추정된다. ²²⁷Ac은 반감기(t1/2)가 21.77년으로 악티늄 동위원소 중에서 가장 길며, ²³⁵U에서 시작되는 악티늄 계열 붕괴 사슬의 중간생성물 중의 하나이다.
자연에는 ²²⁷Ac 외에도²²⁸Ac가 발견되는데, 이는 ²²⁷Ac보다 훨씬 더 희귀하다.²²⁸Ac은 ²³²Th로 시작되는 토륨 계열 붕괴 사슬의 중간 생성물이다. 악티늄은 매우 희귀하고 또 란타넘족 원소들과 성질이 비슷하여 광석에서 이를 분리해 내는 것이 아주 어려워 주로 핵 반응으로 합성해서 얻는다. ²²⁷Ac는 라듐(Ra)-226에 중성자를 쪼여 밀리그램 규모로 얻는데, 연간 전세계 생산량은 1g미만으로 여겨진다. ²²⁵Ac(t1/2=10일)는 이의 모 원자핵인 토륨-229(²²⁹Th)을 ²²⁶Ra 표적에 중성자 또는 α입자를 쪼여 얻거나, 오래된 폐 우라늄 핵연료에서 분리하는 방법 등으로 얻는다.
악티늄 동위원소 중 ²²⁷Ac는 산화베릴륨(BeO)과 혼합하여 중성자원으로 사용되며, 방사성 동위원소 발열발전기(원자력 전지)에 사용할 수 있다. ²²⁵Ac는 이를 포함하는 여러 화합물들이 합성되어 각종 암 치료에 시험되고 있으며, 매우 좋은 치료 효과가 확인되어 α입자 방출 방사성 암 치료제로 크게 기대되고 있다.
악티늄의 발견과 역사[편집]
악티늄은 1899년에 프랑스 화학자 드비에른(André-Louis Debierne, 1874~1949)에 의해 퀴리 부부가 라듐을 추출하고 남은 피치블렌드(pitchblende, 역청 우라늄석) 찌꺼기에서 분리·발견되었다. 그는 처음에는 이 새로운 원소가 타이타늄(Ti)과 비슷하다고 했으나, 다음해에는 토륨과 비슷하다고 발표하였다. 그는 이 원소가 어두운 곳에서 빛을 내는 것에서, 그리스어로 광선을 뜻하는 aktinos 또는 aktis를 따서 원소 이름을 악티늄(actinium)으로 지었다.
한편 이보다 3년 뒤인 1902년에 독일 화학자 기젤(Friedrich Oskar Giesel, 1852~1927)은, 드비에른과는 독립적으로, 피치블렌드에서 새로운 방사성 원소를 분리하고, 이어 2년 동안 이 원소의 여러 성질을 조사한 후, 1904년에 원소 이름을 라틴어로 '발산하다'를 뜻하는 'emanare'를 따서 '에마늄(emanium)'으로 짓고 그 결과를 발표하였다. 이후 곧바로 드비에른의 악티늄과 기젤의 에마늄의 반감기가 측정·비교되었는데, 두 원소가 동일한 것으로 밝혀졌으며, 드비에른의 발견이 시기적으로 더 빨랐기 때문에 그가 악티늄의 최초 발견자로 인정되고 그가 지은 원소 이름 악티늄이 채택되었다. 그러나, 기젤이 처음으로 방사화학적으로 순수한 악티늄을 얻었고 이의 원자 번호가 89번임을 확인하였기 때문에, 기젤을 악티늄의 발견자로 보아야 한다는 과학사 학자들도 있다.
물리적 성질[편집]
악티늄은 무른 은백색의 방사성 금속 원소이다. 가장 안정한 동위원소는 ²²⁷Ac로, 이의 반감기는 21.77년이다. 강한 방사선을 내고 이에 의해 주위의 공기 분자가 이온화되므로, 어두운 곳에서는 푸른색 빛을 낸다. 20℃에서의 밀도는 10.07g/cm³이며, 녹는점은 1050oC이고, 끓는점은 3200℃로 추정된다. 결정은 면심입방(fcc) 구조를 갖는다.
동위원소와 방사성 붕괴[편집]
악티늄 동위원소들은 모두 방사성 붕괴를 한다. 질량수가 206~236인 31가지 동위원소들이 알려져 있는데, 이중에서 자연계에서 발견되는 것은 ²²⁷Ac(t1/2=21.77년)와 ²²⁸Ac(t1/2=6.13시간)의 2가지이다.이들은 각각 ²³⁵U의 붕괴 사슬(악티늄 계열)과 ²³²Th 붕괴 사슬(토륨 계열)의 중간 생성물인데, 천연 악티늄의 거의 대부분은 ²²⁷Ac이다. 악티늄 동위원소들 중 반감기가 상대적으로 긴 것들은 자연에서 발견되는 2 가지 동위원소들 외에 ²²⁵Ac(t1/2=10 일),²²⁶Ac(t1/2=29.37시간), ²²⁴Ac(t1/2=2.78시간), ²²⁹Ac(t1/2=62.7분)이 있으며, 나머지는 반감기가 10분 이내이다. 3 가지 핵 이성체(²⁰⁶m¹Ac, ²⁰⁶m²Ac, ²⁰⁸mAc)가 알려져 있는데, 이들의 반감기는 0.1초보다 짧다. 질량수가 223이하인 동위원소들은 주로 α붕괴를 하고 프랑슘(Fr) 동위원소가 되며, 일부(2% 미만)는 β+붕괴 또는 전자포획을 하고 라듐(Ra) 동위원소가 된다. ²²⁴Ac는 90.9%가 β+붕괴를 하고 ²²⁴Ra이 되나, 나머지는 α붕괴와 β-붕괴를 하고 각각 ²²⁰Fr과 ²²⁴Th이 된다. ²²⁵Ac는 거의 전적으로 α붕괴를 하고 ²²¹Fr이 되며, ²²⁶Ac는 83%가 β-붕괴를 하고 ²²⁶Th이 되며 나머지 17%는 전자 포획을 하여 ²²⁶Ra이 된다. ²²⁷Ac은 98.61%가 β-붕괴를 하여 ²²⁷Th이 되며 나머지 1.38%는 α붕괴를 하고 ²²³Fr이 된다. 질량수가 228이상인 동위원소들은 거의 모두가 β-붕괴를 하고 토륨 동위원소가 된다.
²²⁵Ac의 α붕괴에 의해 생성되는 ²²¹Fr은 계속된 α붕괴로 ²¹⁷At, ²¹³Bi 등을 거쳐 최종적으로 ²⁰⁹Pb가 되며, 이 과정에서 ²²⁵Ac 원자 1개당 4개의 α입자가 방출되는데(아래 그림 넵투늄 계열 참조), α입자는 생체 조직에서 투과 길이가 짧다. 따라서 이의 발생원인 ²²⁵Ac를 암 세포에 부착시키면 암 세포만 파괴되고 다른 건강한 세포는 손상을 입지 않으며, 또한 ²²⁵Ac의 반감기가 10일로 적당하게 길어, 방사선 암 치료에서 요구되는 여러 좋은 특성을 갖고 있다.
화학적 성질[편집]
악티늄의 화학적 성질은 란타넘(La)과 비슷하나, 란타넘보다 좀더 염기성이고 강한 전기 양성을 갖는다. 대부분의 란타넘 및 악티늄족 원소들과 마찬가지로, 화합물에서는 주로 +3의 산화상태를 가지나, +2가 화합물인 수소화악티늄(AcH₂)도 알려져 있다. 공기 중의 산소, 습기와 빠르게 반응하여 회백색의 산화악티늄(Ac₂O₃) 피막이 만들어지는데, 이는 더 이상의 산화를 막는 보호막 역할을 한다. 그러나 공기 중에서 태우면 전체가 Ac₂O₃가 된다. 실온에서 할로겐과 반응하여 할로겐화악티늄(AcX₃)이 되며, 높은 온도에서는 다른 비금속 원소들과도 반응한다. 미세한 가루를 사용하거나 높은 온도에서는 물과 반응하여 수소를 발생시킨다. 묽은 산에 녹으며, 강산과의 염은 물에 잘 녹으나, 약산(예로, HF, H₃PO₄, H₂C₂O₄, H₂CO₃)과의 염들은 물에 약간 녹거나 거의 녹지 않는다. Ac³⁺ 이온은 비활성 기체인 라돈(Rn)과 같은 전자배치를 가지며, 용액에서 색을 띠지 않는다. 산성 수용액에서 Ac³⁺/Ac의 표준 환원 전위(E⁰)는 -2.13V이다.
- Ac³⁺ + 3 e⁻ = Ac E o = -2.13 V
악티늄의 생산[편집]
²²⁷Ac는 초기에는 우라늄 광석에서 분리하였다. 그러나 들어있는 양이 매우 적고 또 란타넘족 원소들과 성질이 아주 비슷하여 이를 순수한 상태로 분리하는 것이 극히 어렵기 때문에, 지금은 핵 반응로에서 ²²⁶Ra에 열 중성자를쪼여 인공적으로 합성하는데, 보통 밀리그램 단위로 얻는다.
이 반응의 수율은 라듐 무게를 기준으로 할 때 약 2%이며, 2개의 중성자 흡수에 의한 ²²⁸Ac도 소량 생성된다. 반응 후 질산으로 녹인 후, 용매 추출 방법이나 이온 교환 방법으로 ²²⁷Ac를 분리한다.
방사성 암 치료에 α입자 요법제로 유용하게 쓰일 것으로 크게 기대되는 ²²⁵Ac는 ²²⁶Ra에 20-30MeV로 가속된 중수소 이온(²D⁺)을 충돌시켜 2000년에 처음 합성되었다. 수년 전까지의 연간 생산량은 약 600 mCi(약 1 x10⁻⁵g)로, 방사성 의약품 개발 연구 등에 대한 수요인 약 7500 mCi(2009년 기준)에 크게 미치지 못하였고, 가격도 1 mCi당 미화 $1200(2003년 기준)으로 아주 높았다. 이에 따라 새로운 ²²⁵Ac 생산 방법들이 개발되었는데, 이의 한 가지는 1970년대의 경수로 증식로 프로그램에서 사용하고 남은 폐 연료에 들어있는 ²³³U에서 이의 전구물질인 ²²⁹Th를 분리하는 것인데, ²²⁵Ac는 ²²⁹Th(반감기 7340년)의 α붕괴에서 생성된 ²²⁵Ra(반감기 14.9일)의 β⁻붕괴로 생성된다(그림 넵투늄 계열 참조). ²²⁵Ac의 분리에는 앞서 언급된 ²²⁷Ac와 같은 분리 방법이 이용될 수 있다.
금속 악티늄은 AcF₃를 1100~1300℃의 진공에서 리튬(Li) 증기로 환원시켜 얻을 수 있다.
악티늄의 용도[편집]
악티늄은 희귀하며 값이 비싸고 강한 방사선을 내기 때문에 산업적 이용은 제한적이다. 그러나 이의 방사성 붕괴를 이용한 중성자원이나 방사성 동위원소 열 발전기에 쓰일 수 있으며, 방사성 암 치료제로 개발되고 있다.
- 중성자원과 방사성 동위원소 열전기 발전기
²²⁷Ac(반감기 21.77년)과 베릴륨(Be) 산화물의 혼합체는 중성자원으로 사용된다. 이는 ²²⁷Ac의 β-붕괴에 의해 생성된 ²²⁷Th과 ²²⁷Th의 딸 원자핵들이 α()입자를 방출하면 Be이 이 α입자를 포획하고 중성자를 방출하는 것을 이용하는 것인데, 이 중성자원은 흔히 사용되는 아메리슘-베릴륨(Am-Be) 또는 라듐-베릴륨(Ra-Be) 중성자원에 비해 더 많은 중성자를 방출한다.
중성자원은 흙에 포함된 수분 함량 측정 등에 사용되며, 따라서 고속도 건설 등에서 중요하게 이용된다. 또한, ²²⁷Ac의 방사성 붕괴에서 방출되는 열은 방사성 동위원소 열전기 발전기(원자력 전지)에 사용될 수 있다.
- α입자 요법 방사성 암 치료제
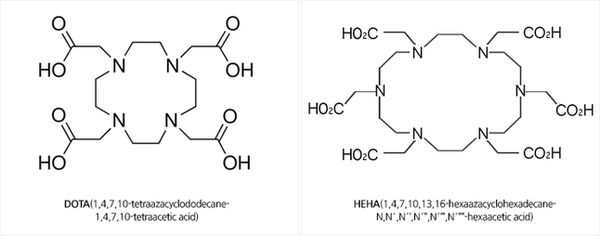
²²⁵Ac를 이용한 α입자 요법 방사성 암 치료제는 앞으로 이용이 크게 기대되는데, 이는 ²²⁵Ac의 반감기가 10일로 적당하고, 붕괴 과정에서 원자 1개당 4개의 α입자가 방출되는데(딸 원자핵이 방출하는 것 포함), α입자는 투과 거리가 짧아 ²²⁵Ac에 인접한 암 세포는 파괴하나 정상 세포는 손상시키지 않는 장점이 있기 때문이다. 악티늄이 뼈나 간에 축적되어 이들의 정상 세포를 손상시키는 것을 막고 특정 암세포에만 전달되도록 하기 위해, Ac³⁺를 HEHA나 DOTA와 같은 강한 킬레이트제와 결합시키고 이를 단일클론항체(monoclonal antibody, 하나의 항원에만 특이적으로 결합하는 항체)에 연결한 것들이 개발되고 있다. 이와 같은 ²²⁵Ac를 사용한 α⁻면역요법은 암 세포의 미소전이 질환과 백혈병, 림프종과 혈액 세포 암에 특히 효과가 있을 것으로 기대되며, 동물 실험 결과 난소암, 전립선암, 신경모세포종(neuroblastoma) 등에도 효과가 있는 것으로 밝혀졌다.
악티늄 화합물[편집]
악티늄은 란타넘(La)처럼 여러 +3가 상태의 화합물을 만들 수 있으며, 수소와는 +2가 상태의 수소화물 AcH₂를 만든다. 그러나 알려진 악티늄 화합물은 많지 않으며, 용도도 거의 개발되지 않았다.
산화물[편집]
악티늄을 공기 중에서 태우면 흰색의 산화악티늄(Ac₂O₃)이 만들어진다. Ac₂O₃는 또한 진공에서 수산화악티늄(Ac(OH)₃)을 500oC에서 가열하거나, 옥살산악티늄(Ac₂(C₂O₄)₃)을 1100℃에서 열 분해시켜서도 얻어진다. Ac₂O₃ 또는 Ac(OH)₃를 산에 녹이면 무색의 Ac3+ 용액이 되는데, 이 용액을 증발시키면 악티늄 염이 얻어지고, 이 용액에 알칼리를 가하면 Ac(OH)₃가 침전된다.
할로겐화물과 옥시할로겐화물[편집]
악티늄을 할로겐 또는 할로겐화 수소와 반응시키거나, Ac₂O₃를 할로겐화 수소산에 녹이면 할로겐화악티늄(AcX3: X=F, Cl, Br)이 얻어진다. 이외에도 AcF₃는 Ac(OH)₃를 700℃에서 HF와 반응시켜 얻을 수 있으며, AcCl₃는 Ac₂O₃ 를 250℃에서 NH₄Cl과 반응시키거나 Ac₂O₃ 또는 Ac₂(C₂O₄)₃를 950℃에서 CCl₄와 반응시켜 얻을 수 있고, AcBr₃는 Ac₂O₃를 750℃에서 AlBr₃와 반응시켜 얻을 수 있다. AcF₃는 물에 녹지 않으나, 다른 것들은 물에 잘 녹는다. AcF₃를 900~1000℃에서 NH₄OH로 처리하면 옥시플루오르화악티늄(AcOF)이 얻어지며, AcBr₃를 500℃에서 NH₄OH와 반응시키면 AcOBr이 얻어진다. AcOCl은 AcCl₃ 용액을 HCl, NH₃와 함께 태우면 만들 수 있다.
생물학적 역할, 독성, 주의 사항[편집]
악티늄의 생물학적 역할은 없으며, 핵 시설이나 특수 연구실을 제외하면 악티늄을 접할 기회도 없다. 악티늄은 강한 방사성 원소로 위험하므로, 취급하는 경우는 특수 시설을 이용해야 한다. 염화악티늄(AcCl₃) 용액을 쥐에 주사한 결과, 악티늄의 약 33%는 뼈에, 약 50%는 간에 축적되는 것이 관찰되었다. 악티늄에서 방출되는 방사선은 세포를 파괴하거나 손상시킬 수 있으며, 방사선은 암, 면역체계 손상, 유산, 불임 등의 여러 질환을 유발하는 것으로 알려져 있다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원