"실리카"의 두 판 사이의 차이
잔글 (→같이 보기) |
|||
| (같은 사용자의 중간 판 6개는 보이지 않습니다) | |||
| 1번째 줄: | 1번째 줄: | ||
[[파일:실리카 분말.jpg|썸네일|300픽셀|오른쪽|실리카 분말]] | [[파일:실리카 분말.jpg|썸네일|300픽셀|오른쪽|실리카 분말]] | ||
| − | '''실리카'''(Silica)는 | + | '''실리카'''(Silica) 또는 '''이산화규소'''는 화학식 '''SiO₂'''를 가지는 [[물질]]이다. 실리카는 지구상에서 가장 풍부한 원소인 [[실리콘규소]]와 [[산소]]가 결합하여 형성된 물질로서, [[모래]]나 여러 가지 [[광물]]의 주요 성분으로 존재하고 [[지각]]을 이루는 [[화합물]] 중 가장 많은 비율을 차지한다. [[석영]]이나 [[유리]] 흡습제인 [[실리카겔]]을 구성하는 성분이기 때문에 우리 주위에서 쉽게 찾아볼 수 있는 [[물질]]이다. |
== 개요 == | == 개요 == | ||
| − | 실리카는 [[도자기]]의 주성분인 동시에 | + | 실리카는 [[도자기]]의 주성분인 동시에 [[광섬유]], 수정진동자(水晶振動子) 등 [[하이테크]]의 기본이 되는 중요한 [[소재]]이다. 실리카는 지각 중에 가장 많이 존재하는 성분으로, 거의 모든 [[토사]] [[암석]] 속에 다른 성분과 결합한 규산염 광물로 존재하는 외에, 순수한 상태에서는 규사(珪砂), 규석(珪石)으로 존재한다. 수정은 단결정(單結晶) 상태의 실리카이다. 실리카의 결정상태에는 몇 가지 존재가 보고되어 있으나, 공업적으로 중요한 것은 [[석영]](石英)과 [[유리]] 상태이다. |
실리카는 대표적인 유리 형성 광물이고, 액체를 급냉하면 쉽사리 유리상태로 화하여, 석영 유리가 된다. 석영 유리는 고내열(高耐熱)이어서 열팽창률이 대단히 작고(5×10⁻̦⁷/℃), 열충격에 강할 뿐만 아니라 내약품성(耐藥品性)이 우수하다. | 실리카는 대표적인 유리 형성 광물이고, 액체를 급냉하면 쉽사리 유리상태로 화하여, 석영 유리가 된다. 석영 유리는 고내열(高耐熱)이어서 열팽창률이 대단히 작고(5×10⁻̦⁷/℃), 열충격에 강할 뿐만 아니라 내약품성(耐藥品性)이 우수하다. | ||
| 11번째 줄: | 11번째 줄: | ||
== 물리적, 화학적 성질 == | == 물리적, 화학적 성질 == | ||
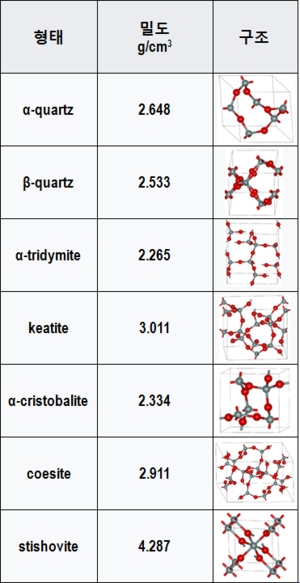
| − | [[파일:실리카의 다양한 결정구조와 밀도.png|썸네일|300픽셀|오른쪽|실리카의 다양한 결정구조와 밀도]] | + | [[파일:실리카의 다양한 결정구조와 밀도.png|썸네일|300픽셀|오른쪽|실리카의 다양한 결정구조와 밀도]] |
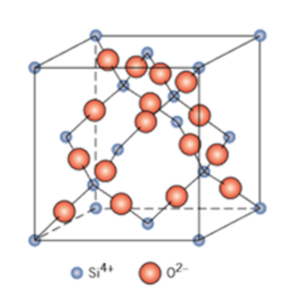
| − | [[파일:석영의 원자 구조.png|썸네일|300픽셀|오른쪽|석영의 원자 구조]] | + | [[파일:석영의 원자 구조.png|썸네일|300픽셀|오른쪽|석영의 원자 구조]] |
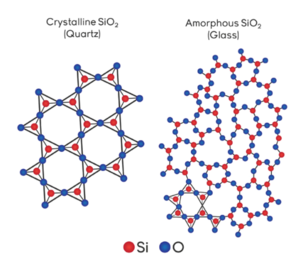
| − | [[파일:석영과 유리.png|썸네일|300픽셀|오른쪽|결정질 실리카인 석영과 비정질 실리카인 유리의 결정구조 비교]] | + | [[파일:석영과 유리.png|썸네일|300픽셀|오른쪽|결정질 실리카인 석영과 비정질 실리카인 유리의 결정구조 비교]] |
| + | |||
실리카의 [[분자량]]은 60.08이며 녹는점은 1743ºC 끓는점은 2950ºC 이다 일반적인 상온 대기압 조건에서 실리카는 고체 상태로 존재한다. 실리카는 굉장히 다양한 결정구조를 가지며 각 결정구조마다 [[밀도]]나 [[열전도]]도 색깔 등 여러가지 특성들이 조금씩 다르다. | 실리카의 [[분자량]]은 60.08이며 녹는점은 1743ºC 끓는점은 2950ºC 이다 일반적인 상온 대기압 조건에서 실리카는 고체 상태로 존재한다. 실리카는 굉장히 다양한 결정구조를 가지며 각 결정구조마다 [[밀도]]나 [[열전도]]도 색깔 등 여러가지 특성들이 조금씩 다르다. | ||
| 30번째 줄: | 31번째 줄: | ||
'''SiO₂ +2C → Si + 2CO''' | '''SiO₂ +2C → Si + 2CO''' | ||
| − | 실리카는 겔 형태로 가공되어 의약품이나 식품의 습도를 제어하는 | + | 실리카는 [[겔]] 형태로 가공되어 의약품이나 식품의 습도를 제어하는 [[흡습제]]로도 널리 사용된다. |
| − | 반도체, 특히 MOSFET(금속 산화물 반도체 전계-효과 트랜지스터)의 게이트 채널 절연을 위해 극히 얇은 층(<1um)으로 사용되기도 한다. | + | [[반도체]], 특히 MOSFET(금속 산화물 반도체 전계-효과 트랜지스터)의 게이트 채널 절연을 위해 극히 얇은 층(<1um)으로 사용되기도 한다. |
== 유해성 == | == 유해성 == | ||
| − | 실리카는 화학적 반응성이 낮기 때문에 신체적 유해성 또한 높지 않다. | + | 실리카는 화학적 반응성이 낮기 때문에 신체적 [[유해성]] 또한 높지 않다. [[구강]]을 통한 [[섭취]]의 경우 반수치사량 LD50이 5gkg 으로 낮지 않다. 오히려 하루 10 mg 정도의 [[소량]]의 실리카를 [[섭취]]한 경우 [[치매]]의 위험이 약 11% 감소했다는 연구결과가 보고되었다. 구강을 통한 체내 흡수와는 달리 [[호흡기]]를 통해 체내로 들어오는 실리카 분진은 여러가지 [[폐질환]]의 원인이 될 수 있으니 주의해야 한다. |
== 참고자료 == | == 참고자료 == | ||
| 43번째 줄: | 44번째 줄: | ||
== 같이 보기 == | == 같이 보기 == | ||
| + | * [[실리카겔]] | ||
* [[실리콘]] | * [[실리콘]] | ||
* [[실리콘규소]] | * [[실리콘규소]] | ||
| + | * [[산화규소]] | ||
| + | * [[일산화규소]] | ||
* [[산소]] | * [[산소]] | ||
* [[석영]] | * [[석영]] | ||
* [[유리]] | * [[유리]] | ||
| − | {{ | + | {{화합물|검토 필요}} |
2024년 10월 11일 (금) 22:44 기준 최신판
실리카(Silica) 또는 이산화규소는 화학식 SiO₂를 가지는 물질이다. 실리카는 지구상에서 가장 풍부한 원소인 실리콘규소와 산소가 결합하여 형성된 물질로서, 모래나 여러 가지 광물의 주요 성분으로 존재하고 지각을 이루는 화합물 중 가장 많은 비율을 차지한다. 석영이나 유리 흡습제인 실리카겔을 구성하는 성분이기 때문에 우리 주위에서 쉽게 찾아볼 수 있는 물질이다.
개요[편집]
실리카는 도자기의 주성분인 동시에 광섬유, 수정진동자(水晶振動子) 등 하이테크의 기본이 되는 중요한 소재이다. 실리카는 지각 중에 가장 많이 존재하는 성분으로, 거의 모든 토사 암석 속에 다른 성분과 결합한 규산염 광물로 존재하는 외에, 순수한 상태에서는 규사(珪砂), 규석(珪石)으로 존재한다. 수정은 단결정(單結晶) 상태의 실리카이다. 실리카의 결정상태에는 몇 가지 존재가 보고되어 있으나, 공업적으로 중요한 것은 석영(石英)과 유리 상태이다.
실리카는 대표적인 유리 형성 광물이고, 액체를 급냉하면 쉽사리 유리상태로 화하여, 석영 유리가 된다. 석영 유리는 고내열(高耐熱)이어서 열팽창률이 대단히 작고(5×10⁻̦⁷/℃), 열충격에 강할 뿐만 아니라 내약품성(耐藥品性)이 우수하다.
또 고순도화(高純度化)한 석영 유리 파이버는 빛의 흡수가 적고 뛰어난 도광성(導光性)을 갖고 있어 광(光)파이버로서 중요하다. 합성법(合成法)에 의한 고순도이고 결정부정(結晶不整)이 없는 합성수정(合成水晶)은 압전(壓電)성이 있어 수정 진동자(水晶振動子)로 이용된다. 또 각종 규산염 광물에 의한 소결체와 유리의 막(膜)은 절연재료 등의 전자부품 혹은 구조재로 파인 세라믹 중에서 확고한 자리를 차지하고 있다.
물리적, 화학적 성질[편집]
실리카의 분자량은 60.08이며 녹는점은 1743ºC 끓는점은 2950ºC 이다 일반적인 상온 대기압 조건에서 실리카는 고체 상태로 존재한다. 실리카는 굉장히 다양한 결정구조를 가지며 각 결정구조마다 밀도나 열전도도 색깔 등 여러가지 특성들이 조금씩 다르다.
실리카의 단결정 형태 중 하나인 석영을 구성하는 실리콘 원자는 사면체의 꼭지점을 둘러싸고 있는 산소원자와 공유결합을 이루고 있다.
석영은 전기 저항과 유전강도가 높으며 특히 응력으로 인해 모양이 변하면 전압이 발생되는 압전특성을 가지고 있다. 또한 석영은 모스 굳기가 7에 이를 정도로 단단하기도 하다. 실리카를 이루는 화학결합의 극성은 거의 0에 가까운 안정적인 물질이다. 결정성 실리카는 물이나 대부분의 산에 녹지 않지만 불산이나 뜨거운 수산화나트륨에는 녹는다.
SiO₂+ 6HF → H₂SiF₆ + 2H₂O SiO₂ + 2NaOH → Na₂SiO₃ + H₂O
또한 실리카의 용해도는 결정형태에 따라 차이가 있는데 비정질 실리카의 용해도는 결정질 실리카인 석영의 용해도보다 서너배 가량 크다.
용도[편집]
상업적인 실리카 생산량의 대부분은 모래 또는 콘크리트와 같은 건축재료로 사용되며 유리의 주요 성분으로도 널리 사용된다. 실리카는 실리콘의 원료로도 사용된다. 실리카를 코크스탄소와 함께 가열하면 실리카가 환원되어 실리콘과 일산화탄소로 분해된다.
SiO₂ +2C → Si + 2CO
실리카는 겔 형태로 가공되어 의약품이나 식품의 습도를 제어하는 흡습제로도 널리 사용된다.
반도체, 특히 MOSFET(금속 산화물 반도체 전계-효과 트랜지스터)의 게이트 채널 절연을 위해 극히 얇은 층(<1um)으로 사용되기도 한다.
유해성[편집]
실리카는 화학적 반응성이 낮기 때문에 신체적 유해성 또한 높지 않다. 구강을 통한 섭취의 경우 반수치사량 LD50이 5gkg 으로 낮지 않다. 오히려 하루 10 mg 정도의 소량의 실리카를 섭취한 경우 치매의 위험이 약 11% 감소했다는 연구결과가 보고되었다. 구강을 통한 체내 흡수와는 달리 호흡기를 통해 체내로 들어오는 실리카 분진은 여러가지 폐질환의 원인이 될 수 있으니 주의해야 한다.
참고자료[편집]
- 〈실리카〉, 《첨단산업기술사전》
- 〈이산화 규소〉, 《위키백과》
- 이호림 박사, 〈실리카(Silica, SiO2)란 무엇인가?〉, 《티스토리》
같이 보기[편집]

 위키원
위키원