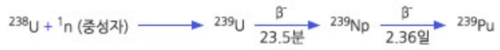"우라늄"의 두 판 사이의 차이
잔글 |
잔글 (→같이 보기) |
||
| (사용자 2명의 중간 판 2개는 보이지 않습니다) | |||
| 1번째 줄: | 1번째 줄: | ||
| + | [[파일:우라늄.jpg|썸네일|300픽셀|오른쪽|우라늄]] | ||
| + | [[파일:우라늄 준위별 전자 수.png|썸네일|200픽셀|오른쪽|우라늄 준위별 전자 수(2, 8, 18, 32, 21, 9, 2)]] | ||
| + | |||
'''우라늄'''(Uranium )은 화학 원소로 원소 기호는 '''U'''이다. 원자 번호는 92인 은회색의 방사성 금속 원소이다. 모든 대형 상업용 원자력 발전소에서는 전기 에너지를 얻는 에너지원으로 우라늄을 쓰고 있다. 1그램의 우라늄에서는 석탄 3톤, 석유 9드럼에서 나오는 것과 같은 에너지를 얻을 수 있다. 또한, 우라늄은 일부 핵무기에 쓰여 엄청난 폭발력을 나타낸다. | '''우라늄'''(Uranium )은 화학 원소로 원소 기호는 '''U'''이다. 원자 번호는 92인 은회색의 방사성 금속 원소이다. 모든 대형 상업용 원자력 발전소에서는 전기 에너지를 얻는 에너지원으로 우라늄을 쓰고 있다. 1그램의 우라늄에서는 석탄 3톤, 석유 9드럼에서 나오는 것과 같은 에너지를 얻을 수 있다. 또한, 우라늄은 일부 핵무기에 쓰여 엄청난 폭발력을 나타낸다. | ||
| 92번째 줄: | 95번째 줄: | ||
== 같이 보기 == | == 같이 보기 == | ||
* [[원자력전지]] | * [[원자력전지]] | ||
| − | * [[ | + | * [[다이아몬드 배터리]] |
| − | {{ | + | {{원소|검토 필요}} |
2022년 1월 24일 (월) 01:43 기준 최신판
우라늄(Uranium )은 화학 원소로 원소 기호는 U이다. 원자 번호는 92인 은회색의 방사성 금속 원소이다. 모든 대형 상업용 원자력 발전소에서는 전기 에너지를 얻는 에너지원으로 우라늄을 쓰고 있다. 1그램의 우라늄에서는 석탄 3톤, 석유 9드럼에서 나오는 것과 같은 에너지를 얻을 수 있다. 또한, 우라늄은 일부 핵무기에 쓰여 엄청난 폭발력을 나타낸다.
우라늄은 자연에서 비교적 쉽게 발견되는 원소 중에서 원자번호가 가장 큰 원소다. 물론 우라늄보다 원자번호가 큰 원소인 넵투늄과 플루토늄이 있지만 이들은 자연에서 매우 적은 양이 존재한다. 게다가 이들은 주로 인공적인 핵반응으로 만들어 내기 때문에 인공원소로 분류된다. 우라늄은 1기압 상온에서 밀도가 큰 은색의 고체 금속으로 존재한다. 독성이 매우 크며 동위원소들은 모두 자연 방사선 원소이다. 우라늄은 바닷물에 1㎥당 약 3.3mg이 녹아 있고 지각에 0.00023% 농도로 들어 있다. 이는 은이나 주석보다 풍부한 양이다. 우라늄은 주로 섬우라늄광과 역청우라늄광(피치블렌드)으로 얻는다. 섬우라늄광에 들어있는 천연 우라늄 산화물은 고대 로마시대부터 노란색 도자기 유약과 채색 유리를 만드는 첨가물로 사용됐다.
목차
개요[편집]
우라늄은 주기율표에서 악티늄족에 있는 은백색 금속이다. 우라늄은 모든 동위원소가 불안정하므로 약한 방사성을 띠는데, 대표적인 동위원소들의 반감기는 159,200년 - 45억 년으로 알려져 있다. 농축하여 원자력 발전이나 원자 폭탄 제조에 사용될 수 있다.
우라늄은 지구 껍질에 평균 약 2.3 ppm(0.00023%) 농도로 들어있으며, 은(Ag), 수은(Hg), 주석(Sn)보다 풍부한 원소이다. 주된 우라늄 광석은 섬우라늄광(uraninite: UO₂)과 이의 일종인 피치블렌드(pitchblende: 역청우라늄광, UO₃, U₂O₅)이다. 이외에도 우라늄을 포함하는 광물들로 인회우라늄광(autunite, Ca[UO₂(PO₄)]₂∙10~12 H₂O)과 카르노타이트(carnotite: K₂(UO₂)₂(VO₄)₂∙1~3 H₂O) 등이 있다.
우라늄 화합물인 천연산화우라늄은 고대 로마시대부터 도자기 유약에 노란색을 넣고 노란색 유리를 만드는데 사용되어왔으나, 현대에는 주로 원자력(핵) 발전과 핵 무기 제조에 사용된다. 천연 우라늄의 0.72%를 차지하는 우라늄-235(²³⁵U, 143개의 중성자가 있어 원자 질량이 235인 우라늄 동위원소)는 천연 동위원소들 중에서는 유일하게 핵분열될 수 있다. 그러나 우라늄을 원자력 발전이나 핵무기에 사용하기 위해서는 ²³⁵U의 비율을 높게 농축시켜야 한다. 천연 우라늄의 99.27%를 차지하는 우라늄-238(²³⁸U)은 그 자체가 핵분열되지는 않으나, 원자로에서의 핵 반응을 통해 플루토늄-239(²³⁹Pu)로 변환되며 ²³⁹Pu는 ²³⁵U와 마찬가지로 핵분열이 된다. 이 때문에 우라늄 원자로에서 나오는 폐연료를 재처리하여 ²³⁹Pu 을 얻고 이를 원자력 발전과 핵무기에 사용할 수 있다. 제2차 세계대전 때 일본 히로시마에 투하된 원자폭탄은 농축 우라늄을 사용한 것이고, 나가사키에 투하된 원자폭탄은 폐연료를 재처리하여 얻은 플루토늄을 사용한 것이다.
우라늄과 이에서 만들어지는 플루토늄은 원자폭탄을 만드는 것 외에도, 원자력 발전으로 전력을 공급하는데 사용된다. 원자력 발전은 세계 에너지 생산의 6%, 전력 생산의 13~14%를 차지하며, 우리나라의 경우 발전량의 40%를 차지한다. 이론적으로는, 1kg의 ²³⁵U는 석탄 3,000톤이 탈 때 내는 에너지와 같은 양의 에너지를 낼 수 있다. 그러나 최근 일본의 후쿠시마 원자력 발전소 사고에서 보듯이 원자력 발전소의 사고는 엄청난 재앙을 가져올 수 있으며, 발전 과정에서 나오는 방사성 폐기물의 처리와 보관도 어려운 실정이다. 또 몇몇 나라는 핵무기를 개발하고 확충하려는 의욕을 여전히 갖고 있어, 세계 평화의 심각한 저해 요소가 되고 있다.
발견과 역사[편집]
우라늄은 1789년에 독일 화학자 클라프로트(Martin Heinrich Klaproth, 1743~1817)에 의해 피치블렌드(pitchblende)라는 광석에서 처음 발견되었다. 이 광석은 당시에는 아연(Zn), 철(Fe), 텅스텐(W) 산화물의 혼합물로 여겨지고 있었다. 클라프로트는 피치블렌드를 질산에 녹인 후 가성소다로 중화시켜 노란색 침전을 얻었는데, 그는 이 침전을 어떤 새로운 원소의 산화물로 생각하고는 숯과 함께 가열하여 검은색 가루를 얻었다. 그는 이 가루를 새로운 금속(실제는 우라늄 산화물임)으로 생각하고, 이보다 8년 전에 새롭게 발견된 행성인 천왕성(Uranus, uranus는 그리스 신화에서 하늘 신의 이름)의 이름을 따서 우라늄(uranium)이라 명명하였다. 1841년에 프랑스 화학자 페리고(Eugene-Melchior Peligot, 1811~1890)가 사염화우라늄(UCl₄)을 포타슘(K)과 반응시켜 금속 우라늄을 처음으로 얻었다.
피치블렌드와 같은 섬우라늄 광석에 들어있는 천연 우라늄 산화물은 고대 로마시대부터 노란색 도자기 유약으로, 그리고 채색 유리를 만드는 첨가물로 사용되었다. 중세 후반에는 현재의 체코공화국 요하임스탈(Joachimsthal)에 있는 은 광산에서 채광된 피치블렌드가 유리 공장에 공급되었다. 1898년에 퀴리 부부에 의해 우라늄 광석에서 라듐(Ra)이 분리∙발견되고 라듐이 여러 용도로 활용되면서 부터는 우라늄 광석은 주로 라듐을 얻는데 사용되었다.
1896년에 베크렐(Antoine Henri Becquerel, 1852~1908)은 우라늄에서 방사성 성질을 발견하였다. 1932년에 중성자가 발견된 이후, 여러 물리학자들이 중성자를 핵과 충돌시켜 핵반응을 유도하는 연구를 하였는데, 이중 한 사람이 이탈리아의 페르미(Enrico Fermi, 1901~1954)이다. 그는 1934년에 우라늄에 중성자를 때리면 베타선이 나오는 것을 관찰하였는데, 이를 원자번호가 93과 94인 새로운 원소가 생성된 것으로 잘못 판단하였다. 1938년에 독일의 오토 한(Otto Han, 1879~1968)과 프리츠 슈트라스만(Fritz Strassmann, 1902~1980)은 235U에 중성자를 때리면 바륨(Ba, 원자번호 56)의 동위원소가 생기고 많은 양의 에너지가 나오는 핵분열 현상을 발견하였다. 원자력 발전과 원자 폭탄의 바탕이 되는 핵 연쇄반응(한 핵이 분열할 때 나오는 중성자가 다른 핵을 다시 분열시키는 핵반응)의 아이디어는 1933년에 헝가리 태생의 유대인 실라르드(Leo Szilard, 1898~1964)가 처음 내놓았는데, 이후 1939년에 실라르드와 페르미가 중성자 충돌에 의해 우라늄 원자핵 1개가 분열할 때마다 매회 평균 2.5개의 중성자가 나온다는 사실을 발견하면서 그 가능성이 확실해졌다. 1942년에는 우라늄의 연쇄 핵반응을 일으키는 최초의 원자로가 미국 시카고 대학에 설치되었다.
이 즈음에 독일은 히틀러가 집권하여 유대인을 박해하였고, 많은 유대인 핵물리학자들이 외국으로 망명하였다. 1939년 9월에 독일의 폴란드 침공으로 제2차 세계대전이 발발하자, 연합국이 독일보다 먼저 핵 무기를 개발하여야 한다고 믿고는, 망명 유대인 과학자들이 주축이 되어 1939년 12월에 미국의 루즈벨트 대통령에게 원자폭탄 개발연구 프로그램을 시행할 것을 청원하였다. 원자폭탄 개발 사업인 맨해튼 계획(Manhattan Project)이 본격적으로 출범한 것은 일본의 진주만 공격 다음해인 1942년이다. 이 사업은 최초의 국가 주도 초대형 연구∙개발 사업으로, 이에 의해 제조된 원자폭탄은 1945년 8월 6일에 일본의 히로시마에, 그리고 8월9일에 일본의 나가사키에 투하되어 제2차 세계대전의 종식을 가져온 반면 수십만 명이 사망하고 많은 사람들이 피해를 입어 평생 동안 고통에 시달려야 했다. 히로시마에 투하된 폭탄은 '꼬마 소년(Little Boy)'이라는 암호명의 우라늄 폭탄이었고, 나가사키에 투하된 폭탄은 '뚱보(Fat Man)'라는 암호명의 플루토늄 폭탄이었다.
전쟁 종료 후 미국과 구소련을 비롯한 여러 나라는 핵 무기 개발 및 확충 경쟁을 하는 한편, 원자력의 평화적 이용에도 노력한 결과 1951년에 최초의 원자력 발전이 미국에서 선보였다. 상업용 원자력 발전은 1954년에 구소련에서 시작되었고, 영국에서는 1956년에, 미국에서는 1958년에 시작되었다. 우리나라에서는 1978년 4월에 고리원전 1호기가 첫 원자력 발전을 시작하였다.
우라늄의 물리적 성질 및 원자핵 붕괴[편집]
우라늄은 은백색 금속이다. 밀도는 19.1 g/cm³으로 대표적인 무거운 금속인 납(Pb, 11.34 g/cm³)보다 월등히 크나, 금(Au)과 텅스텐(W)보다는 약간 작다. 전기전도도는 작다. 녹는점은 1132.2oC이며, 액체의 증발열이 아주 커 끓는점은 3,818oC로 매우 높다. 우라늄은 전기양성도가 큰 원소로, 폴링의 전기음성도는 1.38이며, 첫 번째와 두 번째 이온화에너지는 각각 597.6kJ/mol과 1,420kJ/mol이다.
우라늄은 3가지 동소체를 갖는데, α-우라늄은 사방정 구조를 하고 660℃까지 안정하며, β-우라늄은 정방정 구조를 하고 660~760℃에서 안정하며, γ-우라늄은 체심 입방 구조를 하고 760℃에서 녹는점까지 안정하다. γ-우라늄이 우라늄 동소체 중 전성과 연성이 가장 크다.
천연 우라늄에는 ²³⁴U(0.0054%), ²³⁵U(0.72%), ²³⁸U(99.274%)의 3가지 동위원소가 있는데, 이들은 모두 반감기가 긴 약한 방사성 동위원소들이다. 이들의 자연 핵 붕괴의 일부는 다음과 같다.
- 우라늄-235의 핵분열과 우라늄-238의 플루토늄-239로의 핵 변환
우라늄이 원자력 발전과 핵무기에 이용될 수 있는 것은 우라늄이 가진 핵분열 특성 때문이다. ²³⁵U는 중성자와 충돌하여 2개의 작은 원자핵으로 분열되고 2~3개의 중성자를 내어놓는다. 예로, 크립톤-92(⁹²Kr)과 바륨-141(¹⁴¹Ba)로 분열되면서 3개의 중성자를 내어 놓는다.
이때 나온 중성자는 다른 ²³⁵U 원자핵과 충돌하여 이를 또 분열시킬 수 있기 때문에, 한번 시작된 핵 분열은 연쇄적으로 일어난다. 다만 연쇄 핵분열이 일어나기 위해서는 ²³⁵U의 농도가 일정 수준(3%) 이상이 되어야 한다.
천연 우라늄의 99.274%를 차지하는 ²³⁸U는 중성자를 흡수해도 핵 분열을 일으키지 않고, 다음과 같은 핵 반응으로 플루토늄-239(²³⁹Pu)로 전환되는데, ²³⁹Pu는 ²³⁵U처럼 중성자를 흡수하여 핵분열 될 수 있다.
²³⁸U에 중성자 대신 중수소(2D)를 충돌시키면 ²³⁸Pu가 생성된다. ²³⁸Pu는 핵 붕괴 시 많은 열을 내는데, 열전대(thermocouple)를 사용하면 이 열을 전기로 변환시킬 수 있다. 이를 이용한 것이 원자력 전지의 한 부류인 방사성동위원소 열전자 발전기(Radioisotope thermoelectric generator)이다.
우라늄의 화학적 성질[편집]
우라늄 금속은 거의 모든 비금속 원소와 반응하며, 온도가 높을수록 반응성이 커진다. 알칼리와는 잘 반응하지 않으나, 산과는 잘 반응한다. 예로 진한 염산(HCl)과 잘 반응하여 물에 녹지 않는 검은 침전을 만들며, 진한 질산(HNO₃)에서는 부동화되나 플루오르화 이온(F⁻)를 첨가하면 잘 녹는다. 끓는 물이나 수증기와 반응하면 표면에 산화물을 만들고 수소 기체를 내어 놓는다. 공기 중에서는 표면에 산화물 피막이 생성된다.
우라늄 원자는 비활성 기체 원소인 라돈(Rn)에 비해 6개의 전자를 더 갖고 있으며, 이의 바닥 상태 전자배치는 [Rn]5f³6d¹7s²이다. 수용액에서 가장 안정한 산화상태는 +6이나, 산화수가 +5, +4, +3인 화합물과 이온들도 흔히 관찰된다. 수용액에서는 적갈색의 U³⁺, 녹색의 U⁴⁺, 노란색의 우라닐 이온(UO₂ ²⁺)으로 있을 수 있다. 이외에 UO²⁺ 도 존재하기는 하나, 불안정하다.
우라늄 화합물[편집]
우라늄은 여러 산화물을 만드는데, 이들의 색은 산화상태에 따라 다르다. UO₃는 주황색이고, U₂O₅는 검정색이며, UO₂는 진한 갈색이고, 혼합산화물인 U₃O₈은 진한 녹색이다. 이들 외에 과산화우라늄의 수화물인 UO₄∙2H₂O도 존재한다. 이중 U₃O₈와 UO₂는 가장 흔한 우라늄 산화물로 물에 잘 녹지 않고 비교적 안정하다. 특히 U₃O₈는 가장 안정한 우라늄 화합물로, 보통 우라늄광석에 들어있는 우라늄의 함량을 U₃O₈로 환산해서 나타낸다. UO₂는 핵연료로 가장 흔히 사용되는 우라늄 화합물이다. 우라늄 산화물이 안정하기 때문에, 보통 핵 연료를 생산하여 저장하거나 폐기할 때 우라늄을 이들 산화물 형태로 바꿔서 한다.
우라늄의 할로겐 화합물 UXn (n = 3~6, X= 할로겐)들도 여럿 알려져 있다. 그 중 가장 중요한 것이 육플루오르화우라늄(UF₆)인데, 이는 UO₂와 HF를 반응시켜 얻은 UF₄를 다시 F₂와 반응시켜 얻는다.
UO₂ +4HF → UF₄ +2H₂O
UF₄+ F₂ → UF₆
UF₆는 우라늄 화합물 중 가장 휘발성이 큰 흰색 고체로, 쉽게 승화되며, 56.5℃에서 승화 증기압이 1기압이 된다. UF₆는 실온 부근에서 매우 높은 증기압을 갖는다는 사실을 이용하여 ²³⁵U를 농축시키는데 주로 사용한다. UF₄를 고온에서 H₂로 환원시키면 UF₃가 얻어지고, UF₄와 UF₆를 반응시키면 다른 여러 가지 플루오린 화합물들이 얻어진다.
원소 우라늄이나 수소화우라늄(UH₃)를 Cl₂와 반응시키면 UCl₄가 얻어지고, 이로부터 여러 가지 다른 염화물들도 얻을 수 있는데, 이들 염화물들은 모두 물이나 공기와 잘 반응한다. 우라늄의 브로민화물(UBrn)이나 아이오딘화물(UIn)들도 비슷한 방법으로 얻는다. 이외에도 여러 가지 탄화우라늄(UC, UC₂, U₂C₃), 질화우라늄(UN, UN₂), 그리고 우라닐 화합물(UO₂ ²⁺ 화합물)들이 제조되었다.
우라늄-235의 농축[편집]
기체냉각로(냉각제로 기체를 사용하는 원자로)와 가압중수로(고압하의 중수 D₂O를 냉각제로 사용하는 원자로)를 제외한 대부분의 발전용 원자로와 핵무기에서 우라늄의 연쇄반응을 유지하기 위해서는 우라늄에 들어있는 ²³⁵U가 어떤 특정 농도와 무게(임계 질량) 이상이어야 한다. 0.72%의 ²³⁵U만 들어있는 천연 우라늄에서 ²³⁵U의 농도를 3~5%로 농축시킨 것이 농축 우라늄(enriched uranium)이고, 농축 우라늄을 생산하고 남은, 즉 ²³⁵U의 농도가 낮아진 우라늄을 감손우라늄(depleted uranium)이라 한다. 감손우라늄은 열화우라늄이라고도 하며, 보통 ²³⁵U의 농도가 0.3% 이하이다.
²³⁵U의 농축은 주로 ²³⁵UF₆ (분자량: 349.02)와 238UF₆(분자량: 352.03)의 질량차이를 이용하여 이루어진다. 맨해튼 계획에서 사용된 방법은 기체확산법 4) 으로, UF₆를 은-아연막을 통해 여러 번 반복 분출시키면 가벼운 분자인 ²³⁵UF₆가 더 빨리 확산∙분출되는 성질을 이용해 이를 농축시키는 방법이다.
현재 주로 사용하는 우라늄 농축 방법은 기체원심분리법인데, 원심분리관 위층에는 ²³⁵UF6가 그리고 아래층에는 ²³⁸UF₆가 처음보다 많이 있게 된다. 이 방법은 기체확산법에 비해 에너지가 1/60 정도만 들기 때문에 가장 저렴한 우라늄 농축 방법이다. 이외에도 레이저를 써서 동위원소를 분리시킬 수 있는데, 이는 ²³⁵U-F 결합과 ²³⁸U-F 결합의 작은 결합에너지 차이를 이용하는 것이다. 예로, 제논(Xe) 이온 레이저를 사용하면 ²³⁵UF6만 레이저 빛을 흡수하고 ²³⁵U-F 결합이 끊어지면서 ²³⁵U가 금속으로 분리되어 침전된다.
용도[편집]
퀴리 부부가 우라늄광인 피치블랜드에서 라듐을 발견하기 전까지는 우라늄의 용도가 노란색 유리, 도자기 유약, 여러 색의 타일을 만드는데 쓰이는 정도였다. 그러나 라듐이 발견되고 이를 야광 페인트와 방사선 치료에 사용하면서 라듐을 얻기 위해 우라늄광이 채굴되고, 그 결과 엄청난 양의 우라늄 폐기물이 쌓이게 되었다. 1930년대 말에 우라늄의 연쇄 반응이 발견된 후로 우라늄은 주로 원자폭탄 제조와 원자력 발전의 연료로 쓰이고 있다.
과거 냉전 시대에는 우라늄(이에서 생산되는 플루토늄 포함)이 핵무기 제조에 가장 많이 사용되었고 또 이를 위해 비축되었으나, 핵 무기 확충 경쟁이 거의 끝난 지금에는 대부분이 원자력 발전 연료로 이용된다. 원자력 발전은 전세계 에너지 공급량의 약 6%, 전력 생산량의 13~14%를 차지하며, 우리나라의 경우에는 전력 생산의 약 40%를 차지한다.
그러나 1986년 소련의 체르노빌, 그리고 2011년 일본의 후쿠시마 원전사고 등으로 원자력 발전의 안전성이 크게 문제가 되었다. 또 원자력 발전 과정에서 나오는 각종 방사성 폐기물의 저장과 처리, 그리고 핵 확산 우려 등이 문제시되고 있다. 안전성을 개선시키는 연구가 계속되고 있으며, 미래에는 핵 융합이 대안이 되어야 할 것으로 여겨 이에 대한 연구도 진행 중이다.
농축 우라늄을 생산하고 남은 감손우라늄(열화우라늄)은 전차나 탱크의 장갑판과 또 두꺼운 장갑을 뚫을 수 있는 관통자(열화우라늄 탄환)로 사용되며, 방사성 물질을 저장하고 운반하는 용기, 방사선의 차폐제, 항공기나 미사일의 항법 장치 등에 이용된다. 그리고 여러 우라늄 화합물들이 사진 토너로, 그리고 가죽과 나무를 염색하는데 사용되었다. 아세트산우라닐(UO₂(CH₃COO)₂)과 폼산우라닐(UO₂(HCOO)₂)은 전자 현미경에서 염색 시약으로 사용된다. 화성암에 들어있는 우라늄은 지질 연대 측정에 이용되며, 금속 우라늄은 큰 에너지의 X-선을 내는데도 사용된다.
우라늄이 인체에 미치는 영향[편집]
우라늄은 비록 방사성 원소이기는 하나, 반감기가 아주 길어 약한 방사선을 내며, 나오는 방사선도 투과성이 작은 α-입자이기 때문에 방사선에 의한 위험은 작은 편이다. 그러나 우라늄의 붕괴나 핵분열에서 생기는 라돈, 스트로듐-90, 아이오딘-131 등은 강한 방사성 물질로 이에 노출되면 상당한 건강의 위협을 받는다. 한편, 금속 우라늄은 화학적으로 독성이 큰데, 이는 몸 안으로 들어온 우라늄이 우라닐 이온(UO₂ ²⁺ )이 되고 이것이 뼈, 신장, 간 등의 생식 조직에 축적되어 이들의 기능을 저해할 수 있기 때문이다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원