네온
네온(Neon)은 비활성 기체에 속하는 화학 원소로 기호는 Ne이고 원자 번호는 10이다. 녹는점은 -248.59℃, 끓는점은 -246.08℃, 밀도는 0.9002g/L 이다. 단원자 분자 기체로 반응성이 거의 없어 비활성 기체라고도 하며 색깔과 냄새가 없고 공기 중에 0.00182% 포함되어 있는 원소로 비활성 기체로 매우 안정된 원소이다. 최외각전자가 모두 차 있어 다른 원소나 화합물과 반응하지 않기 때문에 스스로 연소하거나 다른 물질의 연소를 도와주지도 않는다. 단원자 분자(Ne)로 존재하며 색깔, 맛 , 냄새가 없으며 공기보다 가볍다. 동위원소로는 ²⁰Ne(90.48%), ²¹Ne(0.27%), ²²Ne(9.25%) 등이 존재하며 모두 안정하다.
개요
네온은 주기율표 제18족에 속하는, 대기 중 그리고 우주에 5번째로 많은 원소로 무색무취의 기체이다. 헬륨과 마찬가지로 옥텟규칙을 만족하고, 최외각 전자에 모든 전자가 꽉 들어차 있기 때문에 거의 화학 반응을 하지 않고, 매우 안정된 원소이다.
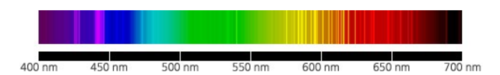
네온이라고 하면 밤거리를 수놓는 네온사인으로 친숙하다. 네온을 봉입한 유리관의 양극을 잇고, 방전하면 빛나는 원리를 이용한 것이 네온사인이다. 네온사인은 1910년 프랑스의 화학자 조르주 클로드에 의해 발명되어, 몇년만에 전세계의 대도시에 보급되었다. 요즘은 LED 등의 광원이 늘어나고 있지만 지금도 네온사인은 수명도 길고 보수가 간단하기 때문에 밤거리에는 빼놓을 수 없는 존재이다. 네온은 새빨간 빛을 발하기 때문에 빨강 이외의 네온사인에 봉입된 기체는 순수한 네온은 아니다. 예를 들면 헬륨은 노랑, 아르곤은 빨강~파랑, 수은은 청록색, 질소는 노란색을 발한다.
멀티탭이나 전자기기의 전원 표시용으로 사용되는 네온 전구에도 사용된다. 아르곤과 같이 봉입되기 때문에 주황색을 낸다.
영어권 한정으로 '니언'이라는 발음이 더 정확하다.
주요 생산국은 우크라이나인데, 동부 우크라이나 위기 때문에 수급이 매우 불안정해져, 네온이 필수적으로 사용되는 엑시머 방식의 레이저를 사용하는 반도체 관련 산업 현장이나 연구소, 대학원에는 비상이 걸려 있다.
네온은 화합물이 없다는 것으로 흔히 알려져 있는데, 엄밀히 말하면 그렇지 않다. 반데르발스 분자인 LiNe, 리간드 형태인 NeNiCO 등이 그 대표적인 예로, 엄청나게 많은 에너지를 가해야 하지만, 네온 화합물을 만들순 있다.
역사
네온은 1898년에 램지(William Ramsay, 1852~1916)와 그의 제자 트래버스(Morris W. Travers, 1872~1961)가 당시 새롭게 찾아낸 기체 아르곤(Ar, 1894년 발견)과 헬륨(He, 1895년 분리, 확인)의 성질을 연구하는 과정에서 발견하였다. 그들은 액화 공기의 저온 분별 증류를 통해 네온과 함께 다른 비활성 기체인 크립톤(Kr)과 제논(Xe)도 분리하였고, 스펙트럼으로 이들을 확인하였다. 네온을 전기적으로 들뜨게 하면 밝은 붉은색의 빛을 낸다는 것도 이들이 발견하였다. 이들 공적으로 램지는 1904년 노벨화학상을 수상하였다. 램지는 네온을 그리스어로 '새로운'을 뜻하는 'neos'를 따서 'neon'이라 이름지었다. 크립톤(krypton)과 제논(zenon)은 각각 그리스어로 '숨겨진 것'을 뜻하는 'kryptos'와 '낯선'을 뜻하는 'xenos'를 따서 명명하였다.
1902년에 프랑스의 '에어리퀴드(Air Liquide, 액화 공기란 뜻)'회사가 설립되고, 공기에서 네온을 분리∙생산하여 판매하기 시작하였다. 이 회사는 1910년에 네온 램프를 선보였고, 1912년에는 광고판으로 네온 방전관(네온사인)을 판매하기 시작하였다. 네온은 과학의 발전에 큰 기여를 하였다. 톰슨(Joseph John Thomson, 1856~1940) 경은 1913년에 기체 방전관에서 나오는 양이온의 조성을 연구하는 과정에서, 네온 양이온들이 이의 경로에 수직으로 걸어준 전기장과 자기장에 의해 두 개의 포물선을 그리며 휘는 것을 발견하였다. 이를 통해 그는 질량이 다른 두 가지의 네온 양이온이 있음을 발견하였다. 즉 네온의 동위원소를 발견하였다. 이는 한 원소에서 방사성이 아닌 안정한 동위원소가 존재할 수 있다는 최초의 발견이다. 또한 이 실험은 오늘날 과학의 여러 분야에서 중요하게 사용되는 질량분석(mass spectrometry)의 첫 번째 예이다.
네온을 비롯한 비활성 기체들이 잇달아 발견됨에 따라 이들이 주기율표에 0족(8B족)으로 들어가게 됨으로써 주기율표의 정확성이 입증되고, 가장 전기음성인 할로겐족 원소와 가장 전기양성인 알칼리 금속 사이의 연결 고리가 만들어졌다. 그리고 이들 원소들이 화학 반응성이 없고 단원자 분자로 존재한다는 사실에서, 원소들의 성질을 원자가 전자의 수로 설명하는 팔전자규칙(octet rule, 최외각 전자 껍질에 8개의 전자를 갖는 것이 가장 안정하다는 규칙)이 나오게 되었다.
물리적 성질
네온은 안정한 전자배치 1s²2s²2p⁶를 하고 있고, 색, 냄새, 맛이 없는 단원자 분자 기체이다. 다른 원자와 화학결합을 하지 않으며, 물에 대한 용해도도 낮다. 1 기압에서 네온의 녹는점은 -248.59oC (24.56K)이고 끓는점은 -246.08oC(27.07 K)이다. 따라서 네온이 액체로 존재하는 온도 범위는 2.51 oC에 불과하다. 같은 부피에서 비교할 때, 네온의 냉동 능력은 헬륨의 40배이고 수소의 3배이다.
네온은 3가지 안정한 동위원소가 있는데, 이들은 ²⁰Ne(90.48%), ²¹Ne(0.27%), ²²Ne(9.25%)이다. ²⁰Ne는 별에서 일어난 핵합성으로 생성되었는데, 2 개의 탄소 원자핵의 융합으로 만들어 졌다. 이와는 달리, ²¹Ne와 ²²Ne은 주로 ²⁴Mg와 ²⁵Mg가 중성자를 흡수한 후 α-입자를 내어 놓는 경로로 합성되었다.
¹²C + ¹²C → ²0Ne + ⁴He (α입자)
²⁴Mg(또는 ²⁵Mg) + ¹n → ²¹Ne(또는 ²²Ne) + ⁴He(α입자)
네온 화합물
네온 화합물은 오랜 기간 존재하지 않는 것으로 알려졌다. 중성 네온 원자가 결합되어 있는 분자는 21세기 들어서야 발견되었으며 오늘날까지도 잘 알려져 있지 않다. 네온은 비활성 기체로 1차 이온화 포텐셜이 21.564 eV로 24.587 eV인 헬륨에 이어 2번째로 높다. 즉 네온이 이온화하여 화합물을 이루기 위해서는 엄청나게 많은 에너지를 가해야 한다. 네온의 극갈림율은 0.395 Å3로 헬륨에 이어 모든 원소에서 두번째로 낮다. 극갈림율이 매우 낮다는 것은 네온이 다른 원자들과 거의 결합하러는 경향이 없다는 것을 뜻한다. 또한 네온의 양성자 친화성도 2.06 eV다. 이럼에도 불구하고 일시적으로 들뜬 이합체가 된 네온이 들어가 있는 분자 이온이 존재한다. 특정 중성 네온 분자는 안정할 것으로 예측되었으나 아직까지 발견된 적은 없다. 이외에도 네온은 다른 물질과 함께 결정체를 형성하여 클라스레이트 나 판데르발스 분자 형태 고체로 있을 수 있다.
참고자료
같이 보기

 위키원
위키원