라돈
라돈(Radon)은 화학 원소로 기호는 Rn, 원자 번호는 86이다. 라돈은 방사성 비활성기체로써 무색, 무미, 무취의 성질을 가지고 있으며 공기보다 무겁다. 자연에서는 우라늄과 토륨의 자연 붕괴에 의해서 발생된다. 가장 안정적인 동위 원소는 Rn-222으로 반감기는 3.8일이고, 이를 이용하여 방사선 치료 등에 사용된다. 라돈의 방사능을 흡입하게 되면 폐의 건강을 위협할 수 있다. 이러한 이유로 많은 과학자들이 라돈에 대한 화학적 연구를 꺼리고 있고, 그로 인해 아직까지 알려진 화학적 합성물질은 매우 극소수에 불과하다.
우라늄과 토륨이 납으로 자연붕괴되는 과정에서 라듐을 생성하게 되고, 이 라듐에 의해서 라돈이 생성되게 된다. 우라늄하고 토륨은 지구를 구성하는 물질 중에 하나이며, 지구상 어디에서나 흔히 존재하고 있다. 자연상태에 있는 우라늄의 반감기는 45억년, 토륨의 반감기는 140억년이다. 지구상에 우라늄과 토륨이 존재하는 한 계속적으로 라듐이 생성되고 그 과정에서 라돈이 생성되게 되어있다.
개요
라돈은 원자번호 86번의 원소로, 원소기호는 Rn이다. 주기율표에서 헬륨(He), 네온(Ne), 아르곤(Ar), 크립톤(Kr), 제논(Xe)과 함께 비활성(noble) 기체 족으로 불리는 18족(8A족, 과거의 0족)에 속하며, 이 족의 맨 아래에 있는 원소이다. 색, 냄새, 맛이 없는 기체로, 모든 동위원소들이 강한 방사선을 내고 반감기(t½)가 짧은 방사성 원소이다. 표준 상태(0℃ , 1기압)에서의 밀도는 9.73g/L로, 공기보다 약 8배 무겁다. 어는점은 -71.15℃ (202.0K)이고, 끓는점은 -61.85℃(211.3K)이다. 어는점 이하에서는 방사선으로 인해 밝은 노랑색 빛을 내는데, 온도를 낮추면 주황색으로 변한다. 물에 약간 녹고, 유기용매에는 보다 잘 녹는다. 화학 반응성은 거의 없으나, 산화력이 큰 원소들과의 화합물 몇 가지가 알려져 있다.
라돈의 동위원소 ²¹⁹Rn, ²²⁰Rn, ²²²Rn은 우라늄과 토륨의 자연 방사성 붕괴 사슬의 중간 생성물로 생성되는데, ²¹⁹Rn는 ²³⁵5U(천연 우라늄의 0.72%를 차지하며, t½은 7.04억년)의 자연 붕괴(악티늄 계열)에서, ²²⁰Rn 는²³²Th(천연 토륨의 거의 100%를 차지하며, t½은 140억년)의 자연 붕괴(토륨 계열)에서, 그리고 ²²²Rn는 ²³⁸U(천연 우라늄의 99.274%를 차지하며, t½은 44.7억년)의 자연 붕괴(우라늄 계열)에서 각각 ²²³Ra(t½=11일), ²²⁴Ra(t½=3.66일), ²²⁶Ra(t½=1600년)의 α붕괴로 생성된다(네이버캐스트 [라듐] 참조). 이들 라돈 동위원소들은 모두 α붕괴를 하여 폴로늄(Po)이 되고, 최종적으로는 납(Pb) 동위원소가 되는데, 중간 생성물로 여러 방사성 동위원소들이 생긴다. 예로, ²²²Rn의 방사성 중간 생성물로는 ²¹⁸Po(t½=3.1분), ²¹⁴Pb(t½=26.8분), ²¹⁴Bi(t½=19.9분), ²¹⁰Po(½=138.76일) 등이 있다
자연 방사성 붕괴 사슬에서 생성된 이들 ²¹⁹Rn, ²²⁰Rn, ²²²Rn중에서 ²¹⁹Rn(t½=3.96초)은 수명도 짧고 모 원자핵인 ²³⁵U의 존재 량도 적어 다른 두 가지에 비해 월등히 작은 양이 생성되어 곧 바로 붕괴된다. ²²²Rn는 ²²⁰Rn와 거의 같은 속도로 생성되나, 이의 반감기(3.82일)가 ²²⁰Rn의 반감기(55.6초)보다 훨씬 길어 월등히 높은 농도로 존재하게 된다. 따라서 자연에 존재하는 라돈은 거의 전부가 ²²²Rn이며, 그냥 라돈이라고 부르면 이를 가리킨다. ²²²Rn은 자연계에 존재하는 라듐(거의 전부가 ²²⁶Ra)의 α붕괴를 통해 생성되는데, ²²⁶Ra과 이에서 생성된 ²²²Rn은 우라늄광, 인광석, 화성암 및 변성암, 석회석, 흙, 석유 등에서 미량 발견된다. 라돈은 건조한 대기 중에 평균 약 6x10⁻¹⁴ppm(6/10²⁰)의 부피 비율로 들어있으며, 대기 중에 존재하는 전체양은 100g미만이다. 지각에는 약 4/10¹⁹의 무게 비율로 들어 있으며 화강암에는 1.7x10⁻¹⁰ppm의 무게 비율로 갇혀 있는데, 지진 활동 등으로 암반이 균열되면 대기로 방출된다. 따라서 환기가 잘 되지 않는 일부 건물의 실내나 지하실에는 외부 대기에서보다 월등히 높은 농도로 라돈이 축적될 수 있다. 일부 온천수, 광천수, 지하수 등에서도 평균 이상의 라듐과 라돈이 발견되는데, 원천수에 평균 이상의 이들이 녹아 있는 온천을 라듐 온천 또는 라돈 온천이라 부른다. 라돈이 필요한 경우, 보통 라듐에서 생성되는 것을 사용하는데, 1g의 라듐(²²⁶Ra)은 하루에 1/1000 cm³의 라돈(²²²Rn) 기체를 방출한다.
라돈(²²²Rn)과 이의 중간 붕괴 생성물들은 높은 에너지의 α입자를 방출하고 최종적으로 안정한 ²⁰⁶Pb가 되는데, 이 과정에서 β-선과 γ선도 방출된다. 과거에는 라돈을 암의 방사선 치료나 기체 누출 검사에 사용하기도 하였으나, 지금은 보다 효율적이고 안전한 방사성 동위원소들도 대체되었다. 미국 환경보호국(EPA)는 라돈 흡입이 흡연 다음으로 큰 폐암 발병의 원인이라고 경고하고 있다. 따라서 흙, 시멘트, 지반의 균열 등에서 방출되는 라돈 기체가 환기가 잘되지 않은 건물, 특히 지하실에 농축되는 경우가 생기지 않도록 주의해야 한다. 한편, 오래 전부터 라돈 또는 라듐 온천이 류마티스 등에 치료 효과가 있다고 여겨져 왔으나, 이에 대한 과학적 입증은 아직 되지 않은 실정이다.
라돈의 발견과 명명
방사능은 1896년에 프랑스 물리학자 베크렐(Antoine Henri Becquerel, 1852~1908)에 의해 처음 발견되었다. 1899년에 마리와 피에르 퀴리 부부는 라듐에서 방사성 기체가 나오며 이 기체의 방사능이 시간이 지날수록 줄어드는 것을 발견하고, 이 기체가 새로운 방사성 원소일 것으로 여겼으나 더 이상의 연구는 하지 않았다. 같은 해에 러더퍼드(Ernest Rutherford, 1871~1937)와 오언스(Robert Bowie Owens, 1870~1937)는 토륨산화물에서 방사성 기체가 나오며, 이 기체의 방사능이 몇 분간 지속되다가 거의 없어짐을 관찰하였다. 러더퍼드는 이 기체를 '발산물'이란 뜻으로 '에마나티온(emanation: 원소 기호 Em)'으로 불렀는데, 뒤에 토륨에서 발산되는 것임을 나타내기 위해 '토륨 에마나티온(thorium emanation: Th Em)'이라 불렀다. 1년 후인 1900년에 러더퍼드는 소디(Frederick Soddy, 1877~1956: 동위원소 발견의 공로로 1921년에 노벨 화학상 수상)와 함께 액화 질소를 사용하여 토륨 에마나티온을 응축시킬 수 있음을 보였다. 같은 해에 독일 물리학자 도른(Friedrich Ernest Dorn, 1848~1916)은 라듐 화합물이 든 용기 내에 방사성 기체가 축적되는 것을 발견하고는, 이 기체를 ‘라듐에서의 발산물’이란 뜻으로 '라듐 에마나티온(radium emanation: Ra Em)'으로 명명하였다. 그 후 1903년에는 드비에르느(André-Louis Debierne, 1874~1949)가 악티늄에서 나오는 발산물 기체를 발견하고 이를 '악티늄 에마나티온(actinium emanation: Ac Em)'이라 불렀다.
앞서 언급된 3가지 방사성 기체들에 대해 여러 다른 이름들이 제안되었는데, 1904년에는 이들기체의 원천에 따라 각각 엑스토리오(exthorio), 엑스라디오(exradio), 엑스악티니오(exactinio)란 이름이, 1918년에는 원천 원소의 이름에 비활성 기체의 접미어 'on'을 붙여 토론(thoron), 라돈(radon), 악톤(acton)이란 이름이 제안되었으며, 1920년에는 악톤을 악티온(action)으로 고쳐 제안하였는데, 1923년에 국제순수·응용화학연합(IUPAC)은 이들 각각의 이름과 원소 기호(각각 Tn, Rn, An)들을 채택하였다. 이들은 실제로는 라돈의 각기 다른 동위원소들인데, 당시에는 동위원소에 대한 개념과 존재 여부가 잘 확립되지 않아, 반감기가 다른 이들 동위원소들을 각각 다른 원소로 여기고 서로 다른 이름을 붙인 것이다. 뒤에 이들이 같은 원소의 동위원소임이 확인되고 동위원소들을 질량수로 구분하게 됨에 따라, 원소 이름은 가장 안정한 동위원소의 이름을 따라 라돈(Rn)이라 부르고, Tn은 ²²⁰Rn, Rn은 ²²²Rn, An은 ²¹⁹Rn으로 표시하게 되었다. 그러나 1960년대까지만 해도 라돈을 단순히 에마나티온(emanation)으로 부르기도 하였다. 한편, 천연 라돈은 거의 전적으로 라듐 에마나티온으로 부른 ²²²Rn이므로, 이를 처음 발견한 도른을 흔히 라돈의 발견자로 간주한다.
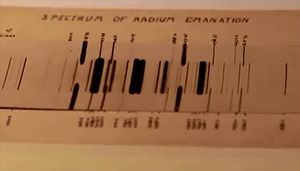
라돈의 성질을 알아내고 이 원소가 주기율표에서 비활성 기체 족에 속한다는 사실을 발견한 사람은 영국의 램지(William Ramsay, 1852~1916; 비활성 기체들의 발견과 이들 기체들이 주기율표에서 차지하는 위치를 결정한 공적으로 1904년에 노벨 화학상 수상)이다. 그는 1904년에 라돈 기체의 스펙트럼이 비활성 기체의 스펙트럼과 비슷하고, 실제로 화학 반응성도 거의 없는 것을 관찰하고는, 라돈이 비활성 기체 족에 속하는 새로운 원소라고 제안하였다. 1908년에 그는 그레이(Robert Whytlaw-Gray)와 함께 충분한 양의 라돈 기체를 분리하여 모으고, 밀도 등 몇 가지 성질들을 측정하였는데, 이 기체는 당시까지 알려진 기체 중 밀도가 가장 컸다. 1910년에 이들은 원소의 이름을 라틴어로 '빛을 내는 것'이란 뜻의 'nitens'를 따서 니톤(niton)이라 정하고 원소 기호를 Nt로 제안하였는데, 1912년에 국제원자량위원회(International Commission on Atomic Weights)는 이 제안을 받아들이기도 하였다.
물리적 성질
라돈은 강한 방사선을 내며, 색, 냄새, 맛이 없고 화학 반응성이 거의 없는 비활성 단원자 분자 기체이다. 표준 상태(STP: 0oC, 1기압)에서의 밀도는 9.73g/L로, 공기 밀도(1.217g/L)보다 약 8배 크다. 어는점은 -71.15℃(202.0K)이고, 끓는점은 -61.85℃(211.3K)이다. 강한 방사선을 내므로, 이에 의해 주위의 원자나 분자가 들뜨게 되어 빛을 내는데, 이런 현상을 방사선발광(radioluminescence: 방사선에 의해 빛을 내는 현상)이라 한다. 고체 상태에서 밝은 노랑색 빛을 내는데, 온도를 낮추면 주황색으로 발광 색이 변한다. 물에 대한 용해도2)는 20℃에서 230cm³/L로, 다른 비활성 기체의 용해도(Ar, 33.6cm³/L; Kr, 59.4cm³/L; Xe, 108.1cm³/L)보다 크다. 유기용매에는 물에서보다 더 잘 녹는다. 결정은 면심입방(fcc) 구조를 한다.
- 동위원소와 방사성 붕괴
라돈의 동위원소들은 모두 반감기가 짧은 방사성 동위원소이다. 가장 안정한 동위원소는 반감기((t½)가 3.82일인 ²²²Rn이다. 자연에서는 ²¹⁹Rn(t½=3.96초), ²²⁰Rn(t½=55.6초), ²²²Rn의 3가지 동위원소로 극미량 검출되는데 ²²²Rn이 거의 대부분을 차지한다. 이들은 모두 우라늄과 토륨의 자연 방사성 붕괴 계열에서 각각 ²²³Ra, ²²⁴Ra, ²²⁶Ra을 거쳐 생성된다. 이들 외에 ²¹⁸At의 β- 붕괴에서 생성되는 ²¹⁸Rn(t½=3.5 x10⁻²초)이 극미량 검출되기도 한다. 질량수가 195~229 범위에 있는 31가지 라듐 동위원소들이 인공적으로 생성되어 확인되었는데, 이중에서 반감기가 긴 것들은 210Rn(t½=2.4시간), 211Rn(t½=14.6시간), ²²⁴Rn(t½=1.8시간)이고 나머지들은 반감기가 30분보다 짧다. 질량수가 222 이하인 라돈 동위원소들은 주로 α붕괴를 하고 폴로늄(Po) 동위원소가 되는데, 일부는 β+ 붕괴를 하고 아스타틴(At) 동위원소가 되기도 한다. ²²²Rn는 α붕괴만을 하는데, 이에서 방출되는 α입자의 평균에너지는 5.590MeV이다. ²²²Rn보다 무거운 동위원소들은 거의 β- 붕괴만을 하고 프랑슘(Fr) 동위원소가 된다. 12가지의 준안정한 핵 이성체들이 알려져 있는데, 반감기가 가장 긴 것은 203mRn(t½=26.7초)이다.
- 방사선 양과 라돈 농도 단위
방사선 양의 국제 단위(SI)는 베크렐(Bq)인데, 1 Bq는 1초에 원자 1개가 방사성 붕괴할 때 나오는 방사선 양이다. 널리 사용되는 또 다른 단위는 퀴리(Ci)인데, 1 Ci는 1g의 라듐(²²⁶Ra, t½=1600년)이 1초 동안 붕괴할 때 나오는 방사선 양으로, 1초당 3.7x10¹⁰개의 원자가 붕괴할 때 나오는 방사선 양과 같다. 따라서 1 Ci = 3.7x10¹⁰Bq이다.
대기 중의 라돈 농도는 화학에서 일반적으로 사용하는 농도(mol/m³, mol/L, g/m³, 또는 g/L)로 표시하기에는 너무 낮아, 흔히 단위 부피당 방사선 양으로 나타낸다. 또 방사선 양을 나타내는 퀴리(Ci)도 너무 큰 값이기 때문에, 이의 1/10¹²인 피코 퀴리(pCi)의 단위를 흔히 사용한다. 보통 사용되는 라돈 농도 단위는 pCi/L 또는 Bq/m³인데, 1pCi/L = 3.7x10⁻² Bq/L = 37 Bq/m³이고, Bq/m³은 2.1 x10⁻¹⁶g/m³에 해당한다. 대기 중의 라돈 농도는 장소에 따라 크게 다른데, 평균적으로 대략 4 Bq/m³이다, 이는 공기 1L에 약 2000개의 라돈 원자가 들어있는 것에 해당하는데, 공기 1L에 들어 있는 각종 분자의 총 수는 약 2.7x10²²개이다.
화학적 성질
라돈은 다른 비활성 기체와 마찬가지로 화학 반응성이 거의 없다. 1960년대 초에 제논(Xe) 등의 비활성 기체도 플루오린(F)처럼 아주 반응성이 큰 원소와는 화합물을 만드는 것이 발견된 이후, 라돈의 경우도 몇 가지 화합물과 이온들이 확인되었는데, 이들은 화합물 항에서 소개된다.
라돈의 생산
라돈은 산업적으로는 우라늄 광석의 처리 과정에서 부산물로 얻는다. 광석을 1% HCl이나 HBr 용액에 넣어 처리하면 라돈, 수소, 산소, 헬륨, 수증기, 탄산가스 등의 기체가 나오는데, 이를 720℃의 구리 위로 통과시켜 수소와 산소를 제거한 후, KOH와 P₂O₅가 담긴 관을 통과시켜 산과 수증기를 제거한다. 남은 라돈 기체는 액체 질소를 써서 응축시킨 후, 승화로 정제한다.
라돈은 라듐(²²⁶Ra, t1/2=1600년)의 자연 방사성 붕괴에서도 얻어진다. 물 속에 라듐 화합물을 두면 라돈 기체가 나오는데, 이 기체를 유리관에 모으고, 함께 들어있는 다른 기체들을 앞에서 언급한 방법으로 제거하면 순수한 라돈 기체가 얻어진다. 1g의 라듐에서 하루에 0.001mL의 라돈이 얻어진다.
지금은 라돈이 실용적으로 거의 사용되지 않으며, 다만 ²²²Rn 검출기 보정용으로 라돈의 전구물질인 라듐 용액이 가끔 사용될 뿐인데, 이 용도의 표준 용액(어떤 순간의 ²²²Rn 존재량이 약 3x10-⁻¹²g인 ²²⁶RaCl2 용액) 0.2mL를 미국표준기술연구소(NIST)에서 미화 $1635로 구입할 수 있다.
라돈의 용도
라돈의 이용은 이와 이의 핵 붕괴 생성물에서 방출되는 강한 방사선을 이용하는 것이다. 보통 수명이 짧은 라돈을 바로 분리하여 이용하기 보다는 ²²⁶Ra를 사용하여 라돈을 계속 발생시켜 사용한다. 20세기 초반에는 라돈 기체를 밀봉된 금 바늘에 넣고 생체에 이식시켜 암의 방사선 치료에 사용하였는데, 이때에는 α와 β선은 걸러내고 γ선만 통과시켜 암 세포를 파괴하도록 하였다. 그러나 건강한 세포도 방사선에 의해 손상되고, 또 조작이 복잡하여 지금은 다른 방사성 동위원소들로 거의 대체되었다. 라돈은 또한 다른 기체나 액체에 첨가되어, 기체가 새는 것을 검출하는데도 사용되었다.
라돈은 기름과 같은 물질에 잘 흡착되기 때문에 기름으로 오염된 토양의 연대 측정에 사용되었다. 또 어떤 지하수에는 라돈이 높은 농도로 들어있으므로, 하천의 라돈 농도는 지하수의 유입 여부를 나타내는 지표로 사용되기도 한다. 지각에 갇혀있는 라돈은 암반이 균열되면 대기 중으로 방출되는데, 라돈은 반감기가 짧기 때문에 대기 중의 라돈은 최근에 유출된 것이다. 따라서 대기 중의 라돈 농도의 증가 여부로 새로운 지각 균열을 검출하고 대 지진을 예측하려는 시도도 있다.
한편, 오래 전부터 라돈이나 이의 전구 물질인 라듐이 평균치보다 많이 들어있는 온천수, 식수 등은 건강에 효능이 있고 류마티스 관절염이나 스트레스에 연관된 질환을 치료하는 효과가 있다고 여겨져 널리 애용되었다. 일본에서는 일부 식당에서 식수에 라돈이 포함된 기체를 불어넣은 것을 제공하기도 하였다. 그러나 이들 효능에 대한 확실한 과학적 근거는 없는 실정이며, 오히려 높은 농도의 라돈에 장기간 노출되면 폐암, 위암 등을 일으킨다고 알려져 있다.
라돈 화합물
1960년대 초반에 제논(Xe) 화합물들이 합성되면서 비활성 기체 원소들도 화합물을 만들 수 있음이 확인되었다. 라돈의 경우도 제논과 유사하게 플루오린(F), 산소(O)와의 화합물들이 알려져 있다. 그러나 강한 방사선을 내고 수명이 짧으며, 용도도 없어 알려진 화합물의 종류는 매우 적다.
가장 잘 알려진 라돈 화합물은 플루오르화물인데, 1962년에 라돈과 플루오린(F₂)과의 반응에서 고체로 얻어졌으며 방사성 붕괴에 의해 노랑색 빛을 낸다. 이 화합물은 증발이 잘 되지 않으며, 증발시키려고 가열하면 250℃ 이상에서는 원소들로 분해된다. 화학적 조성은 확실하지 않으나 RnF₂로 짐작된다. RnF₂는 계산상으로는 XeF₂보다도 안정하고, 다른 비활성 기체의 플루오린화물과는 달리 이온성 화합물일 것으로 여겨지고 있다. RnF₄와 RnF₆도 합성하였다는 보고가 있으나, 정말로 합성되었는지는 확실하지 않다.
라돈의 산화물인 삼산화라돈(RnO₃)도 존재하는 것이 확인되었으며, 이원자 분자 형태의 라돈(Rn₂), 제논화라돈(RnXe), 라돈카르보닐(RnCO) 등도 이론적으로는 안정할 것으로 예측되었다. 또한 2010년에는 HRnCCH와 HORnH도 존재할 수 있다고 예측되었는데, Rn대신 다른 비활성 기체 원소인 Kr이나 Xe이 들어간 해당 화합물은 이미 합성된 바 있다.
한편, 몇 가지 라돈 내포화합물(클라스레이트, clathrate: 어떤 화합물이 만든 3차원 골격 구조의 빈 공간에 원자 또는 분자가 물리적으로 갇혀서 생긴 화합물)들도 알려져 있다. 그 중 하나는 풀러렌(fullerene, C₆₀) 우리(cage) 속에 라돈이 들어간 것으로 암의 방사성 치료제로 제안되었으며, 다른 하나는 물 분자가 만든 우리 속에 라돈 분자가 갇힌 라돈 수화물(radon hydrate)로, 이런 형태의 기체 수화물은 다른 비활성 기체(He, Ne 제외), CH₄, H₂S, Cl₂, CHCl₃ 등에 대해서는 이미 잘 알려져 있다.
생물학적 역할과 위험성
라돈의 직접적인 생물학적 역할은 없으나, 이에서 방출되는 방사능이 지구상의 배경 방사능(background radioactivity)의 주된 몫을 차지하는 것으로 미루어 볼 때, 이에 의한 유전자 변형이 생명체의 진화에 간접적인 역할을 하였을 것으로 여겨지고 있다. 라돈은 라돈 자체 혹은 이의 방사성 붕괴 생성물들이 내는 강한 방사선때문에 인체에 매우 해로운 원소이다. 중세 시대부터 광산에서 일했던 광부들이 수명이 짧고 폐병(폐암)으로 사망한 경우가 많았는데, 이의 주된 원인이 라돈으로 여겨지고 있다. 라돈은 또한 흙, 암반, 건축재료 등에 들어있는 라듐(우라늄의 자연 방사성 붕괴에서 생성됨)의 방사성 붕괴에서 방출되므로 환기가 잘 되지 않은 건물의 실내, 특히 지하실에 라돈 기체와 이에서 생성된 방사성 물질들이 축적되어 거주자의 건강을 위협할 수 있다. 대기에서의 라돈 함량은 지역에 따라 크게 다른데, 넓은 바다를 면한 해안에서의 평균 농도는 1 Bq/m³, 대륙에서의 평균 농도는 약 10 Bq/m³, 실내의 평균 농도는 39 Bq/m³인 것으로 보고되었다. 미국 환경보호국(EPA)은 라돈 흡입이 흡연 다음으로 큰 폐암 발병 요인이며 실제로 폐암 환자의 약 10%가 라돈 흡입에 의한 것으로 간주하고, 실내 환경의 라돈 농도가 148 Bq/m³ 이하가 되도록 권고하고 있다. 그러나 어떤 집의 지하실에서는 약 10만 Bq/m³의 라돈이 검출되기도 하고, 어떤 우라늄 광산에서는 100만 Bq/m³의 라돈이 검출되기도 하였다.
참고자료
같이 보기

 위키원
위키원