인산
인산(燐酸, phosphoric acid)은 무기 산소산의 일종으로, 화학식은 H₃PO₄이다. 인산은 산 자체와 PO4³⁻이온을 동시에 가리키기도 하며, 대체로 화학에서의 인산은 산으로서 인산을 포함하는 산성 반응물을 가리킨다. 한편 생명체에서 인산은 대체로 PO₄³⁻이온을 나타내는데, 이때 인산은 생체내에서 다수의 물질과 결합하여 인산이 포함된 화합물을 구성하고 있으며, DNA사슬에 포함된 인산이 대표적이다. PO₄³⁻는 보통 인산 이온(phosphate ion)이라고 한다. 인산 이온이 양이온과 이온 결합한 상태는 인산염이라고 한다.
개요
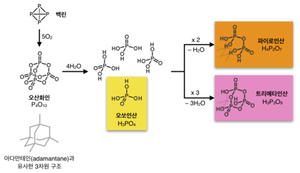
인산은 오산화인(phosphorus pentoxide)의 가수분해로 만들어지는 산으로서, 넓은 범주에서는 인 산소산(phosphorus oxyacid)의 일종이다. 인산의 원료가 되는 오산화인은 P₂O₅의 실험식으로 표기하지만, 실제 분자식은 P₄O₁₀이며, 백린(white phosphorus; P₄)과 산소의 반응을 통해 얻는다 (식 (1)). 이 산화 과정을 통해 인은 가장 높은 +5의 산화수를 갖게 된다.
P₄ +5O₂ → P₄O₁₀ (1)
P₄O₁₀ + 6H₂O → 4H₃PO₄
오산화인 가수분해 반응(식 (2))의 생성물인 H₃PO₄는 인산의 가장 단순한 형태로 오쏘인산(orthophosphoric acid, 또는 오르토인산)이라고 부른다. 오쏘인산 두 분자의 축합반응으로 파이로인산(pyrophosphoric acid, H₄P₂O₇; 피로인산, 이인산, 혹은 초성인산으로도 불린다)이 얻어진다
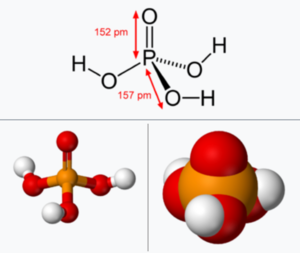
오쏘인산 세 분자가 세 개의 물 분자를 잃으면서 축합되면 위 그림처럼 고리 모양을 갖는 트리메타인산(trimetaphosphoric acid, H3P3O9 )이 얻어진다. 올리고머 형태의 인산은 Hₙ₊₂Pₙ O₃ₙ₊₁의 일반식으로 쓸 수 있는데, 선형 분자 양쪽 끝의 축합 반응을 통해 물 분자 하나를 제거해서 고리를 만들면 HₙPₙ O₃ₙ의 조성이 된다. 이 글의 아랫부분부터는 가장 간단한 형태이면서 가장 널리 쓰이는 오쏘인산을 인산으로 부르기로 한다.
정제된 인산은 상온에서 결정성이 있는 고체(녹는점: 42.3 °C)로 밀도는 2.030 g cm⁻³ (25°C 기준)이다. 인산은 446 g / 100 mL 정도로 물에 녹으며 (14.95°C 기준),1) 수용액에서 삼양성자산(triprotic acid)으로 작용하여 양성자를 세 개까지 내놓고, H₂PO₄⁻, HPO₄²⁻, PO₄³⁻의 세 가지 음이온을 만들 수 있다. 시판되는 85% 수용액은 점도 2.4-9.4 cP 정도의 끈적한 액체이다.
인산염(phosphate) 및 인산에스테르로 널리 생물계에 분포하며, 생체에서 인은 대개 인산의 형태로 존재한다.
인산은 양성자가 세 개나 붙어있는(H₃PO₄) 다양성자산인데, 다양성자산이면서 pKa값이 절묘하기 때문에 완충용액으로 널리 쓰인다. 특히 생체내에 많이 포함되어 있다는 특징 때문에 마땅한 버퍼를 찾기 힘든 생물질의 완충용액으로 사용할 수 있다. 그렇다고 해서 실제로 인산만 쓰는 건 아니고, 더 좋은 버퍼들도 많이 쓴다. 분석화학 교과서에 웬만해서는 인산 버퍼의 pH 구하는 문제는 나온다.
칼슘 화합물과 반응하여 '인산칼슘'이라는 화합물을 만든다. 칼슘과의 반응성이 상당히 강하다 보니 인산이 폐수에 섞여들어갔을 때 산화칼슘을 사용하여 인산을 제거하는 방식으로 사용하거나, 또한 녹 제거나 변기 세척용으로도 요긴하게 쓰인다. 순수한 인산칼슘을 다른 무기물과 섞어서 비료로 만들어 주기도 한다.
반대로 인산칼슘은 동물의 몸에 잘 흡수되지 않는데다 칼슘과의 반응도가 높아 동물이 칼슘을 이용하는 것도 방해하는데, 우유와 함께 인산이 들어간 음식을 먹으면 인산칼슘이 되어서 몸에 흡수되지 않고 배출되며, 콜라 등 청량음료에도 많이 들어있어 충치의 원인으로 지목받는다. 환경운동가 최열이 이 사실을 특히 강조하며 인산이 든 음식을 피할 것을 권유했다.
ATP, DNA, RNA, 세포막, 뼈의 구성성분이며, 그렇기 때문에 지구상의 모든 유기생명체의 필수요소다.
생산과 활용
인산은 인광석(phosphate rock)을 원료로 만든다. 중국, 미국, 모로코, 러시아에서 생산하는 인광석의 양이 전 세계 생산량의 약 80% 정도를 차지한다. 인광석은 습식법이나 건식법을 사용해서 인산으로 전환한다.
습식법은 수산화 인회석(calcium hydroxyapatite, Ca₅(PO₄)3OH)과 같은 인광석을 황산으로 처리해서 인산을 생산하는 방법이다 (식 (3)). 전세계적으로 대량 생산되는 황산의 중요한 공업적 용도가 여기에 있다.
Ca₅(PO₄)3OH + 5H₂SO₄→ 3H₃PO₄ + 5CaSO₄ + H₂O
또 다른 인광석인 플루오린화 인회석4)(fluoroapatite, Ca₅(PO₄)3F)의 경우에는 NaSi₂F₆의 형태로 플루오르화 음이온을 제거해서 인산을 얻는다.
건식법에서는 인광석을 코크스로 환원시켜 원소 상태의 인을 먼저 만드는데, 이 과정에서 실리카를 첨가하여 규산 칼슘 부산물을 형성하는 방법으로 칼슘을 분리해낸다. 생성된 인은 증류를 통해 정제한 후 공기로 연소해서 높은 순도의 오산화인을 만든다 (위 그림 참조). 이렇게 생산한 오산화인을 물에 녹이면 높은 순도의 인산을 얻을 수 있다.
인산은 암모늄 인산염의 형태로 대부분 비료로 사용한다. 전세계 인산 생산량의 90%가 비료로 쓰인다. 그 외에도 비누, 세제, 식품 첨가물, 수질 처리, 치약, 섬유 산업 등에 이용된다.1) 31P NMR 분광법의 외부 표준 물질로 쓰기도 한다.
화학반응
H₃PO₄ (s) + H₂O (l) ⇌ H ₃O + (aq) + H₂PO₄⁻ (aq) K a1 = 7.11 × 10 ⁻³
H₂PO₄⁻ (aq) + H₂O (l) ⇌ H ₃O + (aq) + HPO₄²⁻ (aq) K a2 = 6.34×10 ⁻⁸
HPO₄²⁻ (aq) + H₂O (l) ⇌ H ₃O + (aq) + PO₄³⁻ (aq) K a3 = 3.98×10 ⁻¹³
인산의 중요성
ATP
ATP는 생체 내의 중요한 에너지 화폐이다. ATP에는 인산기가 3개가 있는데 구조의 바깥에서부터 γ인산기, β인산기, α인산기이다. 바깥에서부터 차례대로 인산기가 분리되면서 에너지를 발생시킨다.
인지질
인지질은 지질의 한 종류이며, 구조 중에 인산 에스터를 가지고 있다. 세포막 같은 생체막의 중요한 구성 성분이다.
DNA와 RNA
핵염기와 디옥시리보스에서 구성되는 디옥시리보뉴클레오사이드의 인산기가 결합한 디옥시리보뉴클레오타이드는 생명 유전자 본체인 DNA 구성 단위이다.
참고자료
같이 보기

 위키원
위키원