에틸렌
에틸렌(ethylene)은 C₂H₄의 화학식을 갖는 유기화합물이며 IUPAC 명명법으로는 에텐(ethene)이라고 한다. 탄소와 탄소 사이에 이중 결합을 갖는 탄수소화합물을 통칭하는 알켄(alkene)류에서 가장 간단한 형태이다. 합성 고분자인 폴리에틸렌의 원료로써 세계에서 가장 많이 생산되는 유기화합물이기도 하다. 자연계에서는 과일을 익게 하는 식물 호르몬으로 발견되기도 한다.
개요
에틸렌은 흔히 석유화학의 쌀이라 불리운다. 그 이유는 석유나 천연가스에서 정제해 얻는 기본 원료로써 그 활용성이 무궁무진하기 때문이다. 에틸렌은 주변에 흔한 플라스틱, 비닐부터 시작해 합성고무, 각종 건축자재, 접착제나 페인트까지 일상에서 사용하는 다양한 제품을 만드는 석유계 기초 유분이다. 에틸렌은 통상적으로 석유화학산업 규모를 나타내는 '기준' 혹은 '지표'로 많이 활용된다. 세계적으로도 에틸렌을 많이 생산하는 나라일수록, 그 나라의 석유화학산업 규모가 크다는 뜻이다. 에틸렌은 구조가 간단해 석유화학산업의 다양한 원천 원료로 활용되고 석유화학의 기본 원료 중에서도 가장 많이 생산되기 때문이다.
발견
에틸렌 발견에 대한 가장 오래된 기록은 1669년, 독일의 화학자 요한 요아힘 베처가 자신의 책에서 언급한 것이다. 그는 에탄올을 황산으로 가열해 에틸렌 가스를 얻었다. 이후 1794년 네덜란드 화학자들은 에틸렌 기체를 염소와 반응시켜 1,2-디클로로에탄 액체를 얻었다. 이때 이들은 에틸렌을 '기름을 만드는 기체'라고 불렀다. 옛날 사람들도 과일을 숙성시키고 성장을 촉진시키는 에틸렌의 존재는 어렴풋이 알고 활용해 왔다. 고대 이집트인들은 무화과를 빨리 익히기 위해 일부러 상처를 냈고, 중국의 농부들은 폐쇄된 방 안에 배를 놓고 향불을 피워 에틸렌을 촉진했다.
식물 호르몬으로써 에틸렌을 처음 발견한 사람은 러시아의 과학자 드미트리 넬류보프이다. 넬류보프는 1800년대 말, 실험실에서 완두콩을 키우면서 당시 불빛으로 사용하던 석탄 가스에서 나온 에틸렌 때문에 완두콩이 '특이하게 자란다'고 생각했다. 이후 1934년 영국의 과학자 리차드 게인은 사과가 만들어 낸 에틸렌을 분리해 내면서 최초로 기체 식물 호르몬을 증명해냈다.[1]
구조
에틸렌의 두 탄소가 모두 sp² 혼성 오비탈을 가지고 있어 모든 원자가 같은 평면에 놓여있는 평면 구조를 갖는다. C=C 이중 결합의 길이는 1.34 Å이고 C-H의 결합 길이는 1.09 Å이며, H-C=C 결합각은 121.3°이다. 에틸렌의 탄소-탄소 간 π결합으로 인해 여러 가지 친전자체와 비교적 쉽게 반응할 수 있다. 탄소-탄소 간 이중 결합은 특히 전이 금속과 착물을 잘 형성할 수 있어서 전이 금속을 촉매로 하는 반응들이 비교적 많다.
성질
상온에서는 무색의 기체상태로 존재한다. 냄새가 나며, 인화성이다. 녹는점은 -169.15°C, 끓는점은 -103.71°C이다. 임계온도는 9.5°C, 임계압력은 49.98atm이다. 밀도는 0°C, 760mmHg에서 1.26g/l이다. 물에 약간 녹는다. 공기 중에서 태울 경우 빛을 발하며 탄다.
분자를 구성하는 원자는 모두 한 평면 위에 위치하고 있으며, C=C의 결합 길이는 1.35Å, C-H의 결합 길이는 1.07Å이다. H-C-H결합 간의 결합각은 거의 120도에 가깝다.
화학적 성질
에틸렌은 이중 결합의 존재로 인한 활성으로 인해 여러 가지 반응에서 중요한 역할을 한다. 에틸렌이 일으키는 반응 중 대표적인 것은 다음과 같다.
- 에틸렌은 염화 수소와 산 촉매 하에서 염화 에틸을 생성한다. 반응식은 다음과 같다.
- CH₂=CH₂ + HCl → CH₃-CH₂Cl
- 에틸렌은 산화되어 아세트알데하이드를 생성한다. 반응식은 다음과 같다.
- CH₂=CH₂ + 1/2 O₂ → CH₃CHO
- 에틸렌은 산화되어 산화 에틸렌을 생성할 수도 있다.
- 에틸렌은 물과 첨가반응을 하여 에탄올을 내놓는다.
- CH₂=CH₂ + H₂O → CH₃CH₂OH
- 에틸렌은 옥시염소화(Oxychlorination)반응을 통하여 이염화 에틸렌을 생성한다. 반응식은 다음과 같다.
- CH₂=CH₂ + 2 HCl + 1/2 O₂ → C₂H₄Cl₂ + H₂O
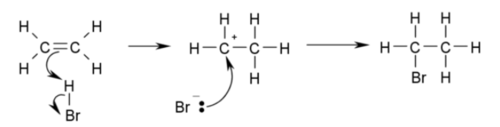
- 에틸렌은 할로젠과 첨가 반응하여 할로젠화합물을 만든다.
- 하이포아염소산이나 하이포아브로민산과 반응하여 각각 에틸렌 클로로하이드린과 에틸렌 브로모하이드린을 생성한다.
- 아이오딘화 수소나 브로민화 수소와 반응하여 각각 아이오딘화 에틸, 브로민화 에틸을 생성한다.
- 수소와 촉매하에 반응하여 (예를 들어, 150°C에서 니켈 촉매) 에테인을 생성한다.
- 진한 황산과 160°C에서 반응하여 황산 수소 에틴을 만든다.
- 에틸렌을 과망간산 칼륨으로 산화시켜 에틸렌 글리콜을 만들 수 있다. 그러나 이염화 에틸렌이나 클로로하이드린로부터 에틸렌 글리콜을 만드는 방법이 더 선호된다.
생물학적 성질
에틸렌은 식물호르몬의 일종이다. 과일 성숙 호르몬 또는 스트레스 호르몬으로도 불린다.
- 에틸렌의 발견 : 1800년대 가스관에서의 가스누출로 인하여 근처의 나무들의 잎이 일찍 떨어지는 현상이 발견되었고 이후 1901년 러시아의 과학자 넬류보프(Neljubow)는 이 현상이 에틸렌으로 인한 것임을 밝혔다.
- 에틸렌의 합성 : 이 기체호르몬은 합성량이 매우 낮은 편인데, 식물은 씨의 발아. 식물의 노화, 그리고 과일의 성숙 등 식물의 생장과 상처를 받거나 병원체의 공격을 받았을 때, 그리고 산소의 부족, 가뭄, 냉해 등 다양한 스트레스에 의해서 에틸렌을 합성한다. 또한 에틸렌은 과일이 성숙할 때나 예정세포사가 일어날 때도 합성된다.
- 에틸렌의 작용 : 낮은 농도(0.1ppm)에서도 식물의 생장과 발생에 중요한 영향을 끼친다.
에틸렌의 제법
일반적으로 탄소수 2 이상의 탄화수소를 700°C~900°C 정도의 고온에서 열분해하면 에틸렌을 주성분으로 하는 가스를 얻을 수 있다. 공업적으로 에틸렌을 제작하는 방법은 여러 가지가 있는데, 방식의 선택은 사용할 수 있는 원료, 제조 규모, 공장입지 조건 등에 의해 다양하게 결정된다. 에틸렌을 제작하는 방법으로는 다음과 같은 것이 있다.
- 에테인을 수증기로 묽게 하고 700~750°C에서 열분해한다. 원료에 프로페인, 뷰테인 등이 포함되어 있어도 가능하다. 미국 등 습성 가스를 비교적 쉽게 구할 수 있는 지역에서 주로 이용된다. 반응식의 예는 다음과 같다.
- CH₃CH₃ → C₂H₄ + H₂
- CH₃CH₂CH₃ → C₂H₄ + CH₄
- 석유를 열분해한다. 에틸렌은 원유에 포함되어 있는 거의 모든 파라핀계 탄화수소와 나프타계 탄화수소 크래킹 과정에서 부산물로 얻을 수 있다. 프로펜, 뷰텐, 펜텐 등이 부산물로 같이 생산될 수 있다. 습성 가스를 비교적 구하기 힘든 일본이나 서유럽에서 주로 사용된다. 최근에는 에테인 열분해법 보다 더 선호되는 추세이다.
- 부분 연소법을 사용한다. 이는 원료 탄화수소의 일부를 연소시켜 그 열로 나머지 부분을 분해하는 방식인데, 에틸렌을 아세틸렌과 함께 얻을 수 있고, 남은 가스는 합성가스로 이용할 수 있다.
- 아세틸렌을 수소화하여 에틸렌을 얻는다. 석유 분해법 등에 의한 에틸렌 제조가 활발한 오늘날에는 그다지 사용되지 않는다.
- 에탄올을 탈수하여 에틸렌을 얻는다.
- 코크스로가스에서 분리하여 에틸렌을 얻는다.
실험실 환경에서는 에탄올을 진한 황산으로 탈수시키거나, 활성 알루미나를 촉매로 하여 기체상 탈수를 이용하여 에틸렌을 만들 수 있다.
용도
에틸렌을 원료로 하여 가장 많이 생산되는 공업적 제품과 그 공정들은 아래와 같다.
- 저밀도 폴리에틸렌(LDPE: low-density polyethylene) 및 선형 저밀도 폴리에틸렌 (LLDPE: linear low-density polyethylene) (에틸렌의 중합반응)
- 고밀도 폴리에틸렌(HDPE: high-density polyethylene) (에틸렌의 중합반응)
- 1,2-다이클로로에테인 (에틸렌에 염소 첨가 반응)
- 에틸렌 옥사이드 (은 촉매를 사용한 에틸렌의 산화 반응)
- 에틸 벤젠 및 스타이렌 (에틸렌과 벤젠을 반응시켜 에틸 벤젠을 만들고 이를 탈수소 반응시켜 스타이렌을 만듦)
- 아세트알데하이드 (에틸렌을 산화시켜 생산함)
- 에탄올 (에틸렌에 물 첨가 반응)
- 바이닐 아세테이트 (에틸렌에 아세트산 및 산소를 반응시켜 생산)
각주
- ↑ 함봉균 기자, 〈(대한민국 희망 프로젝트)<696>에틸렌〉, 《전자신문》, 2021-02-14
참고자료
- 〈에틸렌〉, 《화학백과》
- 〈에틸렌〉, 《위키백과》
- 함봉균 기자, 〈(대한민국 희망 프로젝트)<696>에틸렌〉, 《전자신문》, 2021-02-14
같이 보기

 위키원
위키원