아미노산
아미노산(amino acid)은 생물의 몸을 구성하는 단백질의 기본 구성 단위로, 단백질을 완전히 가수분해하면 암모니아와 함께 생성된다. 화학적으로 아미노기와 카복실기를 포함한 모든 분자를 지칭하기도 하며 화학식은NH₂CHRnCOOH(n=1~20)이다.
생화학에서는 흔히 α(알파)-아미노산을 간단히 아미노산이라 부른다. α-아미노산은 아미노기와 카복실기가 하나의 탄소(알파 탄소라고 부른다)에 붙어있다. 아미노산의 일종인 프롤린(proline)은 실제로는 아미노기 대신 이차 아미노기를 포함한 2차 아민인데 생화학적으로 보통의 아미노산과 비슷한 기능을 수행하기 때문에 2차 아미노기를 가진 프롤린도 아미노산으로 분류한다.
목차
개요[편집]
보통 아미노산이라고 하면 단백질을 구성하는 기본적인 성분들이라고 보면 된다. 그러나 단백질의 구성 요소가 아닌 비단백 아미노산이라는 것도 존재한다.
조직의 성장과 유지에 관여한다. 또한 호르몬과 효소, 항체 등의 주요 구성성분이 된다. 각기 고유의 기능을 가지고 있다. 부족하면 성장기 어린이의 성장 지연과 성인의 체중 감소를 유발하고 인체 대사 조절에 영향을 미칠 수 있다.
식물이 광합성 과정에서 합성하고, 동물은 다른 식물이나 동물을 먹어서 얻는다. 구성 원자 중에 질소가 들어가 있는데 식물은 공기 중의 질소 분자를 사용하지는 못한다. 그래서 일부 질소 고정 세균류가 합성하는 암모늄, 질산염, 아질산염 등을 흡수해 사용한다. 그 외에도 번개가 칠 때도 질산염이 합성되며 인간이 만드는 배기 가스에도 질소화합물이 섞여 있다.
우리 혀가 필수 영양소인 단백질을 음식 속에서 감지해내기 위해 아미노산을 인식하고 뇌는 우리가 단백질을 섭취하도록 유도하기 때문에, 이게 들어간 것은 대개 맛이 괜찮다. 아미노산계 조미료인 MSG가 대표적. 이래서 그런지 식품첨가물로 많이 들어간다.
구조[편집]
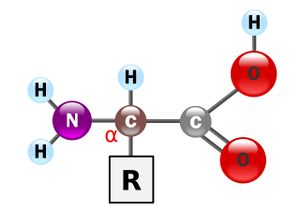
일반적인 α-아미노산의 구조는 오른쪽 그림과 같다.
아미노기와 카복실기를 모두 포함하고 있어, 아미노산은 중성에서 양쪽성 이온으로 존재하며, 카복실기가 공명 상태로 안정화를 취한다. 오른쪽의 구조에서 R은 나머지라는 뜻의 "Residue" 혹은 "Remainder"의 머릿글자로 곁사슬(Side chain)을 나타내고, 곁사슬에 무엇이 붙느냐에 따라 아미노산의 종류가 결정된다. 아미노산은 곁사슬의 성질에 따라 산성, 염기성, 친수성(극성), 소수성(무극성)의 네 가지 종류로 구분된다. 곁사슬이 수소 원자뿐인 글라이신(glycine)을 제외하고, 다른 아미노산은 모두 두가지 광학 활성을 가져, D형과 L형으로 구분된다. 단백질(protein)을 구성하는 아미노산의 거의 대부분은 L-아미노산 형태로 존재한다. 청자고둥(cone snail)같은 일부 특이한 바다생물에서 D-아미노산이 발견되기도 했다. 단백질은 아미노산의 탈수반응이자 펩타이드 결합(peptide bond)인 축합 중합을 통해 만들어진다.
아미노산의 물리적 성질[편집]
α-아미노산은 비휘발성 백색 결정성 화합물로 확정된 녹는점 대신 250-300 °C에서 분해된다. 이러한 성질은 아미노산의 안정한 쯔비터 이온 형성에 기인한다. 적외선이나 라만 분광학적 자료가 쯔비터 이온 형성을 증명한다. 아미노산은 등전점에서 수용액 용해도가 가장 낮기 때문에 등전점에서 아미노산을 정제하거나 재결정하는 것이 유리하다.
아미노산의 입체화학[편집]
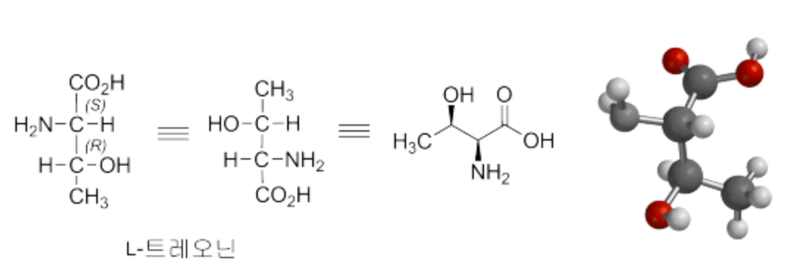
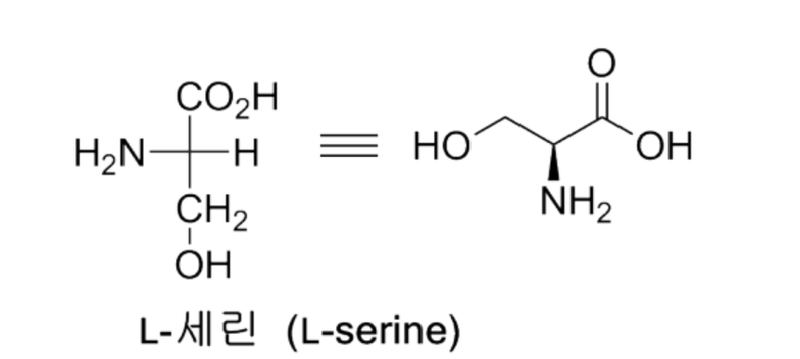
가장 간단한 아미노산 글리신 이외 천연의 알파-아미노산은 카이랄하다. 피셔 투영식에서 카복실산 알파(α)-위치의 아민이 왼편에 위치하면 L-입체화학을 가진다라고 한다. 예를 들면 L-트레오닌의 경우 아미노기의 위치의 입체화학은 입체표시자 L(소대문자)로 표시됨에 따라서 알수는 있지만 베타 위치의 하이드록시기의 입체화학에 대해서는 더 이상의 입체화학 표시가 없다. 정확한 표기는 R/S 입체 표기법(CIP 우선권 표시)이 필요하다. 탄수화물의 D/L 입체 구조의 기준을 글리세르알데하이드로부터 출발하는 것과 유사하게 아미노산 입체 구조는 L-세린으로 생각하여, 예전에는 D/L 입체 표시자를 Ds/Ls처럼 아래첨자 s(serine 의미)로 사용하였다.
아미노산의 산-염기성[편집]
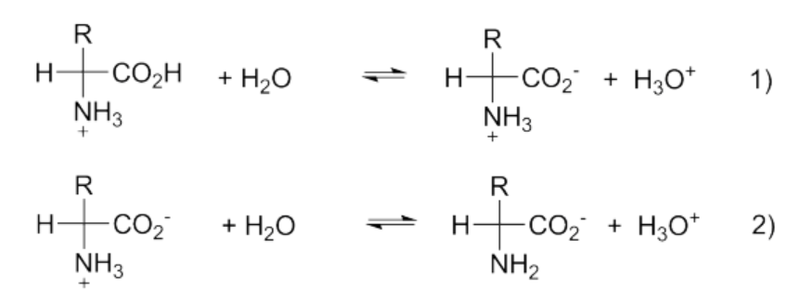
아미노산의 예로 알라닌을 들면 pH 7에서는 아민과 카복실기 모두 전하를 띠어 분자 내 양전하와 음전하가 동일한 개수인 쯔비터 이온(zwitter ion, 혹은 베테인,(betain))이 되어 전체 전하가 0이지만, 산도가 커지면 카복실기가 중화되어 아민만 양성자화된 암모늄 이온이 되면서 전체 전하가 +1이 된다. 그러나 염기성 수용액에서는 카복실기는 음이온이고 아민은 유리기로 존재하여 전체 전하가 -1이 된다. 단순 아미노산은 이양성자산이 된다. 이양성자산에 해당되는 pKa1과 pKa2의 평형 상수는 각각 1)과 2)식에 해당되는 평형상수이다.
전체 전하가 0인 경우 아미노산은 전기장에서 양극이나 음극 방향으로 이동하지 않는다. 이때의 pH 값을 등전점(isoelectric point, pI)이라 한다. pI=1/2(PKa1 + pKa2)가 된다.
아미노산의 구분[편집]
아미노기와 카복실기를 모두 포함하고 있어, 아미노산은 중성에서 쯔비터 이온(zwitter, 한 분자내에 양전하와 음전하를 모두 소유)으로 존재하며, 공명(resonance) 안정화를 취한다. 여기서 'R'은 곁사슬을 나타내고, 곁사슬에 따라 무슨 아미노산인지가 결정된다. 아미노산은 곁사슬의 성질에 따라 소수성(비극성), 친수성(극성), 염기성, 산성의 네 가지 종류로 구분된다.
소수성 아미노산[편집]
소수성 아미노산에는 글라이신(유일한 비카이랄성 아미노산), 알라닌, 발린, 류신, 아이소류신, 프롤린, 메티오닌(티오에테르 결합을 소유)이 있다. 그리고 방향족 아미노산 중에서는 페닐알라닌, 트립토판이 소수성 아미노산에 속한다. 이 9가지 소수성 아미노산들은 세포의 수용성 환경을 피하기 위해 단백질 내부에 서로 모이는 경향이 있다. 이렇게 소수성 그룹들이 모이는 경향을 소수성 효과라고 한다. 다양한 크기와 모양을 가지는 탄화수소들은 단백질 내부에 응집하여 빈 공간이 없는 구조를 형성한다.
친수성 아미노산[편집]
친수성 아미노산은 전체 분자는 중성이지만 전기음성도가 큰 산소 원자가 있는 –OH(hydroxyl)기를 갖는 세린, 트레오닌, 티로신, 그리고 –SH기를 갖는 시스테인, 카복실아마이드를 가지는 아스파라긴, 글루타민이 있다. 극성의 R기는 물과 수소결합을 하기 때문에 비극성 아미노산에 비해 용해도가 높다.
염기성 아미노산[편집]
염기성 아미노산인 라이신, 아르기닌, 히스티딘은 중성 pH에서 양전하를 갖는다. 히스티딘은 양전하를 갖는 이미다졸(imidazole)기를 가지고 있는데, pKa가 6에 가까워 중성 pH에서는 주위 환경에 따라 중성이나 양전하를 가질 수 있다. 그래서 히스티딘은 효소의 활성부위에 많이 존재한다.
산성 아미노산[편집]
산성 아미노산인 글루탐산과 아스파트산은 곁사슬에 카복실기를 갖고 있다.
필수 아미노산과 비필수 아미노산[편집]
아미노산 중에 필수 아미노산에는 류신, 라이신, 메티오닌, 발린, 아이소류신, 트레오닌, 트립토판, 페닐알라닌, 히스티딘이 있다. 필수 아미노산이란 생체 내에서 합성이 되지 않거나 합성하기가 어려워서 음식물로 섭취해야 하는 아미노산을 말한다. 또 체내에서 합성이 되더라도 필요량만큼 합성이 되지 않는 일부 아미노산도 포함된다. 성인의 필수 아미노산에는 아이소류신, 류신, 라이신, 메티오닌, 페닐알라닌, 트레오닌, 트립토판, 발린 등의 8가지 아미노산이 있고, 영유아에게는 히스티딘을 더한 9개의 아미노산이 해당된다. 이 경우 히스티딘은 준필수 아미노산에 해당하지만, 최근에는 성인의 경우에도 필수 아미노산으로 분류한다.
비필수 아미노산은 체내에서 대사적으로 합성이 가능한 아미노산을 말한다. 성인은 시스테인, 타이로신, 히스티딘, 알라닌, 아스파트산, 글루탐산, 글라이신, 프롤린, 세린이 속한다. 영유아의 경우에는 히스티딘이 필수 아미노산이기 때문에 비필수 아미노산에서는 제외된다. 시스테인은 메티오닌으로부터, 타이로신은 페닐알라닌으로부터 합성할 수 있기 때문에, 아미노산 조성으로부터 단백질의 영양가를 계산하는 경우에는 각각 함황아미노산, 방향족아미노산으로 필수 아미노산에 더해질 수 있다.
- 필수 아미노산들의 기능
필수 아미노산들의 기능을 간단히 살펴보면, 먼저 류신의 경우 모든 단백질구성의 필수재료로 성장호르몬과 뼈의 생성에 직접 관여하며 칼슘 흡수를 촉진하고 질소 평형 유지 작용으로 골다공증을 예방한다. 류신과 아르기닌을 함께 섭취할 경우 흡수 경쟁하여 면역력을 증강시키며, 고혈당으로 인한 백내장 증상을 완화시키기도 한다. 또 류신은 프롤린과 함께 지질단백질의 동맥혈전 형성을 억제하며, 항체, 효소, 호르몬의 생성에 관여, 콜라겐 형성에 관여, 근소실 억제 및 조직손상 회복 등의 기능을 한다.
아이소류신은 탄수화물, 지방, 단백질을 분해하여 에너지를 생성하고 헤모글로빈을 생성하며 혈당조절, 근육생성 및 보수(repair) 등을 담당한다.
발린은 정신적 활력 촉진을 담당하며, 페닐알라닌의 경우 뇌에 의해 이용되어 노르에피네프린의 생산, 공복 시 통증감소, 항우울제 작용, 기억력 개선 등의 기능을 한다. 트레오닌은 콜라겐, 엘라스틴, 에나멜 단백질의 구성요소이며 간에 지방이 축적되는 것을 막는다. 또 소화기능이 원활하도록 돕는다.
메티오닌은 간에서 레시틴 생산을 증가시키고 간의 지방을 감소시킨다. 또 암모니아 형성을 조절한다. 트립토판은 천연이완제로 정상적인 수면을 유도하고, 면역을 강화하며, 콜레스테롤 수준을 감소시킨다.
라이신은 칼슘 섭취를 보충하고 콜라겐 형성을 도우며, 항체, 호르몬, 효소 생산을 돕는다. 히스티딘은 지방분해를 촉진하고 류마티스성 관절염 치료에 도움을 준다. 또 위산의 위액을 증가시키고 소화를 돕는다.
목록[편집]
필수 아미노산 8종은 ★로 표기. 단백질 생성 아미노산 20종은 ○로 표기.
- 감마아미노부탄산
- 글루타민 (Gln, Q) ○
- 글루탐산 (Glu, E) ○
- 글라이신 (Gly, G) ○
- 라이신 (Lys, K) ★○ - 리신이라고도 한다.
- 류신 (Leu, L) ★○ - 로이친이라고도 한다.
- 메싸이오닌 (Met, M) ★○
- 발린 (Val, V) ★○
- 세린 (Ser, S) ○
- 셀레노메싸이오닌
- 셀레노시스테인 (Sec, U)
- 시스테인 (Cys, C) ○
- 시트룰린
- 아르지닌 (Arg, R) ☆○
- 아스파라진 (Asn, N) ○
- 아스파트산 (Asp, D) ○
- 알라닌 (Ala, A) ○
- 오르니틴
- 아이소류신 (Ile, I) ★○
- 타우린
- 테아닌
- 트레오닌 (Thr, T) ★○
- 트립토판 (Trp, W) ★○
- 타이로신 (Tyr, Y) ○
- 페닐알라닌 (Phe, F) ★○
- 프롤린 (Pro, P) ○
- 피롤라이신 (Pyr, O)
- 히스티딘 (His, H) ☆○
- 비천연 아미노산
인류의 필수 아미노산: 이소류신, 류신, 라이신, 메티오신, 페닐알라닌, 트레오닌, 트립토판, 발린, (아르지닌, 히스티딘)
참고자료[편집]
같이 보기[편집]

 위키원
위키원