알코올
알코올(alcohol)은 하이드록시기(-OH)가 포화 탄소 원자에 결합한 유기 화합물을 말한다. 가장 중요한 알코올 형태인 단순 사슬형 알코올의 구조식은 CnH₂ₙ₊₁OH 꼴이다. 그중 술의 주요 성분인 에탄올(C₂H₅OH)은 알코올을 대표하며, 일반적으로 알코올은 에탄올이 포함된 음료인 술을 지칭하기도 한다. 접미사 '~올'(-ol)은 IUPAC 명명법에서 하이드록시 기가 주 작용기일 경우에 붙인다. 다른 작용기가 더 주요 역할을 할 경우, '하이드록시~'(hydroxy-)라는 접두사를 붙이기도 한다. 접미사 '~올'은 파라세타몰(paracetamol) 혹은 콜레스테롤처럼 하이드록시기가 포함된 다른 화합물에도 쓰이며, 이들도 알코올의 일종이다. 하지만 당류(글루코스, 슈크로스 등)처럼 하이드록시기가 있음에도 접미사를 쓰지 않는 화합물도 많다.
알코올은 아랍어 알쿨(الكحل, al-kuḥl, "화장먹, 아이라이너 같은 가루")에서 왔다. 알(ال, al) 은 영어의 the 와 같은 아랍어의 관사이다. 라틴어 의학용어를 차용한 프랑스어를 거쳐 16세기 영어에 도입되었다.
목차
단순 알코올[편집]
가장 널리 사용되는 알코올은 에탄올(C₂H₅OH)로, 에테인에 하이드록시기가 결합된 형태이다. 에탄올은 발효 또는 증류된 술의 형태로 수천년간 사람들이 만들고 소비해왔다. 끓는점이 78.4 °C인 가연성의 투명한 액체로, 산업용 용매, 자동차 연료, 화학 산업의 원료 등으로 널리 쓰인다. 술에 관한 법과 세금 등의 이유로, 다른 용도로 쓰이는 공업용 에탄올에는 데나토늄벤조에이트처럼 불쾌한 맛을 내거나, 메탄올처럼 독성이 있는 물질을 넣기도 한다. 이런 에탄올을 변성 알코올이라고 한다.
가장 단순한 형태의 알코올은 메탄올(CH₃OH)이다. 예전에는 나무를 건류하여 얻었기에 목정(木精)이라고도 한다. 에탄올과 냄새와 성질이 비슷한 투명한 액체로, 끓는점(64.7 °C)은 약간 낮다. 용매, 연료, 원료 등으로 쓰인다. 에탄올과 달리 메탄올은 매우 독성이 강하여, 10 ml의 소량으로도 시신경이 파괴되어 실명할 수 있으며, 30 ml로도 사망할 수 있다.
분류[편집]
하이드록시기 수에 따른 분류[편집]
알코올은 탄소 원자에 결합하는 하이드록시기(-OH)의 숫자에 따라 1가 알코올, 2가 알코올, 3가 알코올 등으로 분류한다. 대표적인 1가 알코올로는 메탄올, 에탄올 등이 있다. 2가 알코올은 글라이콜(영어: glycol)이라는 총칭으로 불리기도 하며, 대표적인 2가 알코올로는 에틸렌 글라이콜, 프로필렌 글라이콜 등이 있다. 이밖에 알코올 분자에 붙는 하이드록시기의 수에 따라서 3가 알코올, 4가 알코올 등의 다가 알코올이 존재한다.
알킬기 수에 따른 분류[편집]
알코올은 하이드록시기와 결합하고 있는 탄소 원자에 결합하는 알킬기 CH(일반식 R)의 수에 따라 0차 알코올, 1차(primary) 알코올, 2차(secondary) 알코올, 3차(tertiary) 알코올로 분류하기도 한다. 탄소 원자는 총 4개의 공유 전자쌍을 형성할 수 있는데 이 중 1개는 하이드록시기와 결합하고 있기 때문에 알킬기의 수에 따라 분류하면 3차 알코올까지만 존재하고, 4차(quaternary) 알코올은 없다.
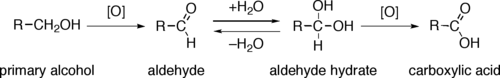
0차 알코올은 탄소 원자에 알킬기가 결합하지 않은 알코올이고, 오직 메탄올만이 0차 알코올에 속한다. 1차 알코올은 하이드록시기와 결합하고 있는 탄소 원자에 알킬기가 1개 결합한 알코올 분자이고,에탄올, 프로판올 등이 대표적인 1차 알코올이다. 이러한 1차 알코올은 총 두 번 산화될 수 있는데 한번 산화되면서 수소 원자를 2개 잃은 것을 알데하이드, 알데하이드가 다시 한번 산화되어 산소 원자와 결합한 것을 카복실산이라 한다.
2차 알코올은 하이드록시기와 결합하고 있는 탄소 원자에 알킬기가 2개 결합한 알코올 분자이며, 한번 산화되어 케톤을 생성한다. 3차 알코올은 하이드록시기와 결합한 탄소 원자에 알킬기가 3개 결합한 알코올 분자이고, 이들은 산화가 불가능하다.
용도[편집]
- 알코올성 음료: 주로 3~40 부피 % (v/v)를 함유한 알코올이 주류로서 선사 시대부터 사용됐다. 알코올을 자연 발효시킬 때 극미량의 2-methyl-2-butanol 및 γ-hydroxybutyric acid(GHB)를 포함하고 있는데 이는 약제로 사용되는 알코올과 비슷하게 향정신성(psychoactive) 효과를 보인다.
- 부동액: 알코올은 50%(v/v) 용액으로 에틸렌 글라이콜 수용액과 혼합하여 부동액으로 사용된다.
- 의료용: 에탄올은 주사를 투입하기 전에 피부의 소독에 사용된다. 에탄올을 함유하는 비누는 알코올의 휘발성 때문에 건조하지 않아도 되기 때문에 식당에서 널리 사용되고 있다. 알코올을 함유하는 젤 제품들은 손의 세정제로 널리 사용되고 있다.
- 알코올 연료: 에탄올과 메탄올은 연료로 사용될 수 있다. 터보 과급기(turbocharger)에 의해 압축된 알코올/공기는 훨씬 밀도가 증진되어 효과적인 연료로 사용된다.
- 용매: 에탄올은 독성이 낮으며 물질을 녹이는 성질이 뛰어나기 때문에 약품이나 향수 등의 용매로 쓰인다.
성질[편집]
알코올의 분자는 하이드록시기 때문에 극성을 띤다. 알코올의 하이드록시기는 물에 잘 녹게 해 주지만, 탄소 원자로 이루어진 사슬은 물 분자를 거부한다. 따라서 메탄올·에탄올·프로판올 같은 작은 분자는 하이드록시기가 우세해서 물에 잘 용해되지만 더 큰 분자는 탄소 사슬이 우세하기 때문에 녹는 양이 적거나 녹지 않는다.
알코올 분자들 사이에는 수소 결합이 형성될 수 있기 때문에 비슷한 분자량의 탄화수소에 비해 끓는점이 높다. 하이드록시기 때문에 알코올은 물과 마찬가지로 산으로도 염기로도 작용할 수 있는 양쪽성 물질이다. 알코올이 산화되면 알데하이드, 케톤, 카복실산 등이 된다. 카복실산과 반응하여 에스터를 만들기도 한다.
알코올(에탄올)은 g당 29KJ (약 7kcal)의 에너지를 발생시킨다.
반응[편집]
금속과의 반응[편집]
알코올은 나트륨과 같은 알칼리 금속이나 알칼리 토금속과 반응하여 수소 기체(H₂)를 발생시킨다. 이렇게 알코올과 금속이 반응하여 생성된 물질을 알콕사이드(alkoxide)라고 부른다. 이 반응은 탄소 수가 같을 때 알코올과 작용기 이성질체 관계인 에터를 구별할 때 사용된다.
2C₂H₅OH + 2Na → 2C₂H₅ONa + H₂
에스터화 반응[편집]
에스터는 과일 등 생물체에 흔히 존재하는 물질로 분자량이 작은 것은 휘발성이 꽤 크며 아름다운 향기를 가지고 있다. 에스터는 알코올과 카복실산으로부터 합성할 수 있는데, 이 반응을 에스터화 (에스테르화) 반응이라고 한다.
이와 같이 2개의 분자에서 물이 한 분자가 되면서 두 분자가 결합하는 반응을 축합 반응이라고 한다. 에스터화 반응은 역으로도 진행되는데, 에스테르에 물을 넣고 가열하면 카르복시산과 알코올이 생긴다. 이 반응은 가수 분해 반응이라고 한다.
알코올은 진한 황산이 촉매로 작용하면 카복시산과 반응하여 에스터를 형성한다. 이때 분자 간에 탈수 작용이 일어나 물이 생성되며, 공업적으로 에스터를 제조할 때는 수득률을 높이기 위해 황산을 더 첨가하거나 딘-스타크 증류 장치(Dean-Stark apparatus)를 이용하여 물을 제거한다. 일반적인 반응식은 아래와 같다.
R-OH + R'-COOH → R-COO-R' + H₂O
산화 반응[편집]
1차 알코올은 최대 두 번 산화될 수 있으며, 알데하이드(R-CHO)나 카복시산(R-COOH)이 생성된다. 또, 알데하이드가 카복시산으로 산화하기 전에 물과 반응하면 알데하이드 수화물(R-CH(OH)₂)을 생성하며, 과망가니즈산 칼륨과 같은 강한 산화제를 사용하면 알데하이드를 거치지 않고 바로 카복시산으로 분해되기도 한다. 2차 알코올은 한 번 산화되어 케톤(RR'C=O)을 생성하며, 3차 알코올은 거의 산화되지 않는다.
탈수 반응[편집]
알코올은 분자 내에서 제거 반응을 통해 알켄을 생성한다. 이 과정에서 물이 빠져나오는 탈수 반응이 진행된다. 일반적으로 이러한 반응에서는 자이체프 법칙에 따라 가장 안정한 알켄이 생성된다. 이러한 분자 내 탈수 반응은 1차 알코올의 경우 비교적 고온에서 일어나지만 알코올의 차수가 높아지면 실온 정도의 온도에서도 일어난다. 아래의 그림은 산 촉매 하에서 일어나는 에탄올의 분자 내 탈수 반응으로, 에텐이 생성된다.
더 높은 온도에서는 알코올 분자들끼리 탈수 반응을 일으켜 에터를 생성하기도 한다. 이때 황산이 촉매로 작용할 수 있으며, 주로 다이에틸 에터를 생성하는데 사용된다.
R-OH + R'-OH → R-O-R' + H₂O
참고자료[편집]
같이 보기[편집]

 위키원
위키원