단일결합
단일결합(single bond)은 화학결합을 나타내는 방법 중 하나로 하나의 공유결합을 말한다.
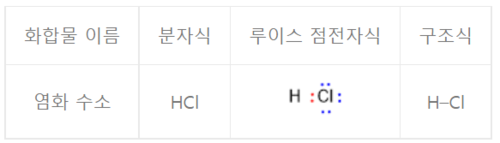
두 원자 사이에 1개의 전자쌍을 공유하는 공유결합으로, 단결합(單結合)이라고도 한다. 예를 들면 염화수소 · 메탄 · 에테인 등의 분자 사이의 결합이 이에 해당한다. 화학 결합을 나타내는 방법에서 단일결합은 원소 기호 사이에 하나의 선으로 표시한다.
원자 A와 원자 B의 결합에서 A의 원자가전자(原子價電子)와 B의 원자가전자의 궤도가 주로 A와 B의 원자핵을 연결한 선상에 겹쳐져 안정되어 있는 공유결합(共有結合)을 결합이라고 하는데 단일결합은 이 결합 하나만에 의한 결합이다.
단일결합에 대응하는 말로 2개의 전자쌍을 공유하는 이중결합, 3개의 전자쌍을 공유하는 삼중결합이 있으며 결합수가 증가할수록 결합 길이는 짧아져 결합 길이는 단일 결합>이중 결합>삼중 결합 순이고, 공유결합 에너지는 결합차수가 커질수록 커지므로 단일 결합<이중 결합<삼중 결합 순이 된다.
상세
단일결합은 서로 이웃한 두 원자 사이 '원자가 전자들(valence electrons)'의 공유를 통해 이루어지는 화학 결합인 공유 결합 중 하나로 두 원자가 공유하는 전자쌍이 1개인 결합을 가리킨다. 공유결합은 두 원자를 연결하는 결합의 수를 나타내는 결합 차수(bond order)를 통해 또한 분류할 수 있는데 단일결합은 곧 결합 차수가 1이다. 예를 들어 염화수소(hydrogen chloride, HCl) 분자는 수소 원자와 염소 원자가 각각 1개의 '원자가 전자'를 공유하며 공유 전자쌍이 1개인 단일 결합을 형성한다. 상온에서 고체 상태인 아이오딘 분자(I2)도 각각의 아이오딘 원자가 1개의 '원자가 전자'를 공유함으로써 두 아이오딘 사이 결합 차수가 1인 단일 결합 화합물이다.
화합물의 구조를 나타내는 루이스 점전자식에서 단일 결합에 대한 표시는 공유 전자를 점으로 나타내어 두 원자 사이에 콜론(:) 형태로 나타내는 방법이다. 아래 그림에서 빨간색으로 표시된 전자쌍이 염화수소 분자 내 공유 전자쌍이며 파란색으로 표시된 전자쌍은 염소 원자의 고립 전자쌍을 나타낸다. 화합물 구조에 대한 다른 표현 방법으로 공유 전자쌍 1개를 하나의 선으로 나타낼 수 있으며 두 원자의 원소 기호 사이에서 두 원소 기호를 연결해주는 방식으로 그리면 된다.
단일결합의 세기는 결합 해리 에너지(Bond Dissociation Energy, BDE) 값을 통해 정량적으로 이해할 수 있는데, 공유 결합을 공부할 때 처음 등장하는 가장 간단한 단일 결합 화합물인 수소 기체 분자(H2, H–H)의 결합 해리 에너지값 432 kJ/mol을 기준으로 잡고 다른 단일 결합의 세기를 추측해 보는 것이 좋다. 수소 원자와 단일 결합하는 파트너 원자로 수소보다 전기음성도가 큰 원소, 예를 들어 산소 또는 플루오린과 결합하는 경우 H–H와 비교하여 더 강한 결합 세기를 추측할 수 있으며, 실제로 H–O의 평균 결합 해리 에너지와 H–F의 결합 해리 에너지는 467 kJ/mol, 565 kJ/mol이다. 반면에, 2주기 동종 원소 간 단일 결합의 경우, 즉 N–N, O–O, F–F에서 결합의 세기는 앞의 예들과 달리 질소 원자 사이 단일 결합이 평균적으로 163 kJ/mol로서 가장 강하며 다음이 산소 원자 사이 단일 결합으로 평균 157 kJ/mol, 마지막으로 플루오린 사이 결합이 154 kJ/mol로 가장 약하다. 전기음성도를 통해 이해했던 H–H, H–O, H–F의 현상과는 반대의 결과를 보이는 N–N, O–O, F–F에서 결합의 세기는 2주기 원자가 화학 결합을 통해 가지는 비공유 전자쌍(또는 고립 전자쌍) 사이 반발로 이해할 수 있다. 3주기 이상 원자들의 경우 화학 결합을 통해 비공유 전자쌍을 가지고 있더라도 원자핵에서 멀리 떨어지려는 성질이 있어 결합한 원자들의 비공유 전자쌍 사이 반발이 크지 않지만, 2주기 원자들은 비공유 전자쌍들이 원자핵 가까이 있으려는 성질이 있고 그로 인해 결합한 원자들의 비공유 전자쌍 사이 반발이 크다. 비공유 전자쌍의 반발 정도는 질소 원자에서 플루오린 원자로 갈수록 강해지므로 N–N 결합이 가장 세고 F–F 결합이 가장 약하다.
원자가 결합 이론(valence bond theory)을 통한 단일 결합의 이해
공유결합은 두 원자 사이 공유된 전자들에 의해 이루어지며 전자는 고전 역학이 아닌 양자 역학을 통해 이해할 수 있으므로, 화학 결합을 근본적으로 이해하고자 한다면 우리는 양자 역학을 통해 화학 결합을 바라봐야 한다. 1927년 하이틀러(Walter Heitler, 1904~1981)와 런던(Fritz W. London, 1900~1954)에 의해 처음 제안되고 폴링(Linus Pauling, 1901~1994)에 의해 확장, 발전된 원자가 결합 이론은 화학 결합을 양자 역학을 통해 이해할 수 있는 하나의 이론이다.
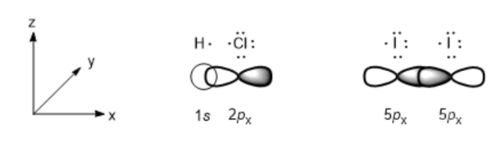
원자가 결합 이론에서 공유결합이란 결합에 참여하는 두 원자 사이 홀전자 오비탈의 겹침으로 설명할 수 있으며, 이러한 홀전자 오비탈 사이 겹침은 크게 두 가지 방식이 있다. 하나는 시그마(σ) 결합이며 다른 하나가 파이(π) 결합으로 각 결합에 대한 좀 더 자세한 내용은 앞서 말한 위키(원자가 결합 이론)에서 찾아볼 수 있다. 앞서 예로 설명된 염화 수소 분자의 경우 염소와 수소 원자가 3차원 좌표에서 x 축에 나란히 있다면, 두 원자 사이 결합은 염소 원자의 홀전자 2px 오비탈과 수소 원자의 홀전자 1s 오비탈 사이 겹침에 따른 시그마 결합이며, 아이오딘 분자 또한 각 원자의 5px – 5px 홀전자 오비탈 사이 겹침에 따른 시그마 결합이다. 이처럼 모든 단일 결합은 시그마 결합이다.
참고자료
- 〈단일결합〉, 《화학백과》
- 〈단일결합(single bond, 單一結合)〉, 《사이언스올》
같이 보기

 위키원
위키원