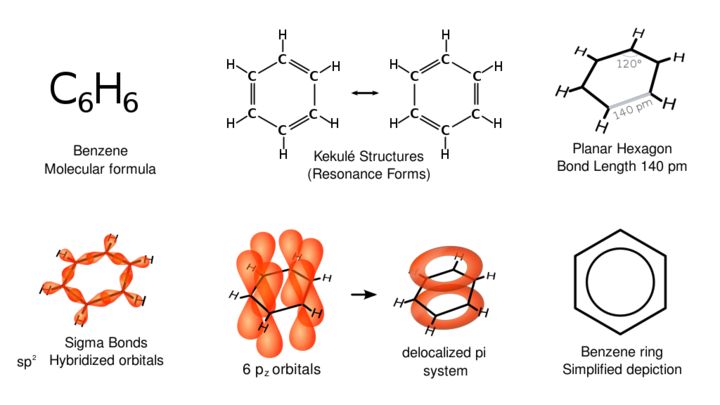벤젠
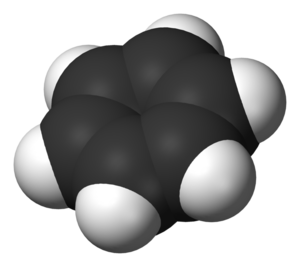
벤젠(benzene) 또는 벤졸(benzol)은 휘발성 액체 탄화수소로 콜타르를 증류, 정제하여 만든다. 6개의 탄소 원자가 동일 평면에 있는 평면 정육각형의 고리구조를 가졌으며 가장 기본적인 방향족 탄화수소 물질이고 대표적인 아눌렌(6-아눌렌)이다. 무색이고 가연성이 있으며, 발암 물질로도 알려져 있다. 비등점은 섭씨 80.1도이고 화학식은 C6H6이다. 가끔 페닐기에 수소가 붙어 있다는 의미로 Ph-H로 표기되기도 한다. 상대적으로 높은 끓는점을 가진 것으로 알려져 있으며 달콤한 냄새를 가진 것이 특징이다. 발암성 때문에 가솔린에의 첨가는 제한되었지만 화학 공정에서 중요한 용매로 사용되며, 약품, 플라스틱, 인조 고무, 염료, 향료, 폭약 등의 원료로 쓰인다. 벤젠은 원유의 성분이며, 석유에 존재하는 다른 물질들을 통해서 합성할 수도 있다.
벤젠을 구성하는 6개의 탄소 원자는 서로 공유결합을 이루며, 6개의 탄소 원자 끝에 각각 1개의 수소 원자가 공유결합을 이루고 있다. 탄소 원자 간의 결합은 단일결합도, 이중결합도 아닌 중간적 성질을 가지며, 탄소원자 사이의 결합길이는 0.139nm로 모두 같다. 공명 구조를 이루고 있어 화학적으로 매우 안정하다. 벤젠은 무극성 분자이다.
개요
벤젠(benzene)은 화학식 C₆H₆를 갖는 탄화수소로 무색이며 달콤한 냄새가 나는 가연성 액체이다. 벤젠은 여섯 개 탄소가 정육각형 평면을 이루며 각 탄소에는 하나의 수소가 결합한다. 여섯 개의 각 결합은 단일 결합과 이중 결합의 중간 정도의 동일한 결합이며 화학적으로 매우 안정한 방향족성을 갖고 있다. 벤젠은 휘발유의 옥탄가를 높이는 효과가 있어 한동안 첨가제로 사용되다가 발암성 때문에 첨가제로의 사용이 규제되고 있다. 오늘날 벤젠은 공업용 재료가 되는 다양한 벤젠 유도체의 합성에 필요한 출발 물질로 연간 수천만 톤이 석유로부터 생산되고 있다.
역사
발견
'Benzene'이라는 단어는 15세기부터 유럽의 약제사들과 향수 제조사들에게 동남아시아에서 생산된다고 알려졌던 향기나는 수지(樹脂) 'gum benzoin'에서 유래됐다. 'benzoin'이라는 말은 '자바 섬의 유향'이라는 뜻의 'luban jawi'가 전와된 것이다. benzoin으로부터 산성 물질이 승화를 통해 분리되었고, 이를 'flower of benzoin' 혹은 벤조산이라고 이름붙였다. 벤조산으로부터 분리된 탄화수소는 이리하여 '벤진(benzin)', '벤졸(benzol)' 혹은 '벤젠(benzene)'이라는 이름을 갖게 되었다.
1825에 패러데이(Michael Faraday)가 조명 가스 생산 과정 중에 얻어진 기름 잔류물로부터 벤젠을 분리하였고, 이때는 "bicarburate of hydrogen" 이라 이름 지었다. 1833에 그는 실험식을 C₆H₆로 결정하였다. 1833년 미쉘리치(Eilhard Mitscherlich)는 벤조산(benzoic acid)을 증류하는 과정에서 벤젠을 얻었는데 이를 벤진(benzin)이라 불렀다. 1845년에 영국 화학자인 맨스필드(Charles Mansfield)가 콜타르(coal tar)로부터 벤젠을 분리하는 방법을 개발함으로써 공업적 규모의 생산이 가능하게 되었다.
벤젠의 화학구조
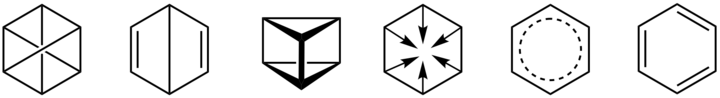
1825년에 이미 벤젠의 실험식이 C₆H₆로 알려졌으나, 탄소 하나에 수소 하나를 갖는 불포화도가 큰 구조를 결정하는 것은 19세기 내내 도전 과제였으며 클라우스(Claus, 1867), 듀와(Dewar, 1867), 라덴버그(Ladenburg, 1869), 암스트롱(Amstrong, 1887), 티엘(Thiele, 1889) 및 케큘레(Kekule, 1865)에 의하여 다양한 구조가 제안되었다.
그 중에서 오늘날 티엘과 케큘레가 제안한 구조를 사용하고 있다. 특히 케큘레는 단일 결합과 이중 결합을 교대로 포함하는 구조를 제안함으로써 C6H6의 실험식을 만족함과 동시에 다음과 같이 치환 반응 생성물의 이성질체 종류가 1 치환인 경우 오직 1가지, 2 치환인 경우 3가지로 일치한다는 것을 근거로 제시하였다.
케큘레에 의한 벤젠의 형태는 꿈에서 본 뱀이 꼬리를 물어 원을 형성하는 형상으로부터 떠올랐다는 일화가 있기도 한데, 벤젠의 형태에 대한 케큘레의 제안은 다른 방향족 화합물을 이해하는 데도 매우 중요하다. 벤젠의 고리 형태는 1929년에야 론스데일(Kathleen Lonsdale)에 의한 X선 결정 구조 분석으로 증명되었다.
공명 구조
벤젠(C6H6)에 있어 탄소원자간의 결합길이가 단일결합은 0.154 nm, 이중결합은 0.134nm이나, 벤젠은 모두 0.140 nm 로 측정되고 있어, 흔히 알고 있는 6각형의 단일결합과 이중결합의 구조가 제대로 설명하고 있지 못한다. 따라서 단일결합과 이중결합의 중간인 1.53결합, 즉 공명 구조를 이루고 있는 것으로 알려져있고, 공명 구조를 가지는 경우 그렇지 않은 분자들에 비해 에너지가 낮아 안정한 구조이다.
벤젠의 구조를 표현하는 유니코드도 존재한다. [6]-아눌린 으로써의 유니코드는 U+232C (⌬) 공명구조는 U+23E3 (⏣)이다.
제법
오늘날 대부분 벤젠은 석유로부터 얻어지며 소량만이 석탄으로부터 생산된다.
- 지방족 탄화수소의 촉매 개질(catalytic reforming)
석유에 함유된 지방족 탄화수소를 촉매 하에서 500-525 °C로 가열하면 수소를 잃고 다양한 방향족 화합물로 전환되는데, 이러한 촉매에 의한 개질(catalytic reforming)로 옥탄가 높은 휘발류가 얻어지며 부산물로 벤젠이 얻어진다.
- 톨루엔의 불균등화(disproportionation)
톨루엔을 촉매 존재 하에서 가열하면 자일렌(xylene)과 함께 벤젠이 얻어진다.
- 증기 열분해(steam cracking)
중질의 가솔린인 나프타(naphtha)로부터 에틸렌 화합물들을 얻기 위한 증기 열분해 공정에서 벤젠이 부산물로 얻어진다.
반응성
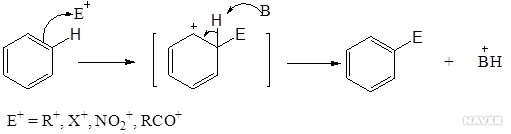
- 친전자성 방향족 친환 반응
루이스산 촉매 존재 하에서 다양한 친전자체(E⁺)를 벤젠 고리에 도입할 수 있다. 그 예로, 할로젠(X), 알킬(R), 니트로(NO₂), 케톤(RCO), 설폰산(SO₃H)등이 있다.
벤젠은 방향족성에 의한 안정화(150kJ/mol) 때문에 방향족이 아닌 알켄(alkene)에 비하여 매우 안정하다. 친전자성 방향족 치환 반응에서는 탄소 양이온 중간체를 거치며, 방향족성을 유지하기 위하여 첨가 반응대신 치환 반응이 일어나게 된다.
- 환원 반응
방향족이 아닌 알켄은 Pd/C를 촉매로 쉽게 환원되지만, 벤젠은 매우 안정하여 동일한 조건에서는 환원되지 않는다. 그러나 Rh/Al₂O₃촉매나 고압의 수소와 니켈(Ni)촉매를 사용하여 벤젠을 환원하면 사이클로헥세인을 얻을 수 있다. 또한, 액체 암모니아(NH₃) 용액에서 소듐(Na), 리튬(Li) 등의 알칼리 금속을 사용하여 벤젠을 환원하면 부분적으로 환원된 1,4-사이클로헥사다이엔을 얻을 수 있다.
용도
벤젠은 20세기 초까지는 좋은 냄새 때문에 면도 후에 사용하는 로션에 첨가하였고, 금속에 묻은 기름을 제거하는 용매, 커피에서 카페인을 제거하기 위한 용매 등으로 사용되기도 하였으나, 1950년경에 벤젠의 발암성이 알려진 후로는 벤젠 대신 톨루엔(toluene)을 용매로 사용한다. 한편, 다양한 벤젠 유도체를 합성하는데 필요한 출발 물질로 사용되고 있다. 원료 물질로 사용되는 벤젠의 50% 정도는 에틸벤젠의 원료로 사용하는데, 에틸벤젠은 폴리스타이렌의 원료인 스타이렌의 전구물질이기 때문이다. 20% 정도는 큐멘(cumene)의 원료로 사용되는데, 큐멘으로부터 페놀 및 아세톤이 얻어진다. 페놀과 아세톤으로부터 폴리카보네이트 및 에폭시 수지의 원료인 비스페놀 A를 합성할 수 있다.
위험성
벤젠은 암이나 다른 질병을 일으킬 가능성이 매우 높다. 재생불량성 빈혈, 급성 백혈병, 골수 이상 등의 치명적인 질병을 일으키는 것으로 알려져 있다. 신체 기관 중 골수 손상을 유발하는 것으로 유명하고, 그 밖의 다른 기관(간, 뇌, 콩팥, 심장, 폐)에도 타격을 준다. 벤젠은 암을 일으키는 것으로 공인된 물질이라, 세계보건기구(WHO) 산하 기관인 국제암연구소(IARC)에서 1군 발암물질(암의 발생과 명백한 상관관계가 있다고 확인된 물질)로 지정했다. 그래서 실험 때도 매우 위험한 괴수 취급한다. 조금 흘렸어도 쓱 닦아버리고 말 정도로 아직 안전의식이 미약한 국내 인식과 달리 엄격한 규칙을 준수하는 타국의 연구소에선 이건 숫제 괴수가 아니라 재앙 취급이다.
제2차 세계 대전 때 약물주사형에 이걸 사용한 기록도 있다. 나치 독일 군의관인 에두아르트 크렙슈바흐(Eduard Krebsbach)은 병든 죄수들에게 벤젠을 주사해서 900여명에 달하는 러시아인, 폴란드인, 체코인들을 죽였다. 이 때문에 악명이 자자했고 "주사 박사(Dr Spritzbach)"라는 별명이 붙을 정도였다. 당연히 종전 이후 전범으로 재판받고 교수형에 처해졌다.
비타민C와 안식향산 나트륨이 특정 조건에서 반응을 일으킬 경우 벤젠이 합성될 수 있다. 1990년대에 알려진 사실이었으나, 2006년 미국의 한 소비자단체가 대대적으로 홍보하면서 세계적으로 파동이 일었는데, 합성 첨가물 없이 순수하게 자연계에서만 얻을 수 있는 원료(크랜베리 주스 등)만으로도 벤젠이 검출될 만큼 반응을 일으킬 수 있고, 양이 먹는 물 기준으로 목표치에 가까울 만큼 워낙 소량이라, 세계적으로 두 원료를 의도적으로 같이 쓰지 않도록 권고 정도만 하는 정도이다. 현대인의 건강을 해칠 수 있는 벤젠의 주요 섭취경로는 (직접/간접) 흡연, 매연(실외에서의 호흡), 주유소 이용/근무, 벤젠을 용매로 사용하는 실험/분석 업무 정도로, 식품으로부터의 비의도적 경구 섭취는 심각하게 오염된 토양에서 자란 작물을 섭취하는 것이 아닌 이상 거의 영향을 주지 못한다 (참고) 게다가 간대사가 이루어지는 경구섭취와 호흡으로 노출되는 것은 위험도가 완전히 다르다. 굳이 소비자 레벨에서 신경쓰지 않아도 되는 정도로, 2006년에 한번 떡밥을 뿌려 크게 파동이 인 후 잊혀진 상태.
경기도 안산의 한 식품회사에서 향미유에 벤젠을 넣어 팔다가 적발된 사건이 있었다.
참고자료
같이 보기

 위키원
위키원