에탄올
에탄올(ethanol, 乙醇)은 탄소 원자, 수소 원자와 산소 원자로 이뤄진 술의 주성분이자, 광범위하게 사용되는 소독제 및 공업화학의 주요 용매이다. 코로나19 예방을 위해 널리 사용되고 있는 손 소독제의 주성분이 에탄올이다. 물 또는 에테르와 섞일 수 있다. 에탄올을 태울 경우 투명하고 옅은 푸른색을 띤 화염을 발생시키며, 물과 이산화탄소가 만들어진다. 증기는 폭발성이며, 이를 이용하여 일부 내연기관에서 연료로 사용되기도 한다.
목차
에탄올의 명명, 구조 및 성질
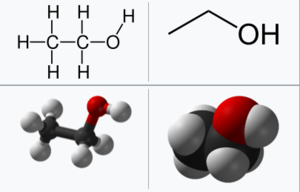
에탄올은 에틸 알코올(ethyl alcohol)이라고도 불리는 탄소 원자 두 개와 산소 원자 한 개, 수소 원자 여섯 개로 이뤄진 분자로 C₂H₅OH, C₂H₆O, CH₃CH₂OH의 화학식을 갖는 분자이다. 예로부터 술의 핵심 성분으로 이용되었기 때문에, 주정(酒精)이라는 명칭으로도 불린다.
탄소와 수산화기(하이드록실기, -OH)로 이뤄진 알코올 화합물은 이를 이루고 있는 탄소의 개수에 의해 이름이 결정되는데, 탄소 1개를 포함하는 알코올은 메탄올(methanol), 탄소 두 개로 이뤄진 알코올은 에탄올(ethanol), 탄소 3개로 이뤄진 알코올은 프로판올(propanol), 네 개로 이뤄진 알코올은 뷰탄올(butanol)이라고 불리는 방식이다(표 1).
탄소 3개 이상을 포함하고 있는 알코올부터는 탄소들이 결합하고 있는 방식에 따라서 구조 이성질체가 존재하지만, 메탄올과 에탄올은 알코올의 성질을 유지하는 구조 이성질체가 없이 오직 1 종류만 존재한다.
탄소 개수와 포화 탄화수소 및 알코올 명명 체계 탄소 1개 탄소 2개 탄소 3개 탄소 4개 탄소 5개 탄소 6개 탄화수소 이름 메테인 (methane) 에테인 (ethane) 프로페인 (propane) 뷰테인 (butane) 펜테인 (pentane) 헥세인 (hexane) 알코올 이름 메탄올 (methanol) 에탄올 (ethanol) 프로판올 (propanol) 뷰탄올 (butanol) 펜탄올 (pentanol) 헥산올 (hexanol)
에탄올의 분자 구조를 살펴보면, 탄소 두 개가 연결되어 있고, 하나의 탄소는 세 개의 수소와, 나머지 하나의 탄소는 2개의 수소 및 1개의 수산화기와 연결 되어있는 구조를 가지고 있다. 이 수산화기가 수소 결합의 원인이 되며 에탄올이 비슷한 분자량을 갖는 다른 탄화수소들에 비해 높은 녹는점과 끓는점을 갖게 한다.
에탄올은 특유의 냄새와 맛이 있고, 상온에서는 무색 투명한 액체로 존재한다. 녹는점은 -114.5 °C, 끓는점은 78.32 °C이다. 휘발성을 가지고 있어서 상온에서 쉽게 기화되며, 증기는 높은 폭발성을 가지고 있기 때문에, 연료로도 이용 가능하다. 연료로 사용되는 에탄올은 푸른 불꽃을 내며 연소한다. 에탄올의 밀도는 물보다 가벼운 0.789 g/mL이지만 물과 매우 잘 섞이기 때문에 층을 이루진 않는다. 에탄올은 물 외에도 다른 알코올, 에터 등의 용매들과 매우 잘 섞이는 성질을 가진다. 다양한 물질에 대한 높은 용해도와 우수한 휘발성, 그리고 상대적으로 낮은 독성 때문에 광범위한 부분에서 세정제로 많이 사용된다. 근래에 사용되고 있는 자동차 유리 워셔액의 주성분도 에탄올이다.
역사
인류가 에탄올을 처음으로 사용하기 시작한 것은 알코올이 포함된 음료, 주류의 역사와 함께 하기 때문에 정확한 그 기원을 알 수 없다. 다만 포도주 등의 과일을 발효하여 만든 과실주의 경우, 기원전 5000년경부터 메소포타미아 지방이나 이집트 등지에서 만들어졌다고 알려졌으며, 가축의 젖의 발효를 통한 주류도 다양한 문화권에서 생산되었다. 이후 채집과 수렵의 시기에서 농경 시대로 접어들면서, 곡식을 이용한 양조주가 발달하게 된다. 하지만 이런 술을 마실 경우 취하게 되고, 이 이유가 에탄올이라는 것이 밝혀진 것은 15세기 무렵이다.
순수한 에탄올의 분리는 1796년 독일-러시아의 화학자 요한 토비아스 로비츠(Johann Tobias Lowitz)에 의해서 보고되었다. 로비츠는 순수하지 않은 물-에탄올 불변 끓음 혼합물을 과량의 무수 알칼리 염들과 혼합한 다음 저열로 혼합물을 증류하여 순수한 에탄올을 얻었다.
프랑스의 화학자 라부아지에(Antoine Lavoisier)는 에탄올을 처음으로 탄소, 수소 및 산소 화합물로 묘사했으며, 1807년 소쉬르(Nicolas-Théodore de Sausure)가 에탄올의 화학 구조식을 결정했다. 이로부터 약 50년 후, 영국의 화학자 쿠퍼(Archibald Scott Couper)가 에탄올의 구조 공식을 CH₃CH₂OH로 발표했는데, 이것은 화합물의 구조식을 정확히 밝힌 최초의 일이었다.
에탄올은 1825년 영국의 화학자 패러데이(Michael Faraday)에 의해 화학적인 방법으로 합성되었다. 패러데이는 황산이 대량의 석탄 가스를 흡수할 수 있다는 사실에 기인하여, 현재의 공업적인 에탄올의 합성과 유사한 산 촉매를 이용한 에틸렌(ethylene)의 수화 반응(hydration)으로 합성하였다.
용도
음료로 이용
에탄올은 고대부터 이용된 알코올성 주류의 주요 성분으로, 마셨을 경우 대뇌의 역할을 억제하여 흥분 상태가 되고, 에탄올 자체가 중추 신경계에 작용하는 진정제 중에 하나이다. 에탄올이 포함된 알코올성 주류를 지나치게 자주 섭취할 경우, 습관성이 생기게 되고 중독되는 것으로 알려져 있다.
의학적 이용
에탄올은 병원에서 이용하는 거즈, 솜, 휴지, 물티슈 등의 소독과 피부에 사용하는 소독용 젤에 주로 사용된다. 에탄올은 단백질을 변성하고, 지질을 분해하여 유기물들을 죽이기 때문에, 질병 및 오염의 원인이 되는 대부분의 박테리아와 곰팡이 및 많은 바이러스에 효과적이다. 하지만 에탄올은 박테리아 포자 자체에는 직접적인 효과가 없다. 병원 및 생물학 실험실에서는 70% 에탄올 수용액을 가장 흔하게 사용하는데, 이는 물이 포함되지 않은 순수 에탄올은 미생물의 세포막을 완전히 투과하지 못하기 때문에 에탄올 수용액에 비해서 그 효율성이 감소하기 때문이다. 에탄올은 그외에도 의학적 용도로 독성이 큰 다른 알코올류(예를 들어 메탄올 및 에틸렌 글라이콜) 중독에 치료제로 이용될 수 있다. 또한, 에탄올의 우수한 용해도를 이용하여 물에 녹지 않는 약을 투여할 때 에탄올을 이용한다.
연료로 이용
자동차 내연기관에 에탄올이 직접 연료로 사용될 수 있으며, 시중에 판매 중인 휘발유에도 일정 범위의 에탄올이 포함되어 있다. 브라질의 경우에는 시중에 판매되는 휘발유에 약 25% 정도의 에탄올이 포함되어 있으며, 미국을 포함한 많은 국가에서 10% 정도의 에탄올이 포함된 휘발유를 사용 중이다. 최근 개발된 차량 중에는 에탄올만을 연료로 이용하는 경우도 있지만, 아직 주요 판매 대상은 아니다. 에탄올은 낮은 독성 때문에 메탄올을 사용하는 기존 연료 전지에도 대체제로 사용될 수 있다.
- 바이오 연료로서의 에탄올
알콜램프나 등산용 알콜버너 같은데 쓰이는 알콜은 주로 메탄올이지만 에탄올도 쓸 수 있고 초창기 로켓연료로도 쓰였다. 독일의 V-2 로켓의 연료가 25%의 물을 섞은 에타놀. 감자를 발효시켜 만들었다. 물을 섞는 이유는 엔진이 과열해 녹지 않도록 연소온도를 낮추기 위해. 공장 직원들이 빼돌려 마시기도 했다고. 초음속을 처음 돌파한 X-1 실험비행기에도 쓰이고 케로센등 탄화수소연료로 대체되기 전에는 로켓연료로 많이 쓰였다.
연료전지 중에도 에탄올을 수소이온 공급 연료로 하는 경우도 있고 잠수함의 AIP 발전기로 쓰이기도 한다.
바이오에탄올이라고 대체연료의 하나로 제안되고 있기도 한데, 보통 가솔린과 혼합하거나, 수화반응을 통해 수화에탄올 상태로 만들어 이용하고 있다. 바이오 에탄올은 밀·사탕수수·옥수수·감자 등 녹말 작물을 발효시켜 차량 등의 연료 첨가제로 사용하는 바이오 연료다. 작물의 식물성 기름을 추출해 만드는 바이오디젤과는 다른 종류다.
바이오에탄올 연료 사용은 글로벌 추세다. 전 세계 60여 개 국가에서 에탄올 연료 정책을 도입했다. 미국은 2005년과 2007년 두 차례에 걸쳐 재생 연료 의무화 정책을 내놨고, 유럽연합(EU)·캐나다·브라질 등도 동참했다. 물론 중동에 쏠린 연료 의존도를 낮추려는 의도가 있으나 그게 주는 아니었다. 핵심은 기후 변화를 더는 두고 볼 수 없다는 공감대였다. 탄소중립 구호가 강해진 2017년 이후에만 10개 이상의 나라가 새롭게 바이오에탄올 연료 정책을 만들거나 기존 제도를 확대했다. 원료는 조금씩 다르다. 미국은 옥수수, 브라질은 사탕수수, 동남아시아는 카사바를 주로 이용한다.
현재는 옥수수나 사탕수수가 주원료로 쓰이지만 앞으로는 산림에 흔히 존재하는 폐목재나 정부미, 오래된 쌀 등을 이용해서도 바이오에탄올 연료를 만들 수 있다. 기술적으로 어려운 게 아니다. 한국 정도의 기술력을 갖춘 국가에는 말이다. 환경만 조성되면 된다고 본다. 원료 수입을 아예 안 할 수는 없겠으나 국내에도 새로운 시장과 일자리를 만들 기회다. 그리고 바이오에탄올 생산은 이미 국내에서도 이뤄지고 있다. 그게 연료가 아닌 주류(酒類) 분야일 뿐이다.
전기차와 수소차로 대표되는 친환경 모빌리티가 언젠가는 모든 내연기관차를 대체할 것이다. 전기차는 상용화 단계에 진입했지만 배터리 화재와 같은 불안 요소가 남아있다. 이 문제가 확실히 해결될 때까지 내연기관차에 머물려는 수요가 있을 것이다. 그리고 전기라는 에너지원은 주로 화력발전소에서 만든다. 이 구조가 국가의 탄소중립 목표에 걸림돌이 돼 전기차 성장에 제약 요소로 작용할 수 있다. 수소차는 대중화까지 앞으로 최소 10년 이상의 시간이 필요하다고 한다. 친환경차 시대를 부정하려는 게 아니고, 곧장 그런 세상이 펼쳐지기엔 과도기가 꽤 길 수 있다는 말이다. 그렇다면 그사이의 시간을 우리는 그냥 방치할 것인가. 전기차 생산 숫자만 가지고 파리협약을 지킬 수 있을까. 힘들다. 바이오에탄올 연료는 내연기관차에서 친환경 모빌리티로 넘어가는 과정을 자연스레 연결해 한국의 탄소중립 연착륙을 도울 것이다. 미국 환경보호청(EPA)과 캘리포니아주 대기자원위원회(CARB) 등에 따르면, 바이오에탄올 연료는 100% 휘발유와 비교해 온실가스를 45%나 감축할 수 있다. 또 한국이 바이오에탄올을 기존 연료에 20% 혼합할 경우 온실가스를 7.7%(약 280만t) 줄일 수 있다는 시카고대 연구 결과도 있다.[1][2]
부동액으로 이용
에탄올은 매우 낮은 어는점(영하 114.5 °C)를 갖고 자체 독성 및 환경 오염이 적기 때문에 다양한 기기의 부동액으로 사용된다. 특히 실험실에서 이용하는 낮은 온도의 용매 회수 장치 등에 에탄올을 부동액으로 많이 사용한다.
화합물의 원료 및 용매
에탄올은 상대적으로 저렴한 가격으로 쉽게, 대량으로 얻을 수 있는 공업 용매이다. 산화 반응을 통해 아세트알데하이드(acetaldehyde) 또는 아세트산을 합성할 수 있으며, 산 촉매 반응을 통해 에틸기를 포함하는 에스터류(esters), 에틸기를 포함하는 에터류(ethers)로 전환될 수 있다. 또한, 석유화학의 중요 물질인 에틸렌(ethylene), 뷰타다이엔(butadiene) 등과 밀접한 연관이 있으며, 높은 용해도를 이용하여 다양한 유기 반응에서 용매 및 반응 처리제로 사용된다.
에탄올의 생산
에틸렌의 수화 반응
에틸렌을 사용한 에탄올 제조법은 크게 직접 수화법과 간접 수화법으로 나뉜다. 직접 수화법은 기체 상태에 있는 에틸렌에 물을 직접 첨가하는 반응으로 일반적으로 산 촉매를 이용한다. 이때 생성된 에탄올 두 분자가 탈수 반응을 일으켜 다이에틸 에터(diethyl ether)가 원치 않는 부산물로 발생할 수 있다.
간접 수화법에서는 에틸렌을 황산과 먼저 반응시켜 황산 에틸(ethyl sulfate)이나 황산 다이에틸(diethyl sulfate)을 만든다. 이후 황산 에틸 및 황산 다이에틸은 물과의 가수 분해를 통해 에탄올로 변환된다.
이산화 탄소 전환 반응
이산화 탄소도 에탄올 생산의 좋은 시작 물질이 될 수 있다. 이산화 탄소를 수소 기체와 반응시키면 에탄올과 아세트산 등으로 전환시킬 수 있는데, 이때 특별히 제작된 촉매가 필요하다. 또한, 이산화 탄소는 전기화학 반응을 통해서 에탄올 및 다른 유기화합물로 전환될 수 있는데, 이때도 크기 및 모양이 조절된 구리 촉매 등이 필요하다.
발효
발효를 통한 에탄올 제조는 가장 오래된 제조법이고, 지금까지도 알코올성 음료의 에탄올을 제작하는 데 사용되는 방법이다. 거의 모든 당이나 녹말과 같은 탄수화물을 함유한 농산물을 재료로 하고, 대형 농장에서 재배되는 사탕수수 및 옥수수 등이 주요 원료가 된다. 곡류에 이스트를 첨가하는 방법으로 발효를 대량으로, 손쉽게 일으킬 수 있고, 중금속이나 독성 물질을 함유할 가능성이 낮기 때문에 식용을 목적으로 하는 에탄올 생산에 주로 사용된다.
에탄올의 불변끓음 혼합물
에탄올의 하이드록실기(-OH)는 수소 결합이 가능하고, 주위 분자와 강한 분자간 상호작용을 하기 때문에, 다른 분자와 섞였을 때 불변끓음혼합물(azeotrope)을 생성하는 원인이 된다. 불변끓음혼합물이란, 혼합물은 원래 각 구성 요소의 끓는점을 모두 보여주어야 함에도 불구하고, 혼합물의 끓는점이 하나로 일정한 경우를 의미한다. 불변끓음혼합물이 생성되면 혼합물을 분별 증류를 통해 완전하게 분리해 낼 수 없다. 예를 들어, 물과 에탄올의 혼합물을 끓였을 때, 에탄올의 끓는점인 78 °C와 물의 끓는점인 100 °C에서 각각의 활발한 기화를 보여줘야 하는데, 물 4%와 에탄올 96%인 혼합물은 78.17 °C에서 일정한 끓는점을 갖는다.
불변끓음혼합물은 끓는점 차이를 이용한 혼합물의 분리에서 보이는 최대 순도와 밀접한 연관이 있다. 물과 에탄올은 매우 잘 섞이는 혼합물이기 때문에 밀도 차이 등으로 분리할 수 없고, 끓는점 차이를 이용해 분리하는 증류를 이용한다. 혼합물을 78~80 °C 정도로 가열하면 에탄올만 먼저 증기로 끓어 나오는 것을 이용하여 분리하는 방식이다. 하지만, 에탄올은 물과 불변 끓음 혼합물을 이루기 때문에, 증류를 계속해서 진행한다고 해도 에탄올 96%에 물 4%가 포함된 혼합물이 분리할 수 있는 최대 한계치이다. 다시 강조하면 에탄올 96%에 물이 4% 섞여 있는 경우 끓는점 차이를 보이지 않고 마치 한 종류의 용액처럼 동작하기 때문에 증류를 이용해서 분리할 수 없다.
의료용이나 연구용으로 사용되는 99% 이상의 순수한 에탄올은 에탄올과 물의 불변 끓음 혼합물을 증류 외의 물을 분해하거나 흡수하는 방식을 추가적으로 이용하여 제조할 수 있다.
에탄올과 메탄올의 독성 차이
에탄올은 우리 몸의 장기 중 간에서 탄소 두 개로 이뤄진 아세트알데하이드(acetaldehyde)로 산화되지만, 비슷한 알코올인 메탄올의 경우에는 탄소 하나로 이뤄진 알데하이드인 폼알데하이드(formaldehyde)로 산화된다. 에탄올을 마셨을 때 생성되는 아세트알데하이드가 흔히 말하는 숙취의 원인 중 하나인데, 이와 다르게 폼알데하이드는 직접적인 세포 독성이 높아 매우 위험하다. 이 독성 차이가 메탄올을 에탄올을 줄 알고 착각하여 섭취할 경우 구토 및 실명, 그리고 사망에 이르게 되는 주요 이유이다.
알코올성 주류로 판매되는 에탄올에는 주류에 대한 세금 주세(酒稅)가 부여되는데, 화합물의 생산 및 소독제에 사용되는 공업용 에탄올에는 세금이 부가되지 않으므로, 이를 음료용으로 전환할 수 있다. 이를 막기 위해서 세금이 부가되지 않는 공업용 에탄올에는 바로 음용할 수 없도록 메탄올 및 소량의 첨가제를 추가하여 변성 알코올(denaturated alcohol)로 유통되기 때문에, 절대 이를 직접 마시지 않도록 주의해야 한다.
각주
- ↑ 변국영 기자, 〈“바이오에탄올, 친환경 모빌리티 전환에 ‘핵심역할’ 할 수 있다”〉, 《에너지데일리》, 2021-05-28
- ↑ 전준범 기자, 〈“수소차 시대 곧장 안 온다. 바이오에탄올 연료 거쳐야”〉, 《조선비즈》, 2020-12-24
참고자료
- 〈에탄올〉, 《위키백과》
- 〈에탄올〉, 《화학백과》
- 〈에탄올〉, 《나무위키》
- 변국영 기자, 〈“바이오에탄올, 친환경 모빌리티 전환에 ‘핵심역할’ 할 수 있다”〉, 《에너지데일리》, 2021-05-28
- 전준범 기자, 〈“수소차 시대 곧장 안 온다. 바이오에탄올 연료 거쳐야”〉, 《조선비즈》, 2020-12-24
같이 보기

 위키원
위키원