염화칼슘
염화칼슘(Calcium Chloride)은 염소와 칼슘의 화합물로, 화학식은 CaCl₂이다. 수용성이며, 상온에서 흰색의 고체다. 평소에는 별로 볼 일 없는데, 눈만 왔다 하면 바로 등장하는 물질이다. 제설용으로 많이 쓰기 때문이며, 겨울철에 도로 동결 방지를 위해 길바닥에 뿌린 약간 누런 흰색의 불투명한 가루가 바로 염화칼슘이다.
특징
염화칼슘은 화학식 CaCl₂를 가지는 이온성 무기화합물이다. 상온에서 흰색의 결정성 고체로 존재하며 녹는점은 772℃, 끓는점은 1935℃이며 물에 매우 잘 녹는 특징이 있다. 조해성이 있어 공기 중 수분과 쉽게 반응하여 수화물을 형성한다. 무수물 상태에서 밀도는 215 gcm³이며 용해도는 745 g/100 mL 이다. 물 이외에 아세트산이나 메탄올, 에탄올에도 잘 녹는다.
염화칼슘(무수물)을 물에 녹일 때 많은 열이 발생하는데 이는 염화칼슘의 용해열heat of solution이 매우 커서 나타나는 현상으로, 대량의 염화칼슘을 용해시킬 때는 주의하여야 한다.
염화칼슘의 제법
염화칼슘은 탄산칼슘에 염산을 반응시켜 얻을 수 있다. 이 반응식은 아래와 같다.
CaCO₃ + 2HCl => CaCl₂ + H₂O + CO₂
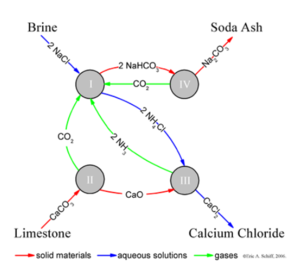
하지만 산업적으로는 석회석을 이용해 소다회(탄산나트륨)을 만드는 공정의 부산물로 얻어지는데, 이 공정은 Solvay 공정이라고 한다. 오른쪽의 그림을 보면 관련물질들의 순환 공정을 알 수 있는데 간단히 요약한 반응식은 아래와 같다.
2NaCl + CaCO₃ => Na₂CO₃ + CaCl₂
용도
물에 녹으면 물의 어는점을 크게 낮추기 때문에 제설용(염화 칼슘의 조해성)으로 사용된다. 염화칼슘이 섞이면 물의 어는점이 낮아지므로 웬만한 추위에도 얼지 않게 되어 쌓인 눈이 녹게 되는 것이다. 다만, 이미 얼어붙은 뒤보다는 얼기 전에 뿌려두는 것이 10배 더 효과적이기 때문에 눈오기 바로 직전에 뿌려두는 것이 일반적이다. 염화칼슘이 녹은 물은 무려 −52°C가 되어야 얼기 시작한다. 환경적으로 극도로 추운 지방인 오이먀콘 같은 곳만 아니면 저절로 녹게 된다는 뜻. 다만, 그렇다고 -52°C까지 그 제설 효과를 볼 수 있다는 것은 아니다. -15°C 이하는 그 효과가 떨어진다고 한다. 그렇기 때문에 강설이나 비가 오기 전에 예보가 있고 도로 노면온도가 영하로 내려갈 경우에 제설 예비 작업으로서 미리 1~2시간 전에 염화칼슘을 살포하는 것이 아예 매뉴얼 규정으로 잡혀있기도 한다.
염화칼슘이 녹는 반응은 발열 반응이어서 뿌려만 두면 습기를 흡수한 후 스스로 눈을 녹여가며 용해되는 장점이 있다. 동식물에게 무해한 편이나, 과량 섭취시 위장장애를 일으킬 수 있고, 과량 사용 시 식물에게는 염해를 일으킬 수 있다. 특히 낮은 온도에서 소금보다 훨씬 효능이 좋고 가격도 저렴해 이만한 제설제가 없다. 다만 소금과 마찬가지로 금속의 부식을 촉진시키기 때문에 금속으로 된 기계나 차량 따위에 닿으면 좋지 않다. 차량에 어느정도 방식처리가 되어있기는 하지만 연결부나 크고작은 흠집 부위 등 방식코팅이 벗겨진 곳으로 침투하면 소용없기 때문에 염화칼슘이 묻을 경우 가급적 빨리 세차를 해주는 것이 좋다. 또한 눈이 녹고 날이 풀려도 물이 더럽게 안마른다. 꽤 춥더라도 기온이 영상이라면 타이어 마찰열로 진작에 날아갔을 수분이 러브젤마냥 마르지도 않고 도로를 축축하게 유지시키는데다 일반적인 물보다 더 미끄럽다. 또, 앞차에서 튄 물방울이 앞유리에 묻고 마르면 염화칼슘 분진이 뿌옇게 들러붙어서 무조건 워셔액을 뿌려야 닦아낼 수 있다
제설 말고도 무수물의 강력한 흡습성 때문에 제습제로도 사용된다. 흔히 볼 수 있는 작은하마 "물먹는 하마"라는 제품에 들어있는 분말의 주 성분이 바로 이 물질이다. 집에서 제습제 만들어 쓰라고 인터넷에서 키트 형태로 염화 칼슘을 팔기도 한다.
해수어 / 산호 어항에 칼슘을 시비할 용도로도 사용된다. 이른바 3 파트 중의 한 성분으로서, 산호의 주 성분이 칼슘이기 때문에 칼슘의 공급은 절대적이다. 같은 용도, 즉 칼슘을 공급하기 위해 수영장 물에도 첨가된다. 물론 수영장 물에 들어갈 사람에게 칼슘 공급해주려는 건 당연히 아니고, 물에 칼슘이 포화되면 배관이 덜 부식되고 수영장 바닥과 벽이 부스러지는 것 또한 줄어 든단다.
콘크리트의 초기 경화를 빠르게 하기 위해 섞어 넣는 경우가 있다. 다만 금속인 철근의 부식을 가속화하기 때문에 철근 콘크리트에는 넣지 않는다.
식품 첨가제로도 쓰인다. 두부를 만들 때 간수로 쓰여 콩을 갈아 만든 콩물이 응고되도록 한다. 그리고 짠맛이 나므로 나트륨 함량을 줄이면서 짠맛을 내기 위해 소금 대신 사용되기도 한다. 몸에 나쁜 것 아니냐고 포카리스웨트 같은 이온 음료에 이미 염화칼슘 성분이 들어가고 있다. 과하지만 않으면 무해하다. 간혹 치즈에도 첨가된다. 분자요리의 기본 중 하나로서, 알긴산과 만나면 응고되는 성질도 있다. 이렇게 굳은 것을 캐비어라고도 부른다(애플 캐비어, 망고 캐비어 등). 물론 농축액이나 고체 형태로 다량 처묵처묵하면 해롭다.
의약품의 성분으로서 사용되기도 한다. 역시 기본적인 목적은 칼슘의 공급. 이 때는 경구 복용 시 위장 장애를 유발하므로 주사제로서 사용된다. 이외에 동물의 중성화수술의 대체요법에도 사용이 가능하다.
조금 더 전문적인 영역으로 들어가면, 세포에 플라스미드(Plasmid)와 같은 DNA 단편 등을 집어넣을 때 사용되기도 한다. 세포막을 통과시키는 용도로 염화 칼슘이 사용된 예. 이 때, 공기를 인위적으로 불어넣어 주어야 조금 더 물질이 세포막을 통과할 확률이 높다.
유의점
독극물은 아니지만, 함부로 다루면 몸에 해롭다. 습기를 빨아들이는 성질 때문에 피부에 닿으면 피부를 건조하게 만들며 자극의 원인이다. 따라서 인체 뿐만 아니라 누군가의 피부였을 가죽 제품도 염화 칼슘이 닿으면 쪼그라드니 조심해야 한다. 물에 녹으면서 열을 내놓기 때문에 눈이나 입에 들어가면 화상을 일으킬 수 있고, 진한 농축액이나 고체인 염화 칼슘을 삼키면 위에 궤양이 생길 수 있다.
그리고, 공업용 염화 칼슘이 묻은 물건이면 가급적 빨리 물이나 세정제로 깔끔하게 씻어내야 좋다.
마지막으로 제설용 염화 칼슘은 공업용으로, 절대 식용이나 의료용이 아니다. 따라서 이런 물건을 값이 싸다는 이유로 식용이나 의료용에 쓰면 범죄다.[3] 수족관이나 풀장 같은 곳에 칼슘 보충용으로 투입하지도 말자. 공업용(제설용)이라고 적어둔 물건은 땅바닥에 뿌려댈 때만 쓰라고 만든 것이다.
석회석이 들어간 시멘트도 염화칼슘과 지속적으로 접촉하면 부식된다. 덕분에 겨울마다 눈이 참 많이 오는 강원도 지역 도로는 내리는 눈에 비례하게 엄청난 염화 칼슘을 살포하기에 옆의 콘크리트 하수구나 사이드블록 같은 경우 겉으로 보기엔 멀쩡해도 만져 보면 퍼석퍼석한 때가 많다. 염수를 집중적으로 뿌리는 터널 내외의 것들이 특히 그런 편.
또 남용하면 토양을 알칼리화시켜서 가로수를 말려 죽이기도 한다.
대기 중 공해물질과 제설용 염화 칼슘이 과하게 사용되어 토양과 수질을 오염시키고 철근을 부식시킨다는 연구결과가 있다. 또한 철근 부식과 차량의 부식의 피해 사례가 있다고 한다.
염화 칼슘이 물의 녹으면서 열을 내기 때문에 겨울철 강아지 발에 화상을 줄 수 있으므로 눈 오는 날이나 다음 날에는 강아지에게 신발을 신어주는게 좋다.
참고자료
- 〈염화칼슘〉, 《나무위키》
- 직장인의 실험실, 〈염화칼슘(CaCl2) - 특성, 제법, 용도와 유해성에 대하여〉, 《티스토리》, 2020-01-11
같이 보기

 위키원
위키원