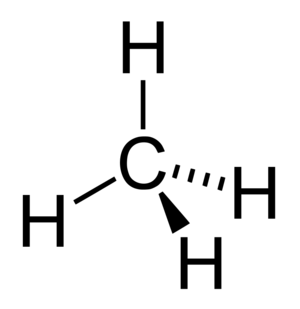
탄소화합물
탄소화합물(Carbon compounds, 炭素化合物)은 탄소 원자가 수소(H), 산소(O), 질소(N), 황(S), 할로젠(F, Cl, Br, I) 등의 원자와 결합을 하여 이룬 화합물의 총칭이다.
개요[편집]
탄소는 4개의 최외각 전자를 가지고 있으며, 결합 방식에 따라 구조가 다른 다양한 화합물을 형성한다. 탄소는 수소, 질소, 산소, 황 등의 비금속 원소와 안정된 공유결합 화합물을 이룬다. 탄소의 수가 증가할수록 사슬 모양, 가지 모양, 고리 모양 등 다양한 구조를 이루며, 단일결합, 이중결합, [[삼중결합[[ 등 다양한 형태의 화학결합을 형성한다.
주변에서 흔히 볼 수 있는 고무, 플라스틱, 섬유, 석유 등이 모두 탄소화합물로 이루어져 있고, 사람을 포함한 동식물을 구성하는 것도 주로 탄소화합물이다. 현재까지 알려진 탄소화합물은 수천만 가지에 이르고 지금도 발견되거나 합성되고 있다. 석탄, 석유와 같은 천연자원이 대표적인 탄소화합물이다.
탄소화합물의 종류가 매우 다양한 것은 골격이 되는 탄소가 다양한 결합을 만들 수 있기 때문이다. 이유는 탄소가 14족 원소이기 때문에 4개의 원자가 전자를 가지고 있으므로 최대 4개의 결합을 만들 수 있기 때문이다. 또한 2주기에 있기에 반지름이 상대적으로 작아서 같은 족 3주기 규소가 잘 만들지 못하는 2중 결합이나 3중 결합을 쉽게 만들 수 있고, 전기 음성도는 2.5로 모든 원소 중에서 중간 정도의 값을 갖기 때문에 많은 원소들과 공유 결합을 형성할 수 있다. 이러한 특징 때문에 탄소는 다양한 형태의 구조로 공유결합을 만들 수 있다.
탄소화합물 구분[편집]
탄소화합물은 탄소원자와 수소원자로만 이루어진 탄화수소, 유기화합물, 무기 탄소화합물로 구분할 수 있다.
탄화수소[편집]
탄화수소(Hydrocarbon)는 탄소화합물의 일종으로 탄소와 수소로만 이뤄진 유기화합물이다. 가장 간단한 탄화수소는 메테인(CH₄)이고, 대표적인 탄화수소는 석유와 천연가스 이다. 휘발유, 파라핀, 항공유, 윤활유 등도 모두 탄화수소 혼합물이다. 탄화수소는 탄소 원자의 개수가 많을수록 분자간의 인력이 증가해 끓는점이 높아진다.
탄화수소 종류는 크게 벤젠과 같이 공명고리가 있는 방향족 탄화수소(Aromatic hydrocarbons)와 그 외의 탄화수소인 지방족 탄화수소(Aliphatic hydrocarbon)로 분류되며 지방족 탄화소는 골격을 이루는 탄소의 결합형태에 따라서 파라핀(Paraffin)계, 나프텐(Naphthene)계, 올레핀(Oleffin)계 등으로 분류되고 있다.
- 파라핀계 탄화수소(지방족 포화 탄화수소): 탄소가 사슬 모양으로 연결된 것으로서 다른 결합수는 수소와 결합한 포화 결합으로 되어 있다.
- 나프텐계 탄화수소(지방족 고리 포화 탄화수소): 파라핀계와 마찬가지로 결합수가 모두 탄소와 수소로 채워져 있는 포화 결합의 탄화수소이며, 골격을 이루는 탄소 원자가 고리 모양으로 결합된 것이 큰 특징이다.
- 올레핀계 탄화수소(지방족 불포화 탄화수소): 파라핀계와 마찬가지로 탄소가 사슬 모양으로 결합되어 있으나, 그중에 탄소끼리의 이중 결합이 하나 들어 있는 것이 특징이다.
유기화합물[편집]
유기화합물(Organic compound)은 구조의 기본 골격으로 탄소 원자를 갖는 화합물을 통틀어 부르는 것이다.
예외로서 흑연과 다이아몬드 등의 탄소의 동소체, 일산화탄소, 이산화탄소 및 탄화칼슘 등의 금속 탄화염, 사이안화 수소와 금속시안산염, 금속싸이오시안산염은 탄소를 중심으로 한 분자종이나 무기 화합물로 분류한다. 1828년 프리드리히 뵐러가 인공적으로 요소를 합성하기 전까지, 유기화합물은 생체가 생산하는 화합 물질이라는 역사적 정의가 존재했기 때문이며 여기에 거론된 탄소 화합물은 당시부터 생체가 관여하지 않은 화합물로 발견되었기 때문에 무기화합물로 분류되었다.
유기화합물은 탄소 골격의 길이나 분기의 다양성에 제한이 없어 무기화합물 보다 복잡한 구조를 가질 수 있다. 또한 탄소에 질소, 산소, 황, 인 또는 할로젠 등이 결합하여 만들어지는 작용기도 다양하므로 각각 독특한 특성을 가져 무한한 다양성을 보여 준다. 그 다양성 때문에 유기화합물은 생물을 구성하는 요소로 없어서는 안 되는 존재이다. 또한 유기화합물을 유기물(有機物)로 부르는 경우도 있다. 대표적인 유기화합물로 단백질, 탄수화물, 지방, 핵산 등이 있다.
화학의 영역에서 유기화합물을 주로 다루는 화학을 유기화학이라 부른다.
유기화합물의 특징은 보통 탄소(C), 수소(H), 산소(O)로 이루어져 있고, 질소(N), 황(S), 인(P), 할로겐 등의 비금속원소를 포함하고 있다. 탄소끼리 결합해서 사슬모양, 고리모양의 화합물을 형성하며, 이성질체가 많아서 화합물의 수는 약 300만 개 이상이다. 분자 사이의 힘이 약해서 융점, 비등점이 낮고 보통 공유결합을 하고 있어서 대부분 비전해질이다.
대부분 쉽게 연소되어 가연성이고, 불완전연소 시 유독가스를 많이 발생시키는 특징이 있다. 산소가 없으면 열분해되어서 탄소가 떨어져 나가게된다. 그을음 같은 게 많이 발생한다고 생각하면 쉽다. 그리고 물에 잘 녹지 않고, 알코올, 벤젠, 아세톤, 에테르 같은 유기용매와 잘 섞인다. 또한 비전해질인 성질이 대부분이라 전기전도성이 거의 없다고 보면 된다.
무기 탄소화합물[편집]
무기 탄소화합물에는 탄소 산화물, 탄소 황화물, 금속과 탄소의 화합물인 탄화물, 할로겐화물, HCN 등이 있다.
- 탄소 산화물 및 관련 화합물: CO, CO₂, H₂CO₃
- 탄소 황화물 및 관련 화합물: C₃S₂, CS, CS₂, COS
- 탄화물: Na₂C₂, CaC₂, Cu₂C₂, Al₃C₄, SiC, Fe₃C
- 할로겐화물: CF₄, CCl₄, COCl₂, CBr₄, CI₄
참고자료[편집]
같이 보기[편집]

 위키원
위키원