"전지"의 두 판 사이의 차이
잔글 (→구조) |
잔글 |
||
| 46번째 줄: | 46번째 줄: | ||
===알칼리-망간 전지=== | ===알칼리-망간 전지=== | ||
| − | [[알칼리-망간 전지]]는 양극에 전해 | + | [[알칼리-망간 전지]]는 양극에 전해 이산화망가니즈 미분말과 콜로이드 흑염, 음극에 아말감화한 아연 입자, 전해질에 산화아연을 포화 용해시킨 농후 수산화칼륨 수용액을 사용한 [[1차전지]]이다. 알칼리-망간 전지는 기존 건전지의 성능을 대폭 개량한 제품으로, 방전 전압의 평단성, 저장성이 뛰어난 대용량 고성능 전지이다. 원통형 또는 버튼형으로 중부화 연속 방전용에 적합하다.<ref name="알칼망간화학용어">화학용어사전, 〈[https://terms.naver.com/entry.nhn?docId=607485&cid=50324&categoryId=50324 알칼리 망간(망가니즈) 전지]〉, 《네이버 지식백과》</ref> |
===납축전지=== | ===납축전지=== | ||
2021년 7월 6일 (화) 12:57 판
전지(電池, battery)란 전기장치에 전원을 공급하기 위해 화학적 에너지를 전기로 변환하여 저장하고, 직류 전력을 생산하는 기기이다. 한 번 사용하면 재사용할 수 없는 1차전지와 사용 후 충전하여 재사용할 수 있는 2차전지가 있다.
목차
개요
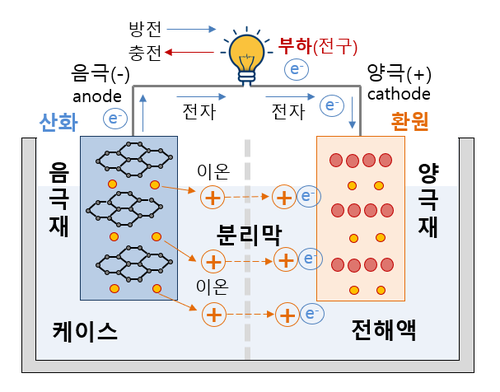
전지는 보통 건전지(dry cell) 혹은 배터리(battery)를 말하며 자발적인 산화-환원 반응을 이용하여 화학에너지를 전기에너지로 변화시키는 화학 장치이다. 음극(cathode)과 양극(anode)의 전극(electrode)이 있고, 각 집전체(集電體)와 반응 재료인 활물질(活物質; active material)로 구성되어 있다. 활물질을 전부 반응시켜 전지의 기전력이 0으로 떨어지면 재사용이 불가능한 1차전지(primary cell)와, 화학에너지를 전기에너지로 변환시키는 방전(discharging) 과정과 전기에너지를 화학에너지로 변화시키는 충전(charging) 과정을 반복할 수 있어서 재사용이 가능한 2차전지(secondary cell)가 있다.[1]
원자는 중성자와 양성자(+)로 이루어진 원자핵과 그 주위를 도는 전자(-)로 이루어져 있다. 전자는 이동이 가능하므로 전자의 움직임에 따라, 원자의 플러스 마이너스(+, -) 상태가 변화한다. 전자를 잃어서 양성자 전하를 띄면 양이온, 전자를 얻어서 전자 전하를 띄면 음이온이라고 부른다. 전해질은 이온이 들어 있는 액체이다. 이온은 전하를 띄기 때문에, 전류가 흐르면, 플러스 또는 마이너스 극으로 달라붙는다. 염화나트륨(NaCl, 소금)을 예로 들어 보면, 소금을 물에 녹이면, 음이온인 'Cl-'와 양이온인 'Na+'로 분리된다. 이 상태가 전해질 상태이다. 이러한 전해질에 전류를 흘려주면 양이온은 음극에, 음이온은 양극에 달라붙는다.[2] 이러한 성질을 이용하여 전지를 만들 수 있다.
역사
흔히 사용되는 1차전지의 기원은 1800년 이탈리아의 알레산드로 볼타(Alessandro Volta)가 개발한 볼타전지이다. 볼타는 서로 다른 금속이 액체를 사이에 두고 반대의 전하를 가질 때 기전력이 발생한다는 사실을 발견했다. 이후 이를 바탕으로 분젠전지, 포겐도르프전지 등 많은 전지가 고안되었고, 많은 개량을 통하여 현재 널리 사용되는 망가니즈 건전지로 발전했다. 화학반응을 이용한 전지를 화학전지, 물리반응을 이용한 전지를 물리전지라고 하는데, 일반적으로 화학전지가 더 널리 사용된다. 화학전지는 1차전지와 2차전지로 나눌 수 있다. 1차전지는 작용물질을 전극 가까이에 미리 넣어 두고, 이 물질의 화학변화에 의해 생기는 전기에너지를 이용한다. 작용물질의 화학변화가 끝나면 수명이 다하여 재생할 수 없다. 1차전지 중 널리 사용되는 사례로 건전지가 있다. 2차전지는 전기에너지를 방출하여 작용물질이 변화한 후에도 다시 전지에 전기에너지를 공급하여 충전하면 작용물질이 재생되어 이를 되풀이할 수 있다. 2차전지는 축전지로 많이 사용된다. 물리전지에는 태양전지, 열전지 등이 있다. 태양전지는 태양빛을 직접 전기에너지로 바꾸는 반도체 접합으로 이루어져 있다. 현대사회에서 전지는 각 특성에 따라 여러 분야에서 다양한 용도로 사용되고 있으며, 첨단기술 발전에 따라 장시간 사용 시의 안정성, 고에너지 밀도, 고출력 밀도, 긴 수명 등의 특징이 요구되고 있다. 또한, 전자기기 자체의 소형화에 따라 전지의 크기도 점차 소형화되고 있다.[3]
구조
전극
전극에서 진행되는 산화 및 환원 반응의 종류에 따라 전극을 애노드와 캐소드로 구분할 수 있다. 전자를 방출하거나 산화(oxidation) 반응이 일어나는 전극을 애노드(anode)라고 하고, 전자가 들어오거나 환원(reduction) 반응이 일어나는 전극을 캐소드(cathode)라고 한다. 예를 들어, 1차전지의 경우 언제나 음극에서 전자를 방출하는 산화반응이 일어나고 양극으로 전자가 들어가는 환원반응이 일어나므로, 음극이 애노드, 양극이 캐소드가 된다. 충전지와 같은 2차전지의 경우에 전지를 사용하는 방전 과정이 일어날 때는 1차전지와 마찬가지로 음극이 애노드, 양극이 캐소드가 된다.[4]
- 음극 : 전류가 나오는 전극을 의미하며, 전류가 전자의 흐름과 반대 방향으로 정의되므로 전자가 기구를 향해 들어오는 전극을 가리킨다. 이 정의에 의해 전지가 동작 중일 때에는 전류가 나오는 양극(positive electrode)이 음극(cathode)인 상황이 만들어진다.[5]
- 양극 : 양극은 전기 기기에서 전류가 흘러 들어가는 전극을 뜻한다. 전하 운반자가 전자인 경우, 전자의 전하가 음이므로 전자가 기기로부터 흘러나오는 전극이 양극이 된다. 이때 전자는 흘러 나오지만 전류의 방향에 대한 관례상 전류가 기기로 흘러 들어간다고 말한다.[6]
화학전지
화학전지는 자발적인 산화-환원 반응을 이용하여 화학에너지를 전기에너지로 변화시키는 전지이다. 화학전지의 종류에는 한번 사용한 후에 폐기처분 하는 1차전지와 여러 번 반복해서 사용이 가능한 2차전지가 있다. 2차전지는 충전을 하면 다시 사용할 수 있다. 그러므로 충전은 자발적인 산화 및 환원 반응이 진행되어 전지 내부에 축적된 생성물을 본래의 반응물 상태로 되돌리는 작업이다. 마치 산 위에 있던 돌이 자발적으로 굴러내려간(자발적인 산화·환원 반응) 다음에 그 돌을 산 위로 끌어올리려면, 에너지를 들여야 하는 것과 마찬가지이다. 충전기를 통해서 역반응에 필요한 전기에너지를 넣어주면, 전지는 다시 한번 자발적인 산화·환원 반응이 진행되기에 충분한 조건을 갖추는 셈이다. 그러나 1차전지를 재사용하기 위해서 충전기를 사용하여 역반응을 진행시켰을 때 가스와 부산물이 발생하게 되어, 내부 압력이 증가하여 전지가 폭발할 가능성이 있어 위험한 일이 발생할 수 있다.[7]
아연-탄소 건전지
가장 흔한 1차전지는 손전등, 휴대용 음원 재생기 등에 쓰이는 아연-탄소 건전지이다. 르클랑셰 전지(Leclanché cell)라고도 한다. 아연-탄소 건전지는 산화 전극(anode: - 전극)인 아연과 환원 전극(cathode: + 전극)인 흑연(graphite) 막대로 구성되어 있다. 흑연 막대(흑연은 탄소로 구성되어 탄소 막대라고도 부른다)는 흑연과 이산화 망가니즈(MnO2)의 촘촘한 층으로 둘러싸여 있다. 아연 산화 전극에서는 금속 아연(Zn)이 아연이온(Zn2+)으로 산화된다. 반면, 흑연 환원 전극에서는 흑연 막대와 접하고 있는 MnO2가 흑연 입자를 통해 흑연 막대까지 전달된 음극을 받아 Mn2O3로 환원된다. 아연-탄소 건전지는 실제로 전지를 구성하는 모든 성분이 건조한 상태로 되어 있지는 않다. 실제로 이 전지에 쓰이는 전해질은 염화암모늄(NH4Cl)과 염화아연(ZnCl2)으로 만든 습한 가루이다. 습기를 포함한 염 혼합물은 갈바니 전지의 염다리와 같은 역할을 한다. 아연-탄소 건전지의 전극 반응은 다음과 같다.
산화 전극 : → 환원 전극 : → 전체 반응 : →
아연-탄소 건전지는 초기 사용 시에는 1.5V의 전압을 발생시킨다. 일상적으로 사용하는 1.5V의 배터리가 이것이다.그러나 시간이 지남에 따라 건전지 내 반응물들의 농도가 변하여 전지의 전압이 떨어지는 단점을 가지고 있다. 전해액이 넘쳐 흐르지 않도록 금속 재질의 막대 모양으로 만든다. 내부저항이 커서 오랜 시간 연속으로 사용하기에는 적합하지 않다. 이전에는 자석식 전화기에 많이 사용하였고 다양한 소형 전기제품에 사용하고 있다.[8]
알칼리전지
알칼리전지(alkaline cell)는 아연-탄소 건전지에서 사용하는 전해질인 염화암모늄(NH4Cl) 대신 염기성인 수산화포타슘(KOH)를 사용한다. 알칼리전지의 전극 반응에는 용해된 화학종이가 없어 시간에 따른 농도 변화가 크지 않아 전압이 오랫동안 일정하게 유지되는 장점이 있다. 알칼리 전지의 전극 반응은 다음과 같다.[8]
산화 전극 : → 환원 전극 : → 전체 반응 : →
수은전지
수은전지(mercuric cell)는 아연-산화수은 전지(zinc-mercuric oxide cell)를 간단히 부르는 말이다. 보통 작은 단추 모양으로 제작하여 시계, 계산기, 보청기 등에 주로 사용된다. 수은전지는 수은과 아연의 혼합물로 된 산화 전극과 산화 수은(II) (HgO)과 접촉되어 있는 강철 환원전극으로 구성되어 있다. 전해질은 45% 수산화포타슘(KOH) 용액으로 포화시킨 흡착제를 사용한다. 수은 전지는 1.34V의 매우 안정된 전압을 제공한다. 수은전지의 전극 반응은 다음과 같다.[8]
산화 전극 : → 환원 전극 : → 전체 반응 : →
알칼리-망간 전지
알칼리-망간 전지는 양극에 전해 이산화망가니즈 미분말과 콜로이드 흑염, 음극에 아말감화한 아연 입자, 전해질에 산화아연을 포화 용해시킨 농후 수산화칼륨 수용액을 사용한 1차전지이다. 알칼리-망간 전지는 기존 건전지의 성능을 대폭 개량한 제품으로, 방전 전압의 평단성, 저장성이 뛰어난 대용량 고성능 전지이다. 원통형 또는 버튼형으로 중부화 연속 방전용에 적합하다.[9]
납축전지
납축전지는 납과 황산을 전극과 전해질로 사용하는 전지로서, 충전과 방전을 통해 반복해 사용할 수 있는 2차전지이다. 납축전지는 1859년 프랑스의 플랑테(Planté)가 개발한 가장 오래된 형태의 2차전지로 현재 자동차에 널리 활용되고 있다. 납축전지는 이산화납 전극과 납 전극이 황산 전해질에 담겨 있는 구조를 하고 있다. 하나의 단위 전지에서 2V의 전압이 생성되는데, 일반적으로 6개의 단위 전지를 직렬로 연결해 전체 납축전지를 구성하므로 전체적으로 12V의 출력 전압을 얻을 수 있다. 구형 납축전지는 밀폐 상태가 완벽하지 않아 사용 시간이 지남에 따라 황산을 보충해 주어야 했지만, 현재 시판되는 납축전지는 내부가 완전히 밀폐되어 황산 보충의 필요성이 없고 누출될 위험도 거의 없다.
납축전지는 다른 2차전지에 비교해 경제적이지만 전지의 용량에 비교해 무거운 것이 단점이다. 납을 사용하기 때문에 환경 오염의 문제가 있다는 단점도 있다. 황산의 누출 위험성만 없다면 다른 2차전지들보다 안정적이다. 황산은 수십 년 동안 전 세계적으로 산업적으로 생산되고 사용되는 화학물질 중 생산량 1위를 차지하고 있는데, 축전지에 사용되는 양도 상당하다. 납축전지는 자동차의 시동 및 조명 등 전자기기의 전원으로 널리 사용되고 있다. 골프용 카트, 지게차 등 전지의 무게가 중요하지 않은 용도로도 활용되고 있다. 산업용으로는 에너지저장장치(ESS), 전자기기 및 통신설비의 예비 전원 등으로 활용되고 있다. 전지의 무게가 문제가 되는 용도에서는 최근 리튬이온 전지로 대체되는 추세에 있다.[10]
니켈-카드뮴 배터리
니켈-카드뮴 배터리(Nickel-Cadmium Battery)는 니켈(nickel)과 카드뮴(Cadmium)을 이용한 충전이 가능한 2차전지이다. 'Ni-Cd 전지'라고도 한다. 전해액은 20~25% 수산화칼륨 수용액에 소량의 수산화리튬을 첨가한 것이 많이 사용된다. 음극과 양극의 두 극판은 서로 엇갈리게 짜서, 니켈을 도금한 강판제 또는 스티롤 등의 합성수지로 된 전해조에 넣고, 두 극판은 염화비닐 등의 다공판인 세퍼레이터(separator)로 격리한다. 기전력은 1.33V에서 1.35V이며, 보통 20~45℃에서 사용이 가능하다. 충전할 때는 전해액이 감소하므로 물을 보충한다. 전기적으로나 기계적으로 튼튼하여 수명이 길고 안정하며 보전이 수월한 독립 전원으로 그 용도가 넓다. 튜브식은 수명이 가장 길고 완방전용에 적합하며, 포켓식은 두꺼운 형과 얇은 형이 있는데, 완방전용과 급방전용의 양쪽에 사용된다. 용도는 갱내 안전, 열차점등용, 통신전원, 전기자동차 동력, 디젤기관의 시동, 기타 고율방전용 등이다. 근래에는 종래의 것과는 구조가 다른 고성능의 소결식 니켈-카드뮴 배터리가 실용되고 있다. 음극과 양극의 두 극판 모두 니켈 분말을 소결해서 얻은 다공성 금속판에 극물질을 스며들게 한 구조이며, 내부저항도 적다. 이 밖에 완전밀폐형도 있으며, 플래시램프·사진 플래시, 전기시계, 전자기기, 라디오, 태양전지 조합전원, 로켓, 미사일 등에 사용된다.[11]
니켈-카드뮴 배터리는 전기면도기, 코드 없는 진공청소기, 가정용 무선전화기 등의 가정용품에도 이용된다. 니켈-카드뮴 배터리는 충방전 방식에서 어떤 한 유형을 선호하여 충방전 유형을 기억하므로, 전류를 충분히 소모시킨 후에 완전 재충전해야 한다. 니켈-카드뮴 배터리를 잘 길들이기 위해서는 처음 이용하기 전에 24시간 동안 충분히 충전해야 하며, 그 후 충전량이 거의 소모될 때까지 전지를 이용한 후 최소 충전 시간인 12~16시간 동안 재충전해야 한다. 충전이 필요한 경우에만 전지를 충전해야 하며, 그렇지 않은 경우에는 충전기 안에 두지 않아야 전지 수명과 연관이 있는 기억 기능을 향상시킬 수 있다. 휴대용 이동전화로, 전화 작동 시간이 짧아지는 이유는 충전과 방전 사이클을 제대로 지키지 않은 경우가 많기 때문이다. 이 때는 전지를 적당히 방전한 후에 다시 전지를 완전히 충전하는 과정을 반복하여 기억 기능을 회복시킬 수 있다. 전기를 생성하는 화학반응은 다음과 같다.[12]
산화 전극 : → 환원 전극 : → 전체 반응 : →
니켈-카드뮴 전지는 1.4V의 매우 안정된 전압을 제공한다. 이 전지가 방전된 후 외부의 전원을 공급하여 충전하면 위의 반응과 반대 방향인 역반응이 일어난다.[8]
납산배터리
2차전지에서 매우 중요한 전지 중의 하나가 자동차에서 사용하는 납산배터리(lead-acid battery) 혹은 납-산 축전지(lead-acid storage battery)이다. 납산배터리는 산화전극으로 다공성 금속인 납(Pb)을 사용하는데, 이는 전해질과 최대한 많이 접촉할 수 있게 하기 위함이다. 환원전극으로는 이산화납(PbO2)이 코팅된 금속 납을 사용하며, 전해질로는 황산 용액(37 w%)을 사용한다. 전기를 생성하는 화학 반응, 즉 방전 과정은 다음과 같다.
산화 전극 : → 환원 전극 : → 전체 반응 : →
12V 납산배터리는 여섯 개의 2.0V 전지를 직렬로 연결한 것이다. 자동차에서는 납산배터리가 완전히 방전된 후 충전하여 사용하는 것이 아니라 자동차의 일부 운동에너지로 발전기를 구동하여 지속해서 충전을 한다. 충전 시 반응은 위의 반응과 반대 방향으로 일어난다.[8]
산화은전지
산화은전지에는 1차전지와 2차전지가 있으며, 단추형의 1차전지가 많이 사용된다. 산화은전지는 1961년 미국에서 개발되었다. 1차전지는 에너지 밀도가 높아 1963년경부터 시판되고 있다. 양극에 은 화합물이 사용되기 때문에 값이 비싸 소형에 국한된다. 2차전지는 용량이 큰 것이 개발되어 주로 군용으로 쓰인다. 단추형의 2차전지도 개발되고 있다. 양극의 산화은에는 산화은(Ⅰ) 또는 산화은(Ⅱ)가 사용된다.
산화은전지의 기전력은 산화은(Ⅱ)를 사용할 때가 약 1.8V이고, 산화은(Ⅰ)을 사용할 때가 약 1.57V이다. 그러나 실용 단추형 1차전지는 특별히 고안한 산화은(Ⅱ)을 사용하여 산화은(Ⅰ)과 공존시켜, 작동전압이 거의 1.5V가 되는 고용량화(高容量化)가 시도되고 있다. 미약한 전류로 장시간 사용이 가능한 것은, 전해질을 수산화나트륨으로 한 것으로 전자손목시계 등에 많이 이용된다. 전해질을 수산화칼륨으로 한 것은 카메라의 전자셔터용으로 적합하다. 그 밖에 전자식 탁상계산기 ·보청기 ·라이터 등에도 사용된다. 단추형 2차전지는 태양전지와 조합하여 전자손목시계와 전자식 탁상계산기 등에 사용한다. 산화은전지는 그 모양이나 치수가 수은전지와 공통점이 많으므로 혼동하기 쉽다.[13]
볼타전지
알레산드로 볼타(Alessandro Volta)는 수차례의 실험을 통해 두 종류의 서로 다른 금속과 습기만 있으면 전기가 발생된다는 것을 발견했고, 인류 최초로 전류를 지속적으로 발생시킬 수 있는 볼타전지를 발명했다. 볼타전지는 구리 원반과 산 용액에 적신 헝겊, 아연 원반을 교대로 쌓아서 만들어진 것이다. 여러 가지 단점들 때문에 잘 사용되지는 않지만, 당시에 물을 전기 분해하는 데에 쓰이는 등 화학의 발전에 지대한 공을 세운 작품이기도 하다. 볼타전지가 작동하는 원리는 금속들이 전자를 내놓으려는 정도가 다른 것을 이용한 것이다. 서로 다른 두 종류의 금속을 전자가 이동하면서 반응을 일으킬 수 있는 용액과 접촉할 수 있는 상태에 두면, 화학반응이 일어나 두 금속 사이에 전자의 흐름을 만들 수 있는 힘이 생기게 된다. 즉, 도선을 통해 반응성이 큰 금속에서 반응성이 작은 금속으로 전자가 이동하여 전류가 흐르게 된다.[14]
전지는 크게 양극, 음극, 전해질 이렇게 3가지 파트로 구성되어 있다. 황산() 전해질에 아연()과 구리()판을 올려놓고 전선을 연결하면, 아연은 산화되어서 아연 양이온(Zn2+)과 전자(2e-)를 내놓는다. 묽은 황산은 이온화 정도가 약 58%로, 강한 산성은 금속과 잘 반응하여 수소를 발생한다. 묽은 황산은 염산 및 질산과 함께 강산으로 작용하는 대표적인 산으로서, 물 속에서 다음과 같이 2단계로 이온화한다. 황산이온은 → 로 생성되고, 황산수소이온은 → 로 생성된다.
아연 양이온은 아연금속에 분리되어서 나오고 전자는 아연금속 내에 쌓이고, 음극이 된다. 음극 아연판에서는 산화 반응이 일어난다. 여기에 전선을 연결하면, 전자(e-)가 구리판 쪽으로 흘러 전류가 흐르기 시작한다. 구리판에 도착한 전자는 황산의 수소(H⁺)와 만나서 H2가 된다. 양극 구리판에 환원 반응을 보인다. 여기서 's'는 고체, 'g'는 기체, 'aq'는 수용액(aqueous)을 의미한다.[2]
음극 : → 양극 : → 전체 : →
리튬전지
리튬전지는 음극에 금속 리튬(Li)을 사용한 전지들을 모두 가리키는 단어이다. 기능면으로 1차전지와 2차전지로 나뉜다. 1차전지는 3V 이상의 기전력을 가지며, 전해질은 프로필렌탄산염 등 유기비수용액(有機非水溶液)이 쓰인다. 종래의 망가니즈건전지보다 약 2배의 고전압을 지니며, 에너지 밀도도 5∼10배이기 때문에, 전자시계, 카메라, 부표 등의 전원에 널리 쓰인다. 이 밖에 고체전해질을 사용한 전지가 심장페이스메이커 등에 사용되고 있다. 2차전지는 리튬을 사용한 고에너지 밀도의 전지로서, 음극에 금속 리튬을, 양극에 이황화타이타늄을 사용한 고체 전해질 리튬전지나 용융염(熔融鹽)을 사용한 고온형 리튬황화철전지 등이 있으며, 리튬이온전지와 리튬폴리머전지 등이 있다.[15]
리튬이온전지가 충전이 될 시에는 리튬이온(Li⁺)이 양극에서 빠져서 음극으로 흐른다. 자연히 양극에 전지가 축적되어서 음극으로 흐른다. 리튬이온전지가 방전될 때는 음극에서 리튬이온이 양극으로 움직인다. 방전이 될 때는 볼타전지에서처럼 음극이 산화되면, 음극의 리튬양이온(Li⁺)이 양극으로 간다. 음극에는 전자가 축적되고 자연히 전류가 양극으로 흐른다.[2]
리튬이온전지
리튬이온전지 1960년대에 그 원리가 제안되었지만 리튬의 반응성이 너무 커서 안정성 문제 해결이 어려워 실용화되지 못하다가 1991년 소니 회사가 제품 개발에 성공함으로써 상용화되기 시작했다. 리튬이온 배터리는 외부 전원을 이용해서 충전할 수 있는 2차전지의 일종이다. 리튬이온전지는 다른 전지에 비해 탁월한 강점을 가지고 있다. 리튬 금속은 다른 어느 금속보다 가볍기 때문에 이 금속을 사용한 전지도 매우 가벼워 에너지 밀도가 매우 크다. 리튬 전해질을 사용한 리튬이온전지의 에너지 밀도는 160Wh/kg으로 니켈-카드뮴 전지의 약 2배, 납 축전지의 6배 정도로서, 기전력이 크다. 리튬이온전지의 기전력은 3.6V로 이 전지 하나로 휴대전화를 작동시킬 수 있다. 니켈-기반(nickel-based)의 전지는 기전력이 1.2V이기 때문에 이 전지 세 개를 직렬 연결하여야 리튬이온전지 한 개의 기전력을 얻을 수 있다. 리튬이온전지는 관리가 쉽다. 리튬이온전지는 기억효과(memory effect)가 없어 완전히 방전시키지 않고 어느 정도 충전되어 있는 상태에서도 충전이 가능하다. 1,000회 이상 반복해도 기억효과가 발생하지 않아 전지를 다 쓰지 않고 재충전해도 수명이 단축되지 않으며 내구성이 좋다. 자가 방전에 의한 전력 손실이 매우 적다는 장점이 있다. 리튬이온전지의 자가 방전율은 "5%/월"로 니켈-기반의 전지의 4분의 1 정도에 불과하다. 하지만, 리튬이온전지는 제조된 직후부터 열화(degrading)가 시작되어 사용량에 관계없이 시간의 흐름에 따라 노화된다. 대개 리튬전지의 수명은 2년에서 3년 정도이다. 또한, 온도에 민감하다. 온도가 높을수록 노화가 빨리 진행된다. 0℃에서는 연간 약 6%, 25℃에서는 약 20%, 40℃에서는 약 35%의 용량 감소가 일어난다. 리튬이온전지를 잘못 취급하여 극한 고온상태로 둔다든지, 햇빛이 쪼이는 곳에 놓아둔다든지 하면 폭발할 위험이 있다. 리튬이온전지는 양극으로 LiCoO2를 사용하고, 음극으로 탄소를 사용하며, 충전 및 방전 때의 반응은 다음과 같다.
산화 전극 : → 환원 전극 : → 전체 반응 : →
여기서 유의해야 할 점은 리튬이온전지의 충전방전 시 리튬이온 자체는 분리막을 통해 양극과 음극을 오갈 뿐 산화되지 않는다. 산화 환원에 참여하는 것은 코발트(Co)이다. 충전 때에는 Co3+가 산화되어 Co4+로 되고, 방전 때에는 Co4+가 환원되어 Co3+로 된다.[16]
↔
- 리튬이온 배터리(Lithium ion battery)
- 리튬이온 배터리는 외부 전원을 이용해서 충전할 수 있는 2차전지의 일종이다. 1991년에 소니(SONY)가 최초로 상용화했다. 리튬이온전지는 출력 전압이 3.7V로 이전에 사용되던 니켈 카드뮴(Ni-Cd) 1.2V, 니켈 수소(Ni-MH) 1.5V보다 전압이 3배 정도 높고, 높은 에너지 밀도와 우수한 보존성 및 긴 라이프 사이클 등 많은 장점을 지니고 있어 노트북 컴퓨터, 디지털카메라, 캠코더, 핸드폰 등 개인용 모바일 기기에 폭넓게 적용되고 있다.[17]
물리전지
물리전지는 화학반응을 수반하지 않는 물리적 에너지를 에너지원으로 하는 전지이다. 물질의 물리적 변화에 의해서 발생하는 에너지를 직접 전기에너지로 변환하는 물리전지는 종류에 따라 발전의 원리가 각각 다른데, 태양전지, 원자력전지, 열전기 발전형 전지, 열전자 발전형 전지 등이 있다.[18]
태양전지
태양전지(solar cell)는 광전지(photovoltaic cell)로도 불리는데, 태양 빛을 전기로 변환시키는 장치이다. 태양에너지를 전기에너지로 변환할 목적으로 제작된 광전지로서 금속과 반도체의 접촉면 또는 반도체의 PN 접합에 빛을 조사(照射)하면 광전효과에 의해 광기전력이 일어나는 것을 이용한 것이다. 금속과 반도체의 접촉을 이용한 것으로는 셀렌광전지, 아황산 구리 광전지가 있고, 반도체 PN 접합을 사용한 것으로는 태양전지로 이용되고 있는 실리콘 광전지가 있다. 태양전지는 실리콘으로 대표되는 반도체이며 반도체 기술의 발달과 반도체 특성에 의해 자연스럽게 개발되었다. 태양전지는 전기적 성질이 다른 N(negative)형의 반도체와 P(positive)형의 반도체를 접합시킨 구조를 하고 있으며, 2개의 반도체 경계 부분을 PN 접합(PN-junction)이라 일컫는다. 이러한 태양전지에 태양빛이 닿으면 태양빛은 태양전지 속으로 흡수되며, 흡수된 태양빛이 가지고 있는 에너지에 의해 반도체 내에서 정공 양극과 음극의 전기를 갖는 입자가 발생하여 각각 자유롭게 태양전지 속을 움직이지만, 전자는 N형 반도체쪽으로, 정공 양극은 P형 반도체쪽으로 모이게 되어 전위가 발생하게 된다. 이 전위 차이 때문에 앞면과 뒷면에 붙여 만든 전극에 전구나 모터와 같은 부하를 연결하게 되면 전류가 흐르게 되는 데, 이것이 태양전지의 PN 접합에 의한 태양광 발전의 원리이다.[19]
열전지
열전지는 전해질에 용융염을 사용하여 100℃ 이상의 온도에서 사용하는 전지이다. 연료전지 중에는 200℃ 이상의 용융염을 사용하는 것도 있으며, 이것은 넓은 의미에서의 열전지에 속한다. 그러나, 좁은 의미에서 열전지는 전지의 활성 물질이 연료 이외의 것인 경우를 가리킨다. 열전지의 특징은, 용융염의 전도율이 수용액에 비하여 크기 때문에 전지의 내부 저항이 작으며, 또 상온에서는 전도성이 없어 자기 방전이 없고 보수성이 좋은 점 등을 들 수 있다.[20]
원자력전지
원자력전지는 방사성 물질의 에너지가 태양전지 기타의 에너지 변환기에 의해 전기에너지로 변환되는 1차전지이다. 원자력전지는 물리전지의 일종으로, 원자핵이 붕괴할 때 방출하는 에너지를 직접 전기에너지로 변환하는 것이다. 이것은 아이소토프(동위원소)를 사용하기 때문에 아이소토프 전지라고도 하며, β선을 내는 스트론튬이나 플루토늄이 아이소토프를 사용하여 실리콘의 PN 접합을 조사(照射)했을 때 발생하는 열을 비스머스-텔루르의 합금 등으로 만든 열전 소자에 의해서 전기에너지로 변환하는 것이다. 원자력전지는 수명이 길기 때문에 인공위성이나 인공장기 등에 이용된다.[21]
연료전지
연료전지(fuel cell)란 수소와 탄화수소 등의 통상적인 연료와 산화제를 전기화학적으로 반응시켜 전기로 변환을 하는 전기화학 전지이다. 연료전지는 모든 반응물이 전지에 포함되어 있어 배터리와 달리 전기를 생산하기 위해 연료를 지속해서 공급해야만 하는 차이가 있다. 가장 흔한 연료전지 시스템은 수소를 기반으로 하는데 연료인 수소(H2)와 산화제인 산소(O2)가 전극에서 전기화학 반응을 일으켜 전기를 발생시키고 생성물로는 물(H2O)이 만들어진다.
산화 전극 : → 환원 전극 : → 전체 반응 : →
이러한 연료전지의 효율은 열역학 제2법칙의 제한을 받지 않아 가장 효율이 좋은 내연기관보다 두 배 더 효과적으로 전기를 생산한다. 그뿐만 아니라 내연기관들에서 불가피하게 발생하는 환경오염이 연료전지에서는 전혀 발생하지 않아 환경 보존에 크게 도움이 되는 장점이 있다. 오늘날 연료전지에 관한 많은 연구는 전해질과 전극 촉매 물질의 개선과 함께 수소 기체보다 운송이 간편한 알코올이나 탄화수소와 같은 통상적인 연료를 사용하는 연료전지의 개발에 집중되고 있다.[8]
- 알칼리형(Alkaline Fuel Cell) : 1960년대 군사용 '우주선: 아폴로 11호'로 개발되었다. 순 수소 및 순 산소를 사용한다.
- 인산형(Phosphoric Acid Fuel Cell) : 1970년대 민간 차원에서 처음으로 기술이 개발된 1세대 연료전지로 병원, 호텔, 건물 등 분산형 전원으로 이용하였다. 가장 앞선 기술로 미국, 일본에서 실용화 단계에 있다.
- 용융탄산염형(Molten Carbonate Fuel Cell) : 1980년대에 기술이 개발된 2세대 연료전지로 대형발전소, 아파트단지, 대형건물의 분산형 전원으로 이용한다. 미국, 일본에서 기술개발을 완료하고 성능평가를 진행 중이다. 250kW 상용화, 2MW 실증 등이다.
- 고체산화물형(Sold Oxide Fuel Cell) : 1980년대에 본격적으로 기술개발된 3세대로서, 용융탄산염형보다 효율이 우수한 연료전지, 대형발전소, 아파트단지 및 대형건물의 분산형 전원으로 이용한다. 미국, 일본 등지에서는 가정용, 자동차용 등으로도 연구를 진행하고 있으나 한국은 다른 연료전지에 비해 기술력이 가장 낮다.
- 고분자전해질형(Polymer Electrolyte Membrane) : 1990년대에 기술개발된 4세대 연료전지로 가정용, 자동차용, 이동용 전원으로 이용한다. 가장 활발하게 연구되는 분야이며, 실용화 및 상용화도 타 연료전지보다 빠르게 진행되고 있다.
- 직접메탄올연료전지(Direct Methanol Fuel Cell) : 1990년대 말부터 기술개발된 연료전지로 이동용 핸드폰과 노트북 등 전자제품의 전원으로 이용한다. 고분자전해질형 연료전지와 함께 가장 활발하게 연구되는 분야이다.[19]
활용
전기자동차 배터리
최근 한국산 전기자동차에는 리튬 폴리머 배터리가 주로 쓰이고 있다. 2차전지인 니켈 카드뮴과 니켈수소 전지는 1.2v 정도의 전압을 가지고 있다. 리튬 폴리머 배터리는 3.6v 또는 3.7의 전압을 가지고 있는데 1개당 1셀이라는 단위로 불린다. 이것을 몇 개씩 묶어 배터리팩으로 부르고 모듈화해 전기차에 장착하는 것이다. 코나 EV , 니로 EV에는 에너지 용량 64KWh의 리튬 폴리머 배터리가 장착되는데 리튬 폴리머 배터리 98개 정도를 묶어 배터리 케이스에 넣어 장착한다(3.6V X 98셀 = 352.8V). 테슬라 모델S 전기자동차에는 원통형 리튬이온 배터리인 파나소닉 NCA 18650 배터리가 적용되었다. 지름이 18mm, 길이가 65mm인 원통형 전지가 장착되어 있다. 테슬라 로드스터의 경우에는 범용 리튬이온 배터리 6,831개를 사용하며, 일본 EV 클럽이 제작한 미라 EV는 리튬이온 배터리를 8,320개를 탑재하여 240V의 전압을 사용한다.
리튬 폴리머 배터리에는 5대 구성요소가 있다. 양극, 음극, 전해질, 분리막, 케이스 등인데 여기에서 리튬 배터리용 양극재에는 니켈, 코발트, 망간이 사용된다, 이것의 앞 글자를 따서 "N, C, M"이라고 하고 비율을 적절히 섞어 안정성과 성능을 결정짓는다. 이에 따라 코나 EV, 니로 EV에는 NCM622의 리튬 폴리머 배터리를 채용하였다. 니로 EV는 NCM811을 쓰겠다고 하였지만 안정성과 범용적인 측면에서 문제가 될 소지가 있어 NCM622로 급선회한 사례가 있다.[22]
각주
- ↑ 산업안전대사전, 〈전지〉, 《네이버 지식백과》
- ↑ 2.0 2.1 2.2 조영지(Youngji), 〈전지(Battery)의 원리〉, 《미디엄》, 2015-09-03
- ↑ 두산백과, 〈전지〉, 《네이버 지식백과》
- ↑ 두산백과, 〈전극〉, 《네이버 지식백과》
- ↑ 물리학백과, 〈음극〉, 《네이버 지식백과》
- ↑ 물리학백과, 〈양극〉, 《네이버 지식백과》
- ↑ 네이버캐스트, 〈전지, 배터리〉, 《네이버 지식백과》
- ↑ 8.0 8.1 8.2 8.3 8.4 8.5 화학백과, 〈전지〉, 《네이버 지식백과》
- ↑ 화학용어사전, 〈알칼리 망간(망가니즈) 전지〉, 《네이버 지식백과》
- ↑ 화학백과, 〈납축전지〉, 《네이버 지식백과》
- ↑ 두산백과, 〈니켈-카드뮴전지〉, 《네이버 지식백과》
- ↑ IT용어사전, 〈니켈-카드뮴 전지〉, 《네이버 지식백과》
- ↑ 두산백과, 〈산화은전지〉, 《네이버 지식백과》
- ↑ 〈화학전지의 원리〉, 《에듀넷》
- ↑ 두산백과, 〈리튬전지〉, 《네이버 지식백과》
- ↑ 두산백과, 〈리튬-이온전지〉, 《네이버 지식백과》
- ↑ 최오현 MD, 〈배터리(battery)종류와 특징〉, 《디바이스마트》, 2014-01-27
- ↑ 〈물리 전지〉, 《네이버 지식백과》
- ↑ 19.0 19.1 〈신재생에너지〉, 《녹색에너지연구원》
- ↑ 화학대사전, 〈열전지〉, 《네이버 지식백과》
- ↑ 전자용어사전, 〈원자력 전지〉, 《네이버 지식백과》
- ↑ 마키님, 〈전기차에게 가장 중요한 부품 배터리에 대해 알아보자〉, 《이브이포스트》, 2019-05-27
참고자료
- 두산백과, 〈전지〉, 《네이버 지식백과》
- 산업안전대사전, 〈전지〉, 《네이버 지식백과》
- 화학백과, 〈전지〉, 《네이버 지식백과》
- 〈화학전지의 원리〉, 《에듀넷》
- 조영지(Youngji), 〈전지(Battery)의 원리〉, 《미디엄》, 2015-09-03
- 물리학백과, 〈음극〉, 《네이버 지식백과》
- 물리학백과, 〈양극〉, 《네이버 지식백과》
- 네이버캐스트, 〈전지, 배터리〉, 《네이버 지식백과》
- 화학용어사전, 〈알칼리 망간(망가니즈) 전지〉, 《네이버 지식백과》
- 화학백과, 〈납축전지〉, 《네이버 지식백과》
- 두산백과, 〈니켈-카드뮴전지〉, 《네이버 지식백과》
- IT용어사전, 〈니켈-카드뮴 전지〉, 《네이버 지식백과》
- 두산백과, 〈산화은전지〉, 《네이버 지식백과》
- 두산백과, 〈리튬전지〉, 《네이버 지식백과》
- 두산백과, 〈리튬-이온전지〉, 《네이버 지식백과》
- 〈물리 전지〉, 《네이버 지식백과》
- 화학대사전, 〈열전지〉, 《네이버 지식백과》
- 마키님, 〈전기차에게 가장 중요한 부품 배터리에 대해 알아보자〉, 《이브이포스트》, 2019-05-27
- 최오현 MD, 〈배터리(battery)종류와 특징〉, 《디바이스마트》, 2014-01-27
- 〈신재생에너지〉, 《녹색에너지연구원》
같이 보기

 위키원
위키원