"악티늄족"의 두 판 사이의 차이
잔글 (→독성) |
잔글 (→성질) |
||
| (같은 사용자의 중간 판 4개는 보이지 않습니다) | |||
| 109번째 줄: | 109번째 줄: | ||
[[산화 토륨]]은 1827년에 노르웨이에서 획득한 광물을 연구하던 중 [[프리드리히 뵐러]]에 의해 발견되었다. [[옌스 야코브 베르셀리우스]]는 1828년에 이 광물의 특징을 더 밝혀냈다. [[사염화 토륨]]을 칼륨과 함께 가열시키던 중 환원되어 나왔다. 그는 금속을 분리시키고 [[북유럽 신화]]에 나오는 천둥의 신 토르에서 이름을 얻어 이름을 토륨이라 붙였다. 이 분리 방법은 후에 페리고가 우라늄을 분리할 때 같은 방법으로 이용되었다. | [[산화 토륨]]은 1827년에 노르웨이에서 획득한 광물을 연구하던 중 [[프리드리히 뵐러]]에 의해 발견되었다. [[옌스 야코브 베르셀리우스]]는 1828년에 이 광물의 특징을 더 밝혀냈다. [[사염화 토륨]]을 칼륨과 함께 가열시키던 중 환원되어 나왔다. 그는 금속을 분리시키고 [[북유럽 신화]]에 나오는 천둥의 신 토르에서 이름을 얻어 이름을 토륨이라 붙였다. 이 분리 방법은 후에 페리고가 우라늄을 분리할 때 같은 방법으로 이용되었다. | ||
| − | 악티늄은 1899년에 [[마리 퀴리]]의 도움으로 드비에른에 의해 발견되었다. 라듐과 폴로늄을 빼고 남은 피치블렌드 찌꺼기에서 발견된 것이다. 1899년 당시, 그는 이 물질이 [[티타늄]]과 비슷했다고 하였다. 또, 1900년 당시에는 토륨과도 비슷했다고 했다. 1971년에 악티늄의 발견자가 드비에른이 맞는 지에 대한 논쟁이 일어나기도 하였다. 그리고 2000년에도 일어났는데 발표가 1904년에 되었는데 1899–1900년에 했던 실험이 모순점이라는 것이었다. 악티늄의 어원은 그리스어로 빛, 광선을 뜻하는 ''aktis, aktinos'' (ακτίς, ακτίνος)를 사용하였다. 이 금속은 자기 자신은 방사성이 아니지만 딸핵종은 방사성이 존재했기 때문이다. 란타넘족과 악티늄족의 유사점이 서서히 밝혀지게 되었다. 자연에 존재하는 적은 양의 원소이었던 것이다. 순수한 악티늄은 1950년이 되어서야 만들어졌다. 악티늄족은 1937년에 [[빅터 골드슈미트]]에 의해 소개되었을 것으로 추정된다. | + | 악티늄은 1899년에 [[마리 퀴리]]의 도움으로 드비에른에 의해 발견되었다. 라듐과 폴로늄을 빼고 남은 피치블렌드 찌꺼기에서 발견된 것이다. 1899년 당시, 그는 이 물질이 [[티타늄]]과 비슷했다고 하였다. 또, 1900년 당시에는 토륨과도 비슷했다고 했다. 1971년에 악티늄의 발견자가 드비에른이 맞는 지에 대한 논쟁이 일어나기도 하였다. 그리고 2000년에도 일어났는데 발표가 1904년에 되었는데 1899–1900년에 했던 실험이 모순점이라는 것이었다. 악티늄의 어원은 그리스어로 빛, 광선을 뜻하는 ''aktis, aktinos'' (ακτίς, ακτίνος)를 사용하였다. 이 금속은 자기 자신은 방사성이 아니지만 딸핵종은 방사성이 존재했기 때문이다. 란타넘족과 악티늄족의 유사점이 서서히 밝혀지게 되었다. 자연에 존재하는 적은 양의 원소이었던 것이다. 순수한 악티늄은 1950년이 되어서야 만들어졌다. 악티늄족은 1937년에 [[빅터 골드슈미트]]에 의해 소개되었을 것으로 추정된다. |
[[프로탁티늄]]은 1900년에 [[윌리엄 크룩스]]에 의해 분리되었다. 1913년에, [[카지미에시 파얀스]]와 오스발트 헬무트 괴링은 <sup>238</sup>U 붕괴 연구에서 짧은 반감기를 가진 <sup>234m</sup>Pa (반감기: 1.17분)를 발견했다. 그들은 새로운 원소의 이름을 ''브레븀''이라고 명칭했다.(라틴어로 짧다는 뜻의 ''brevis''에서 유래되었다.); 이름은 후에 ''프로탁티늄''으로 바뀐다. (그리스어로 πρῶτος + ἀκτίς, "광선 원소보다 먼저"의 뜻을 가지고 있다.) 1918년에 두 그룹의 과학자들이 <sup>231</sup>Pa를 발견하였다. (독일의 오스트리아인 [[리제 마이트너]]와 [[오토 한]], 그리고 영국의 [[프레더릭 소디]]와 존 크랜스턴) 이름은 1949년에 ''프로탁티늄''으로 좁혀졌다.이 원소는 1960년까지 특별한 일이 있었는데, 영국에서 A. G. 매덕과 그의 동업자들이 우라늄을 추출하고 남은 60톤의 찌꺼기들을 분석해서 130그램의 프로탁티늄을 만들어냈다. | [[프로탁티늄]]은 1900년에 [[윌리엄 크룩스]]에 의해 분리되었다. 1913년에, [[카지미에시 파얀스]]와 오스발트 헬무트 괴링은 <sup>238</sup>U 붕괴 연구에서 짧은 반감기를 가진 <sup>234m</sup>Pa (반감기: 1.17분)를 발견했다. 그들은 새로운 원소의 이름을 ''브레븀''이라고 명칭했다.(라틴어로 짧다는 뜻의 ''brevis''에서 유래되었다.); 이름은 후에 ''프로탁티늄''으로 바뀐다. (그리스어로 πρῶτος + ἀκτίς, "광선 원소보다 먼저"의 뜻을 가지고 있다.) 1918년에 두 그룹의 과학자들이 <sup>231</sup>Pa를 발견하였다. (독일의 오스트리아인 [[리제 마이트너]]와 [[오토 한]], 그리고 영국의 [[프레더릭 소디]]와 존 크랜스턴) 이름은 1949년에 ''프로탁티늄''으로 좁혀졌다.이 원소는 1960년까지 특별한 일이 있었는데, 영국에서 A. G. 매덕과 그의 동업자들이 우라늄을 추출하고 남은 60톤의 찌꺼기들을 분석해서 130그램의 프로탁티늄을 만들어냈다. | ||
| 137번째 줄: | 137번째 줄: | ||
그럼에도 불구하고, 버클리 연구소에서는 아인슈타이늄과 페르뮴을 만들 수 있을 것이라고 생각했다. 그래서 플루토늄-239에 중성자를 충돌시키자는 생각을 하고, 1954년에 실험을 하여 만들었다. 이것은 첫 발견이 아니라는 것에 대한 부인까지 합해서 발표했다. "아이비 마이크" 사건은 미등록되고 1955년에서 IUPAC이 승인했다. | 그럼에도 불구하고, 버클리 연구소에서는 아인슈타이늄과 페르뮴을 만들 수 있을 것이라고 생각했다. 그래서 플루토늄-239에 중성자를 충돌시키자는 생각을 하고, 1954년에 실험을 하여 만들었다. 이것은 첫 발견이 아니라는 것에 대한 부인까지 합해서 발표했다. "아이비 마이크" 사건은 미등록되고 1955년에서 IUPAC이 승인했다. | ||
| − | 멘델레븀의 첫번째 동위원소는, [[멘델레븀-256|<sup>256</sup>Md]]이었다. (반감기: 87분)[[버클리 방사선 연구소]]에 있는 60-인치의 [[입자 가속기]]를 이용해서 알버트 기오르소, 글렌 T. 시보그, 그레고리 R. 쇼핀, 베르나르드 G. 하비 그리고 스탠리 G. 톰슨이 합성했다. <sup>253</sup>Es에 [[알파 입자]]를 충돌시켜서 만들어졌다. 이것은 모든 원소 중 처음으로 합성 시 하나의 원자만 나온 합성 원소였다. | + | 멘델레븀의 첫번째 동위원소는, [[멘델레븀-256|<sup>256</sup>Md]]이었다. (반감기: 87분)[[버클리 방사선 연구소]]에 있는 60-인치의 [[입자 가속기]]를 이용해서 알버트 기오르소, 글렌 T. 시보그, 그레고리 R. 쇼핀, 베르나르드 G. 하비 그리고 스탠리 G. 톰슨이 합성했다. <sup>253</sup>Es에 [[알파 입자]]를 충돌시켜서 만들어졌다. 이것은 모든 원소 중 처음으로 합성 시 하나의 원자만 나온 합성 원소였다. |
노벨륨의 동위 원소를 얻기 위해 스웨덴(1957)과 미국(1958) 팀 등에서 여러 시도를 했지만, 처음으로 노벨륨의 동위 원소를 만든 팀은 [[노벨륨-256|<sup>256</sup>No]]을 만든 소련 팀 ([[게오르기 플료로프]] ''외.'')이었다. 1965년에 만들어졌고, 1992년에 [[IUPAC]]에서 승인했다. 플료로프 ''외.'' 팀은 우라늄-238에 네온-22를 충돌시켜서 노벨륨 동위 원소를 만들었다. | 노벨륨의 동위 원소를 얻기 위해 스웨덴(1957)과 미국(1958) 팀 등에서 여러 시도를 했지만, 처음으로 노벨륨의 동위 원소를 만든 팀은 [[노벨륨-256|<sup>256</sup>No]]을 만든 소련 팀 ([[게오르기 플료로프]] ''외.'')이었다. 1965년에 만들어졌고, 1992년에 [[IUPAC]]에서 승인했다. 플료로프 ''외.'' 팀은 우라늄-238에 네온-22를 충돌시켜서 노벨륨 동위 원소를 만들었다. | ||
| 249번째 줄: | 249번째 줄: | ||
여러 원소를 포함하고 있는 [[돌로마이트]]나 [[마그네사이트]] 등의 우라늄 광석일 경우, 산성 물질을 더 많이 필요로 한다. 이 경우에는, 탄산염을 이용한 방법이 우라늄 추출에 주로 쓰인다. 이 방법의 가장 중요한 요소는 [[탄산나트륨]]의 수용액인데, 이것은 우라늄을 복합적인 [UO<sub>2</sub>(CO<sub>3</sub>)<sub>3</sub>]<sup>4−</sup>로 전환시킨다. 이것은 수산화 이온이 적은 수용액 중 안정적인 수용액에 속한다. 탄산나트륨을 이용한 방법의 장점은 화합물의 부식성이 낮고(질산염과 비교했을 때) 가장 좋은 점인 수용액에서 우라늄이 아닌 광석을 침전시킨다는 것이다. 단점은 4가의 우라늄 화합물이 침전이 잘 된다는 것이다. 그러므로, 우라늄 광석은 높은 온도와 낮은 산소 압력일 때에는 탄산나트륨으로 처리하는 것이 효과적이다. | 여러 원소를 포함하고 있는 [[돌로마이트]]나 [[마그네사이트]] 등의 우라늄 광석일 경우, 산성 물질을 더 많이 필요로 한다. 이 경우에는, 탄산염을 이용한 방법이 우라늄 추출에 주로 쓰인다. 이 방법의 가장 중요한 요소는 [[탄산나트륨]]의 수용액인데, 이것은 우라늄을 복합적인 [UO<sub>2</sub>(CO<sub>3</sub>)<sub>3</sub>]<sup>4−</sup>로 전환시킨다. 이것은 수산화 이온이 적은 수용액 중 안정적인 수용액에 속한다. 탄산나트륨을 이용한 방법의 장점은 화합물의 부식성이 낮고(질산염과 비교했을 때) 가장 좋은 점인 수용액에서 우라늄이 아닌 광석을 침전시킨다는 것이다. 단점은 4가의 우라늄 화합물이 침전이 잘 된다는 것이다. 그러므로, 우라늄 광석은 높은 온도와 낮은 산소 압력일 때에는 탄산나트륨으로 처리하는 것이 효과적이다. | ||
| − | :2 UO<sub>2</sub> + O<sub>2</sub> + 6 | + | :2 UO<sub>2</sub> + O<sub>2</sub> + 6 CO ²⁻₃→ 2 [UO<sub>2</sub>(CO<sub>3</sub>)<sub>3</sub>]<sup>4−</sup> |
이 화학식은 용해 방법 중 가장 좋은 방법인 탄산우라늄 공정 과정에서 탄산염과 중탄산염의 혼합물을 넣는 이유를 설명한다. pH가 높을 때에는, 중우라늄산염의 침전물이 나타난다. 이것은 니켈이 들어있는 물에 녹지 않는 사우라늄산염의 탄성 한도를 이용하여 [[수소]]로 처리할 수 있다.(마지막 문장 오역 가능성 있음) | 이 화학식은 용해 방법 중 가장 좋은 방법인 탄산우라늄 공정 과정에서 탄산염과 중탄산염의 혼합물을 넣는 이유를 설명한다. pH가 높을 때에는, 중우라늄산염의 침전물이 나타난다. 이것은 니켈이 들어있는 물에 녹지 않는 사우라늄산염의 탄성 한도를 이용하여 [[수소]]로 처리할 수 있다.(마지막 문장 오역 가능성 있음) | ||
| 360번째 줄: | 360번째 줄: | ||
! +5 | ! +5 | ||
| || | | || | ||
| − | | ''' | + | | '''PaO₂⁺''' |
| − | | style="background:#ff88ff;"| ''' | + | | style="background:#ff88ff;"| '''UOO⁺₂''' |
| − | | style="background:#0c0;"| ''' | + | | style="background:#0c0;"| '''NpO⁺₂''' |
| − | | style="background:#d17;"| <span style="color:white;">''' | + | | style="background:#d17;"| <span style="color:white;">'''PuO⁺₂'''</span> |
| − | | style="background:#ff0;"| ''' | + | | style="background:#ff0;"| '''AmO⁺₂''' |
|| || || || || || || || | || || || || || || || || | ||
|- | |- | ||
! +6 | ! +6 | ||
| || || | | || || | ||
| − | | style="background:#ff0;"| ''' | + | | style="background:#ff0;"| '''UO²⁺₂''' |
| − | | style="background:#fbb;"| ''' | + | | style="background:#fbb;"| '''NpO²⁺₂''' |
| − | | style="background:#fa7;"| ''' | + | | style="background:#fa7;"| '''PuO²⁺₂''' |
| − | | style="background:#ff5;"| ''' | + | | style="background:#ff5;"| '''AmO²⁺₂''' |
|| || || || || || || || | || || || || || || || || | ||
|- | |- | ||
! +7 | ! +7 | ||
| || || || | | || || || | ||
| − | | style="background:#4a4;"| ''' | + | | style="background:#4a4;"| '''NpO³⁺₂''' |
| − | | style="background:#44aa88;"| ''' | + | | style="background:#44aa88;"| '''PuO³⁺₂''' |
| − | | style="background:#4a4;"| ''' | + | | style="background:#4a4;"| '''AmO³⁻₅''' |
|| || || || || || || || | || || || || || || || || | ||
|} | |} | ||
| 468번째 줄: | 468번째 줄: | ||
파일:U3O8 (우라늄염).jpg|U<sub>3</sub>O<sub>8</sub> (우라늄염) | 파일:U3O8 (우라늄염).jpg|U<sub>3</sub>O<sub>8</sub> (우라늄염) | ||
</gallery> | </gallery> | ||
| − | |||
==화합물== | ==화합물== | ||
2024년 5월 31일 (금) 17:31 기준 최신판
| 원자번호 | 이름 | 기호 |
|---|---|---|
| 89 | 악티늄 | Ac |
| 90 | 토륨 | Th |
| 91 | 프로트악티늄 | Pa |
| 92 | 우라늄 | U |
| 93 | 넵투늄 | Np |
| 94 | 플루토늄 | Pu |
| 95 | 아메리슘 | Am |
| 96 | 퀴륨 | Cm |
| 97 | 버클륨 | Bk |
| 98 | 캘리포늄 | Cf |
| 99 | 아인슈타이늄 | Es |
| 100 | 페르뮴 | Fm |
| 101 | 멘델레븀 | Md |
| 102 | 노벨륨 | No |
| 103 | 로렌슘 | Lr |
악티늄족(actinoids)은 악티늄부터 로렌슘까지 원자 번호가 89부터 103까지인 15개의 금속 원소를 포함하고 있는 족이다.
악티늄족은 악티늄족의 제일 처음 원소인 악티늄의 이름에서 따왔다. 기호 Ac은 악티늄족의 화학적 성질을 연구할 때 쓰이는 기호다. 로렌슘을 제외한 모든 원소들의 전자껍질이 f-block에 속하며, 로렌슘은 d-block에 속한다. 하지만 역시 악티늄족으로 취급받고 있다. 란타넘족과 비교하면, 대부분 F-block에 속해 있으며, 악티늄족은 원자가 더 강한 변화를 보인다. 원자 반지름과 이온 반지름이 매우 크며, 매우 큰 물리적 성질이 발견된다. 악티늄족 뒷부분은 (아메리슘부터 로렌슘까지) 란탄족과 유사하다. 토륨부터 넵투늄까지는 전이 금속에 더 가깝다고 볼 수 있다.
악티늄족은 모두 방사성 원소이며 붕괴할 때 에너지를 발생시킨다. 자연적으로 만들어진 우라늄과 토륨, 그리고 인공 합성할 수 있는 플루토늄은 지구에 다량으로 존재하는 악티늄족 원소이다. 이 원소는 원자로와 핵무기에 쓰인다. 우라늄과 토륨도 역사적으로나 다양한 곳에 쓰이고, 아메리슘은 이온화 상자나 대부분의 현대적 연기 감지기에 쓰인다.
악티늄족에는, 원시적으로 자연에 일정량 존재한 토륨과 우라늄, 그리고 적은 양이지만 플루토늄이 존재한다. 우라늄의 방사성 붕괴는 잠깐동안 악티늄과 프로탁티늄, 그리고 넵투늄 원자를 만들어 낸다. 그리고 플루토늄은 가끔 우라늄 광석에서 핵변환 반응을 만들어 낸다. 다른 악티늄족은 모두 인공 합성으로 만들어진 것이다. 핵무기 실험은 플루토늄보다 무거운 적어도 여섯 개의 악티늄족을 발견하게 했다. 1952년 수소 폭탄 폭발 잔해를 분석하던 중 아메리슘, 퀴륨, 버클륨, 캘리포늄, 아인슈타이늄 그리고 페르뮴을 발견했다.
주기율표에 따르면, 란타넘족과 악티늄족은 주기율표 본체의 아래쪽의 두 개의 추가적인 줄에 위치해 있다. 란타넘족이나 악티늄족을 표기할 때 특정한 하나의 원소로 족의 이름을 표기한다. (란타넘 아니면 루테튬, 그리고 악티늄 아니면 로렌슘으로 표기한다.) 이것은 주기율표 본체에 표기된다. (바륨과 하프늄 사이, 그리고 라듐과 러더포듐 사이에 존재한다.)이 족은 실제 주기율표 설정에서 드물게 아랫쪽에 길게 뻗어있는 표에 (주기율표 6주기와 7주기에 포함된다.) 란타넘족과 함께 넣어진다.
목차
발견, 분리와 합성[편집]
| 원소 | 년도 | 방법 |
|---|---|---|
| 넵투늄 | 1940 | 238U에 중성자 충돌. |
| 플루토늄 | 1941 | 238U에 중양성자 충돌. |
| 아메리슘 | 1944 | 239Pu에 중성자 충돌. |
| 퀴륨 | 1944 | 239Pu에 α-입자 충돌. |
| 버클륨 | 1949 | 241Am에 α-입자 충돌. |
| 캘리포늄 | 1950 | 242Cm에 α-입자 충돌. |
| 아인슈타이늄 | 1952 | 핵 폭발의 산물로 발견됨. |
| 페르뮴 | 1952 | 핵 폭발의 산물로 발견됨. |
| 멘델레븀 | 1955 | 253Es에 α-입자 충돌. |
| 노벨륨 | 1965 | 243Am에 15N 충돌. 아니면 238U에 α-입자 충돌. |
| 로렌슘 | 1961–1971 | 252Cf에 10B 또는 11B 충돌. 아니면 243Am에 18O 충돌. |
란타넘족과 같이, 악티늄족은 유사한 성질의 원소들을 모아둔 것이다. 악티늄족 내에는 초우라늄 원소라는 주기율표에서 우라늄을 따르는 원소와, 초플루토늄 원소라는 플루토늄을 따르는 원소, 두 개의 겹치는 그룹이 있다. 란타넘족과 비교하면, (프로메튬을 제외한) 자연에서 찾을 수 있지만, 대부분의 악티늄족 원소들은 흔치 않다. 가장 풍부하거나, 또는 가장 합성하기 쉬운 악티늄족은 우라늄과 토륨이다. 그 뒤로 플루토늄, 아메리슘, 악티늄, 프로탁티늄 그리고 넵투늄이 뒤를 잇는다.
초우라늄 원소의 존재는 1934년, 엔리코 페르미가 그의 연구를 바탕으로 제안한 것이다. 그러나, 그 당시 악티늄족은 4개의 원소밖에 존재하지 않아, 란타넘족과 비슷해진다는 개념을 사람들은 이해하지 못했다. 그 당시에 우세했던 주장은 초우라늄은 악티늄족이 아닌, 7주기에 들어가야 한다고 했던 것이다. 토륨과 프로탁티늄, 우라늄이 각각 6주기인 하프늄, 탄탈럼 그리고 텅스텐 아래에 있어야 한다는 것이었다. 초우라늄의 합성은 서서히 악티늄족의 중심을 파헤쳐갔다. 1944년에 악티늄족 가설을 완성시키기 위해 글렌 T. 시보그가 담당한 퀴륨의 산화 4- 이상의 산화 상태 실험 실패를 관찰하였다. (6주기인 백금 아래에 있을 것으로 추정되었던 것인데, 백금은 산화 6-까지 가능했기 때문이다.) 알려진 악티늄족의 가르침과 더 많은 초우라늄 원소들의 합성이 만들어낸 자료가 중심을 더 파고들어갔지만, 이 문장 "악티늄족 가설"("가설"의 영향은 결정적으로 입증되지 못했다.)은 남아서 1950년대 후반에 과학자들에 의해 적극적으로 활용하게 된다.
현재로써는, 초플루토늄 원소의 동위원소를 만드는 방법이 2가지가 존재한다. 중성자들 또는 가속된 입자에 초플루토늄보다 더 가벼운 원소를 조사(照射)하는 것이다. 첫번째 방법은 응용에 가장 중요한 방법이다. 핵 원자로에서 오직 중성자 조사만 이용하여 상당한 양의 인공 악티늄족을 만드는 것이었다. 그러나, 이 방법은 경원소일때만 해당되었다. 두번째 방법의 보완점은 플루토늄보다 무거운 원소를 이용하여, 중성자 조사를 기반으로 하지 않고 중성자가 부족한 동위원소를 획득할 수 있다.
1962년부터 1966년까지, 미국에서 여섯 종류의 지하 핵폭발을 이용해 초플루토늄 동위원소를 만들려고 한 시도가 있었다. 폭발이 끝나고 즉시 폭발구역의 폭발 산물에서 견본으로 쓸 적은 양의 암석이 추출되었다. 그러나 각 동위원소가 각각 알파 붕괴까지의 긴 반감기를 가지고 있었을 것이라고 예측되었음에도 불구하고 257보다 더 큰 질량수를 가진 동위원소는 발견되지 않았다. 이런 눈에 띄지 않는 것의 결과는 자발 핵분열과 큰 속도에 의해 생성된다. 다른 붕괴 경로로 가기도 하는데, 중성자 배출이나 핵분열로 만들어지기도 한다.
악티늄부터 우라늄까지[편집]
우라늄과 토륨은 처음으로 발견된 원소였다. 우라늄은 1789년에 독일 화학자 마르틴 하인리히 클라프로트가 피치블렌드 광석에서 발견되었고 인정되었다. 그는 천왕성에서 원소의 이름을 고안했다. 다른 과학자보다 단 8년 빠르게 발견한 것이다. 클라프로트는 피치블렌드를 질산에 담가 녹인 상태에서 수산화나트륨에 중화시키고 촉진시켜 (이우라늄산 나트륨 같은) 노란색 화합물을 만들었다. 그는 목탄과 발견한 노란 가루를 환원시켰고, 검은색 물질을 추출했다. 60년이 지난 뒤에, 프랑스의 과학자 페리고가 산화 우라늄을 발견했다. 또한 그는 사염화 우라늄과 칼륨을 함께 가열하여 금속 우라늄을 분리해냈다.
산화 토륨은 1827년에 노르웨이에서 획득한 광물을 연구하던 중 프리드리히 뵐러에 의해 발견되었다. 옌스 야코브 베르셀리우스는 1828년에 이 광물의 특징을 더 밝혀냈다. 사염화 토륨을 칼륨과 함께 가열시키던 중 환원되어 나왔다. 그는 금속을 분리시키고 북유럽 신화에 나오는 천둥의 신 토르에서 이름을 얻어 이름을 토륨이라 붙였다. 이 분리 방법은 후에 페리고가 우라늄을 분리할 때 같은 방법으로 이용되었다.
악티늄은 1899년에 마리 퀴리의 도움으로 드비에른에 의해 발견되었다. 라듐과 폴로늄을 빼고 남은 피치블렌드 찌꺼기에서 발견된 것이다. 1899년 당시, 그는 이 물질이 티타늄과 비슷했다고 하였다. 또, 1900년 당시에는 토륨과도 비슷했다고 했다. 1971년에 악티늄의 발견자가 드비에른이 맞는 지에 대한 논쟁이 일어나기도 하였다. 그리고 2000년에도 일어났는데 발표가 1904년에 되었는데 1899–1900년에 했던 실험이 모순점이라는 것이었다. 악티늄의 어원은 그리스어로 빛, 광선을 뜻하는 aktis, aktinos (ακτίς, ακτίνος)를 사용하였다. 이 금속은 자기 자신은 방사성이 아니지만 딸핵종은 방사성이 존재했기 때문이다. 란타넘족과 악티늄족의 유사점이 서서히 밝혀지게 되었다. 자연에 존재하는 적은 양의 원소이었던 것이다. 순수한 악티늄은 1950년이 되어서야 만들어졌다. 악티늄족은 1937년에 빅터 골드슈미트에 의해 소개되었을 것으로 추정된다.
프로탁티늄은 1900년에 윌리엄 크룩스에 의해 분리되었다. 1913년에, 카지미에시 파얀스와 오스발트 헬무트 괴링은 238U 붕괴 연구에서 짧은 반감기를 가진 234mPa (반감기: 1.17분)를 발견했다. 그들은 새로운 원소의 이름을 브레븀이라고 명칭했다.(라틴어로 짧다는 뜻의 brevis에서 유래되었다.); 이름은 후에 프로탁티늄으로 바뀐다. (그리스어로 πρῶτος + ἀκτίς, "광선 원소보다 먼저"의 뜻을 가지고 있다.) 1918년에 두 그룹의 과학자들이 231Pa를 발견하였다. (독일의 오스트리아인 리제 마이트너와 오토 한, 그리고 영국의 프레더릭 소디와 존 크랜스턴) 이름은 1949년에 프로탁티늄으로 좁혀졌다.이 원소는 1960년까지 특별한 일이 있었는데, 영국에서 A. G. 매덕과 그의 동업자들이 우라늄을 추출하고 남은 60톤의 찌꺼기들을 분석해서 130그램의 프로탁티늄을 만들어냈다.
넵투늄 이후[편집]
넵투늄(우라늄이라는 이름이 지어지고 나서, 천왕성보다 바깥쪽에 있는 해왕성에서 고안해낸 이름이다.)은 1940년, 캘리포니아 버클리에서 에드윈 맥밀런과 필립 H. 아벨슨이 발견했다. 그들은 우라늄에 느린 중성자를 충돌시켜 239Np 동위원소를 (반감기 = 2.4일)만들어 냈다. 이것은 인공적으로 만들어 낸 첫 초우라늄 원소였다.
초우라늄 원소들은 자연에서 발견되지 않거나 거의 없으며, 주로 핵반응에 의해 만들어진다. 핵 원자로에서 주로 만들어진다. 대표적 예로, 원자로 중성자에 조사(照射)를 하여, 우라늄-238이 부분적으로 플루토늄-239로 변환되기도 한다:
이 방법으로 엔리코 페르미와 그의 동업자들은, 첫 핵 원자로 시카고 파일-1을 이용해서, 많은 양의 플루토늄-239를 획득하였고,핵무기를 개발하는 데 큰 영향을 주었다.
악티늄족 원소 중 큰 원소는 입자 가속기로 우라늄, 플루토늄, 퀴륨 그리고 캘리포늄에 질소, 산소, 탄소, 네온 또는 붕소를 충돌시켜서 만들어진다. 그래서, 우라늄-238에 네온-22를 충돌시켜 노벨륨이 만들어졌다.
- .
초플루토늄족의 첫 동위원소는, 아메리슘-241과 퀴륨-242이다. 이 두 원소는 1944년, 글렌 T. 시보그, 랄프 A. 제임스 그리고 알버트 기오르소 팀에 의해 발견되었다. 퀴륨-242는 플루토늄-239에 32-MeV α-입자를 충돌시켜 만들어졌다.
- .
아메리슘-241과 퀴륨-242의 동위원소 역시 핵 원자로에서 플루토늄에 조사(照射)를 하여 만들어졌다. 뒤의 원소는 방사능과 라듐을 발견한 마리 퀴리와 그녀의 남편 피에르 퀴리의 공적을 기리기 위해 그들의 이름을 따서 만들어졌다.
1950년, 퀴륨-242에 α-입자를 충돌시켜 캘리포늄의 동위원소인 245Cf가 만들어졌다. 1949년, 비슷한 방법을 이용하여 아메리슘-241에 α-입자를 충돌시켜 버클륨-243을 만들기까지 하였다. 새로운 원소의 이름은 버클리, 캘리포니아 대학의 이름을 따서 만들어졌다. 터븀이 스웨덴의 이테르비에서 터븀이라는 이름이 나온 것처럼 란타넘족의 상동성과 유사점이 있었다.
1945년에, B. B. 커닝햄이 첫 초플루토늄족 원소 화합물을 발견했고, 수산화아메리슘으로 명칭하였다. 3년에서 4년 뒤, 밀리그램의 양의 아메리슘과 마이크로그램의 양의 퀴륨이 버클륨(톰슨, 1949년)과 캘리포늄(톰슨, 1950년)의 동위원소가 서서히 늘어나는데 도움을 주었다. 이렇게 많은 양의 원소들이 오직 1958년 안에서 발견되었다. (B. B. 커닝햄 그리고 S. G. 톰슨), 그리고 첫 캘리포늄 화합물(0.3 µg의 CfOCl)은 B. B. 커닝햄과 J. C. 월맨에 의해 발견되었다.
아인슈타이늄과 페르뮴은 1952년 11월 1일 실시된 수소폭탄의 첫 성공적 실험인 "아이비 마이크" 핵실험의 부산물로 각각 1952년과 1953년에 발견되었다. 중성자 폭발에 노출된 우라늄-238은 우라늄의 무거운 동위 원소를 생성했다. (우라늄-253과 우라늄-255을 포함한), 그리고 β-붕괴가 아인슈타이늄-253과 페르뮴-255를 만들었다. 새로운 원소의 발견과 중성자를 차지한다는 새로운 기록이 발견되었다. 그런데 그때 당시는 1955년까지 일어났던 냉전 시대여서 긴장 상태였기에 미국 군에서는 완전히 비밀로 하였다.
그럼에도 불구하고, 버클리 연구소에서는 아인슈타이늄과 페르뮴을 만들 수 있을 것이라고 생각했다. 그래서 플루토늄-239에 중성자를 충돌시키자는 생각을 하고, 1954년에 실험을 하여 만들었다. 이것은 첫 발견이 아니라는 것에 대한 부인까지 합해서 발표했다. "아이비 마이크" 사건은 미등록되고 1955년에서 IUPAC이 승인했다.
멘델레븀의 첫번째 동위원소는, 256Md이었다. (반감기: 87분)버클리 방사선 연구소에 있는 60-인치의 입자 가속기를 이용해서 알버트 기오르소, 글렌 T. 시보그, 그레고리 R. 쇼핀, 베르나르드 G. 하비 그리고 스탠리 G. 톰슨이 합성했다. 253Es에 알파 입자를 충돌시켜서 만들어졌다. 이것은 모든 원소 중 처음으로 합성 시 하나의 원자만 나온 합성 원소였다.
노벨륨의 동위 원소를 얻기 위해 스웨덴(1957)과 미국(1958) 팀 등에서 여러 시도를 했지만, 처음으로 노벨륨의 동위 원소를 만든 팀은 256No을 만든 소련 팀 (게오르기 플료로프 외.)이었다. 1965년에 만들어졌고, 1992년에 IUPAC에서 승인했다. 플료로프 외. 팀은 우라늄-238에 네온-22를 충돌시켜서 노벨륨 동위 원소를 만들었다.
1961년, 기오르소 외. 팀은 로렌슘의 첫 동위 원소를 만들어 냈다. 캘리포늄(캘리포늄-252로 추정)에 붕소-10 이온과 붕소-11 이온을 조사하여 만들어졌다. 동위 원소의 질량수는 현재로써는 확실하지 않다. (아마 258 또는 259로 추정) 1965년, 256Lr이 플료로프 외. 팀에서 합성되었다. 243Am과 18O를 이용하여 만든 것이었다. 그래서 IUPAC은 두브나 연구소와 버클리 연구소를 공동 발견자로 인정했다.
동위원소[편집]
2010년 기준, 31개의 악티늄 동위 원소와 8개의 들뜬 핵이성상태와 그것의 핵종이 인식되었다. 그중 3개의 동위원소, 225Ac, 227Ac, 그리고 228Ac는 자연에서 발견되었고 나머지는 인공 합성으로 만들어졌다. 3개의 자연적 동위원소만 적용에 사용할 수 있다. 악티늄-225는 방사성 넵투늄 족에 들어간다. 이것은 1947년에 U233이 붕괴할 때 첫 발견되었다. 이것은 반감기가 10일인 α-방사체였다. 악티늄-225는 악티늄-228보다 적은 양이지만, 방사성 트레이서 적용에 수요가 촉망된다. 악티늄-227 (반감기: 21.77년)은 모든 우라늄 광석에 존재하지만, 적은 양만 존재한다. 우라늄 광석 1그램은(방사성 평형일 때) 오직 2×10⁻¹⁰ 그램의 227Ac만 들어있다. 악티늄-228은 방사성 토륨 족에 들어간다. 228Ra의 붕괴에 의해 생성된다. 이것은 반감기가 6.15시간인 β− 방사체였다.1톤의 토륨에는 5×10⁻⁸그램의 228Ac이 들어있다. 이것은 1906년에 오토 한에 의해 발견되었다.
29개의 212부터 240까지 알려진 프로탁티늄 동위 원소는 3개의 핵이성상태가 존재한다. 오직 231Pa과 234Pa가 자연에서 발견되었다. 프로탁티늄-231을 제외한 모든 동위원소가 짧은 반감기를 가진다.(프로탁티늄-231은 반감기가 32,760년이다.) 가장 중요한 동위원소는 231Pa와 233Pa이다. 우라늄-233에 의한 결과물이고, 여기서 수많은 인공적 프로탁티늄이 많이 만들어졌다. 233Pa는 긴 반감기와 γ-선의 에너지를 일부 가지고 있고, 그래서 프로탁티늄의 화학적 성질 연구에 큰 영향을 끼쳤다. 프로탁티늄-233은 β-입자를 가지고 있으며, 반감기가 26.97일이다.
우라늄은 자연 동위 원소나 인공 동위 원소 둘 다 악티늄족에서 제일 많은 양을 가지고 있다.(합해서 25개(반감기로 추측되는 듯하다.)) 이것들은 질량이 217–242 사이에 있으며, 그 중 3개, 234U, 235U 그리고 238U는 현재도 존재하는 양이 자연에 매장되어 있다. 다른 것 사이에서, 가장 중요한 것은 233U이다. 느린 중성자를 조사(照射)한 232Th의 최종적인 결과이기 때문이다. 233U 낮은 에너지(열)의 중성자를 배출하고, 핵분열 효율이 매우 높으며 235U와 비교가 된다. 우라늄의 화학적 성질은 우라늄-238이 4.4×10⁹년이라는 매우 긴 반감기를 가지고 있다는 것이 밝혀졌기 때문에 모두 밝혀졌다 해도 과언이 아니다.
19개의 넵투늄 동위 원소는 질량수가 225부터 244까지이고, 모두 방사성이 강하다. 과학자들 사이에서 알려진 가장 긴 반감기를 가진 원소는 237Np이고, (t1/2 = 2.20×10⁶년) 가장 반감기가 짧은 원소는 239Np, 238Np이 알려져 있다. (t1/2 ~ 2일).
16개의 아메리슘 동위 원소의 잘량수는 232부터 248까지로 알려져 있다. 가장 중요한 것은 241Am과 243Am이다. 이것들은 알파 입자를 방사하는 데다 방사를 약하게 하지만, γ-선이 강하다; 이 2개는 순수한 동위 원소로 존재한다. 아메리슘의 화학적 성질은 241Am이었으나, 후에 243Am으로 변형되었다. 적은 양의 방사능을 가지고 약 20번의 변형을 하는 것이다.243Am의 단점은, 붕괴될 때 반감기가 짧은 239Np로 붕괴된다는 것과, 분석을 좀 더 해 보아야 한다는 것이다.
19개의 퀴륨 동위 원소 중, 가장 널리 알려진 것은 242Cm과 244Cm이다. α-입자를 방출하지만, 아메리슘 동위 원소보다 훨씬 짧은 반감기를 가지고 있다. 동위 원소들은 γ-선을 거의 방출하지 않지만, 자발 핵분열을 할 때 중성자를 배출한다. 퀴륨의 동위 원소 중 반감기가 긴 편에 속하는 것은245–248Cm이며, 모두 α-입자를 방출한다. 플루토늄이나 아메리슘에 중성자 조사(照射)를 하여 혼합물로 생성된다. 짧은 조사를 할 때, 이 혼합물은 퀴륨-246으로 변하고, 퀴륨-248이 축적되기 시작한다. 248Cm같은 동위 원소는, 더 긴 반감기를 가지고 있고, (3.48×10⁵년) 242Cm과 244Cm보다 화학적 연구에 큰 도움을 준다. 그러나 자발 핵분열의 확률도 더 커진다. 247Cm은 퀴륨의 동위 원소 중 가장 긴 반감기를 가지고 있지만, (1.56×10⁷년), 많은 양이 존재하지는 않는다. 왜냐하면 열중성자의 유도에 의해 자발 핵분열을 할 확률이 더 커지기 때문이다.
14개의 버클륨 동위 원소는 질량수가 238–252 사이로 밝혀졌다. 249Bk만 많은 양으로 존재할 수 있다. 각각 330의 짧은 반감기를 가지고 있고, 감지에 어렵지만 그나마 안정한 β-입자를 방출한다. 이것의 α-선은 β-선보다 약하지만, (1.45×10⁻³% β-선의 사항 포함)동위 원소를 찾는 데 이용되기도 한다. 1,380년의 긴 반감기를 가진 247Bk은 α-입자 방출을 한다. 그렇지만 많은 양을 생산하기는 힘들다. 이것은 플루토늄에 중성자 조사를 하지 않기 때문이다. 왜냐하면 동위 원소의 β-안정성은 질량수가 248 아래인 퀴륨 동위 원소로 만들어지기 때문이다.
질량수가 237부터 256까지인 캘리포늄 동위 원소는 핵 반응기에서 만들어진다. 캘리포늄-253은 β-방사를 하는 동위 원소이고 나머지는 α-방사를 하는 동위 원소이다. 질량수가 짝수인 동위 원소 (250Cf, 252Cf and 254Cf)는 자발 핵분열을 할 확률이 높다. 특히 254Cf는 자발 핵분열할 확률이 99.7%이다. 캘리포늄-249는 그나마 긴 반감기 (352년)을 가지고 있고, 낮은 자발 핵분열 확률과 강한 γ-방사를 하여 인식을 가능하게 한다. 249Cf는 핵 반응기에서 많이 만들어지지 않는다. 왜냐하면 붕괴되기 전 249Bk의 느린 β-붕괴와 중성자와 상호 작용을 할 때의 큰 단면적 때문에 만들기가 쉽지 않다. 그러나 249Bk의 β-붕괴의 산물로 인해 순수한 동위 원소로 축적된다. 캘리포늄은 플루토늄의 반응기 조사에 의해 만들어진다. 이것은 주로 250Cf과 252Cf가 존재하는데, 후에 큰 중성자의 영향으로 점점 뚜렷해지고, 이것의 특징은 강한 중성자선에 의해 반응이 저해된다.
| 붕괴 전 동위원소 |
t1/2 | 낭 동위원소 |
t1/2 | 방사성 평형까지 걸리는 시간 |
|---|---|---|---|---|
| 243Am | 7370년 | 239Np | 2.35일 | 47.3일 |
| 245Cm | 8265년 | 241Pu | 14년 | 129년 |
| 247Cm | 1.64×10⁷년 | 243Pu | 4.95시간 | 7.2일 |
| 254Es | 270일 | 250Bk | 3.2시간 | 35.2시간 |
| 255Es | 39.8일 | 255Fm | 22시간 | 5일 |
| 257Fm | 79일 | 253Cf | 17.6일 | 49일 |
16개로 알려진 질량수가 241부터 257 사이로 추정된 아인슈타이늄 동위 원소 중 가장 중요한 것은 241Am과 243Am이다. 이것들은 알파 입자를 방사하는 데다 방사를 약하게 하지만, γ-선이 강하다; 이 2개는 순수한 동위 원소로 존재한다. 아메리슘의 화학적 성질은 241Am이었으나, 후에 243Am으로 변형되었다. 적은 양의 방사능을 가지고 약 20번의 변형을 하는 것이다.243Am의 단점은, 붕괴될 때 반감기가 짧은 239Np로 붕괴된다는 것과, 분석을 좀 더 해 보아야 한다는 것이다.
19개의 페르뮴 동위 원소는 질량수가 242부터 260 사이로 알려져 있다. 254Fm, 255Fm 그리고 256Fm은 짧은 반감기(시간)를 가지고 있고, α-방사를 한다. 또한 많은 양이 분리될 수 있다. 257Fm은 (t1/2 = 100일)장기적이고 강력한 조사(照射)에서도 축적될 수 있다. 페르뮴 동위 원소는 큰 확률로 자발 핵분열을 한다.
15개로 알려진 멘델레븀 동위 원소 중(질량수는 245에서 260 사이), 가장 알려진 것은 256Md이다. 이것은 반감기가 77분이고, 주로 전자 포획을 통해서 붕괴한다. (α-선은 ≈10%) 또다른 알파 방사체는, 258Md인데, 53일의 반감기를 가지고 있다. 이 동위 원소들은 희귀한 아인슈타이늄(253Es과 255Es)에서 생성된다. 그러므로 생성에 한계가 존재한다.
그나마 긴 수명을 가진 노벨륨 동위 원소와 로렌슘 동위 원소(그리고 더 무거운 원소)는 상대적으로 짧은 반감기를 가지고 있다. 노벨륨은 11개의 동위 원소가 알려져 있으며, 이들의 질량수는 250~260 사이, 그리고 262이다. 노벨륨과 로렌슘의 화학적 성질은 255No(t1/2 = 3분)과 256Lr(t1/2 = 35초)으로 잘 알려져 있다. 노벨륨의 동위 원소 중 259No은 노벨륨의 동위 원소 중 가장 긴 1.5시간의 반감기를 가지고 있다.
자연에서의 분포[편집]

토륨과 우라늄은 자연에 가장 많은 악티늄족 원소다. 각 질량의 집중은 1.6×10⁻³%과 4×10⁻⁴%이다. 우라늄은 주로 지각에서 산화된 광물로 나온다. 잘 알려진 광석은 피치블렌드(우라니나이트)가 있다. 피치블렌드로 불리게 된 이유는 검은색이기 때문이다. 분류:우라늄 광물에서 더 많은 광석들을 볼 수 있다. 카르노타이트 (KUO2VO4·3H2O)나 인회우라늄광 (Ca(UO2)2(PO4)2·nH2O)도 있다. 천연 우라늄의 동위원소는 238U (비율: 99.2742%), 235U (0.7204%) 그리고 234U (0.0054%)이 있다. 238U 은 동위원소 중 가장 긴 4.51×10⁹년의 반감기를 가지고 있다. 전 세계적으로 우라늄을 가장 많이 생산하는 나라는 카자흐스탄이다. 2009년 기준으로 50,572 톤 (전 세계에서 약 27.3%)의 우라늄 광석을 채굴했다. 다른 중요 우라늄 채굴 도시는 캐나다 (20.1%), 호주 (15.7%), 나미비아 (9.1%), 러시아 (7.0%), 그리고 니제르 (6.4%)가 있다.
| 광석 | 생산지 | 우라늄의 함유량, % |
질량비 239Pu/광석 |
비율 239Pu/U (×10¹²}}) |
|---|---|---|---|---|
| 우라니나이트 | 캐나다 | 13.5 | 9.1×10⁻¹² | 7.1 |
| 우라니나이트 | 콩고 | 38 | 4.8×10⁻¹² | 12 |
| 우라니나이트 | 미국 콜로라도주 | 50 | 3.8×10⁻¹² | 7.7 |
| 모나자이트 | 브라질 | 0.24 | 2.1×10⁻¹⁴ | 8.3 |
| 모나자이트 | 미국 노스캐롤라이나주 | 1.64 | 5.95.9×10⁻¹⁴ | 3.6 |
| 페르구소사이트 | - | 0.25 | <1×10⁻¹⁴ | <4 |
| 카르노타이트 | - | 10 | <4×10⁻¹⁴ | <0.4 |
가장 많이 매장되어 있는 토륨 광물은 토리아나이트 (ThO2), 토라이트 (ThSiO4) 그리고 모나자이트가 있다. ((Th,Ca,Ce)PO4) 대부분의 토륨 광석은 우라늄도 포함하고 있고 우라늄 광석도 토륨과 함께 포함하고 있다. 그리고 란타넘족도 일부 포함하고 있다. 토륨 광석이 풍부하게 매장되어 있는 곳은 미국과(440,000톤), 호주, 인도,(각각 ~300,000톤) 캐나다가 있다(~100,000톤).
악티늄이 지각에 매장되어 있는 양은 5×10⁻¹⁵%밖에 되지 않는다. 악티늄은 주로 우라늄 광석에 들어있지만, 다른 광물에도 들어있다. 다만 양이 적을 뿐이다. 악티늄이 들어있는 자연적 광물 중 부모 동위 원소인 235U의 동위 원소 평형에서 주로 발견되고, 약한 Ac 이동에 영향을 받지 않는다. 프로탁티늄은 악티늄보다 비교적 많은 양이 지각에 매장되어 있다. (10−12%) 이것은 1913년에 우라늄 광석에서 파얀스와 괴링에 의해 발견되었다.악티늄과 같이, 프로탁티늄도 주로 235U에 분포해 있다.
넵투늄 중 반감기가 가장 긴 237Np은, 지각의 나이와 비교하면 무시해도 될 정도로 짧다. 그래서 넵투늄은 주로 다른 동위 원소의 붕괴의 중간 생성물로 만들어지지만, 그 양은 무시해도 될 정도로 적다. 1942년에 우라늄 광물에서 처음으로 자연적인 플루토늄을 찾아냈고, 합성으로는 239Pu이 처음 발견되어 주기율표에 요약해서 등록되어 있다 (플루토늄의 다른 어떤 동위 원소도 이 표본에서 가장 쉽게 채취할 수는 없다.). 플루토늄의 동위 원소 중 가장 오래 존재하는 동위 원소는, 244Pu이다. 확률은 3×10⁻²⁰%이다. 플루토늄은 달의 표본에서는 발견되지 않는다. 때문에 자연에서는 많이 존재하지 않고, 대부분의 플루토늄은 주로 합성으로 만들어진다.
추출[편집]

악티늄족의 매장량이 풍부하지 않기 때문에, 추출은 복잡하고 여러 과정을 거쳐서 얻을 수 있다. 악티늄족의 F-들이 주로 쓰이는데 그 이유는 물에 용해되지 않고 산화, 환원 반응에 의해 잘 분리되기 때문이다. F-은 칼슘, 마그네슘 또는 바륨에 의해 환원된다.
악티늄족 중, 토륨과 우라늄은 가장 추출하기 쉬운 원소이다. 토륨은 주로 모나자이트에서 채취된다. 이인산토륨 (Th(PO4)2) 은 질산과 반응하고, 생성된 질산토륨은 인산트리부틸과 비슷하게 취급받는다. 희토류 원소의 불순물은 황산염을 이용해 pH를 더 높여서(염기성을 높여서) 분리할 수 있다.
또 다른 추출 방법으로는, 온도가 140°C일 때 농도가 45%인 수산화나트륨 용액에서 분해된다. 금속 수산화물이 먼저 추출되며, 80°C에서 걸러진다. 물에 씻겨지고 농축된 염산에 담그면 용해된다. 다음으로, 산성 용액은 수산화물과 만나면 중화되는데, (pH = 5.8) 이 결과물이 수산화토륨 침전물이다. (Th(OH)4) 이 물질은 ~3%의 수산화물 희토류와 섞여 있다. 대부분의 수산화물 희토류는 용액에 남아있다. 수산화토륨은 무기물 산에 용해되고 이 과정에서 희토류 원소와 분리된다. 효율적인 방법은 수산화토륨을 질산에 담가 용해시키는 방법이다. 왜냐하면 결과로 나온 수용액이 유기용제와 추출을 이용해서 정제할 수 있기 때문이다.
Th(OH)4 + 4 HNO3 → Th(NO3)4 + 4 H2O
금속 토륨은 무수 산화물에서 분리되며, 염화물 또는 플루오린화물은 비활성 기체 속에서 칼슘에 반응한다.
ThO2 + 2 Ca → 2 CaO + Th
가끔 토륨은 전기분해로 추출될 때가 있는데, 그 방법은 염화나트륨과 염화칼슘, 그리고 플루오린화토륨을 넣고 700–800°C의 온도인 흑연 도가니에서 전기분해하면 추출되기도 한다. 매우 순수한 토륨은 아이오딘화토륨에서 결정바 공정을 이용해서 추출할 수 있다.
우라늄은 우라늄 광석에서 여러 가지 방법으로 추출할 수 있는데, 그 중 한가지 방법은 광석을 용해시키고 용해가 된 광석을 질산과 반응시켜 우라늄을 획득하는 것이다. 등유같은 유기적 물질로 모습이 변할 때는 인산트리부틸(TBP)으로 처리한다. (UO2(NO3)2(TBP)2) 여기에 NH4나 (2U2O7) 과산화수소와 반응시키면 (UO4·2H2O) 용해되지 않은 불순물들이 걸러지고 우라늄이 추출된다.
여러 원소를 포함하고 있는 돌로마이트나 마그네사이트 등의 우라늄 광석일 경우, 산성 물질을 더 많이 필요로 한다. 이 경우에는, 탄산염을 이용한 방법이 우라늄 추출에 주로 쓰인다. 이 방법의 가장 중요한 요소는 탄산나트륨의 수용액인데, 이것은 우라늄을 복합적인 [UO2(CO3)3]4−로 전환시킨다. 이것은 수산화 이온이 적은 수용액 중 안정적인 수용액에 속한다. 탄산나트륨을 이용한 방법의 장점은 화합물의 부식성이 낮고(질산염과 비교했을 때) 가장 좋은 점인 수용액에서 우라늄이 아닌 광석을 침전시킨다는 것이다. 단점은 4가의 우라늄 화합물이 침전이 잘 된다는 것이다. 그러므로, 우라늄 광석은 높은 온도와 낮은 산소 압력일 때에는 탄산나트륨으로 처리하는 것이 효과적이다.
- 2 UO2 + O2 + 6 CO ²⁻₃→ 2 [UO2(CO3)3]4−
이 화학식은 용해 방법 중 가장 좋은 방법인 탄산우라늄 공정 과정에서 탄산염과 중탄산염의 혼합물을 넣는 이유를 설명한다. pH가 높을 때에는, 중우라늄산염의 침전물이 나타난다. 이것은 니켈이 들어있는 물에 녹지 않는 사우라늄산염의 탄성 한도를 이용하여 수소로 처리할 수 있다.(마지막 문장 오역 가능성 있음)
또 다른 분리 방법은 고분자전해질의 고분자 수지를 사용하는 것이다. 합성 수지에서의 이온 교환 과정이 우라늄을 분리하는 것이다. 합성 수지에서의 우라늄은 질산암모늄이나 질산 용액으로 (질산우라닐을 획득하고) 정제할 수 있다. (UO2(NO3)2·6H2O) UO2과 수소가 함께 존재한 채로 가열되었을 때, UO3으로 바뀐다.
- UO3 + H2 → UO2 + H2O
마그네슘 금속과 우라늄 금속의 반응 후 수득률에 의거할 때, 플루오린산과 이산화우라늄이 만났을 때 반응하여 사플루오린화우라늄이 만들어진다.
- 4 HF + UO2 → UF4 + 2 H2O
플루토늄을 추출할 때는, 중성자를 조사한 우라늄을 질산에 용해시키고, 시제(試劑)(FeSO4이나, H2O2)를 소모하여 결과적으로 나오는 용액을 증가시킨다. 우라늄이 질산우라닐의 형태로 남아있을 때에는, 플루토늄의 산화 상태를 +6부터 +4까지 바꾼다(UO2(NO3)2). 용액은 시제를 소모하고 난 후 탄산암모늄으로 pH 8까지 중화시켜서 Pu4+ 화합물의 침전물을 생성할 수 있다.
또 다른 방법으로는, Pu4+과 UO₂²⁺는 인산트리부틸로 추출할 수 있으며, 추출한 후 하이드라진과 반응시켜서 정제된 플루토늄을 얻을 수 있다.
악티늄의 분리 방법 중 가장 많이 쓰이고 있는 분리 방법은 악티늄과 성질이 비슷한 란타넘과 비슷한 방법으로 분리한다. 또한 악티늄은 라듐 동위 원소와 핵반응을 일으켜 합성을 하거나 이온 교환 과정을 거쳐서 분리할 수도 있다.
성질[편집]
악티늄족은 란타넘족과 비슷한 성질을 갖고 있다. 6d와 7s 전자껍질은 악티늄과 토륨이 존재하고, 5f 껍질은 악티늄과 토륨보다 더 큰 수의 악티늄족에 존재한다. 4f 껍질은 란타넘족에 존재한다. 악티늄족이 5f전자라는 것을 이용한 첫 실험이 1940년 맥밀런과 아벨슨이 한 실험이다. 란타넘족과 악티늄족의 이온 반지름이 원자 번호와 함께 지속적으로 감소한다.
| 성질 | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 핵 충전 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| 원자량 | [227] | 232.0377(4) | 231.03588(2) | 238.02891(3) | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [266] |
| 자연적 동위원소의 수 | 3 | 7 | 3 | 8 | 3 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 자연적 동위원소 | 225, 227–228 | 227–232, 234 | 231, 233–234 | 233–240 | 237, 239–240 | 238–240, 244 | — | — | — | — | — | — | — | — | — |
| 가장 반감기가 긴 동위원소 | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 266 |
| 가장 반감기가 긴 동위원소의 반감기 | 21.8년 | 140억 년 | 32,500년 | 44.7억 년 | 214만 년 | 8080만 년 | 7,370년 | 1560만 년 | 1,400년 | 900년 | 1.29년 | 100.5일 | 52일 | 58분 | 11시간 |
| 바닥 상태일 때의 전자 배치 | 6d17s2 | 6d27s2 | 5f26d17s2또는 5f16d27s2 | 5f36d17s2 | 5f46d17s2또는 5f57s2 | 5f67s2 | 5f77s2 | 5f76d17s2 | 5f97s2또는 5f86d17s2 | 5f107s2 | 5f117s2 | 5f127s2 | 5f137s2 | 5f147s2 | 5f147s27p1 |
| 산화 상태 | 2, 3 | 2, 3, 4 | 2, 3, 4, 5 | 2, 3, 4, 5, 6 | 3, 4, 5, 6, 7 | 3, 4, 5, 6, 7, 8 | 2, 3, 4, 5, 6, 7 | 2, 3, 4, 6, 8 | 2, 3, 4 | 2, 3, 4 | 2, 3, 4 | 2, 3 | 2, 3 | 2, 3 | 3 |
| 금속 결합 반지름 (단위: nm) | 0.203 | 0.180 | 0.162 | 0.153 | 0.150 | 0.162 | 0.173 | 0.174 | 0.170 | 0.186 | 0.186 | ? 0.198 | ? 0.194 | ? 0.197 | ? 0.171 |
| 이온 결합 반지름 (단위: nm): An4+ An3+ |
— 0.126 |
0.114 — |
0.104 0.118 |
0.103 0.118 |
0.101 0.116 |
0.100 0.115 |
0.099 0.114 |
0.099 0.112 |
0.097 0.110 |
0.096 0.109 |
0.085 0.098 |
0.084 0.091 |
0.084 0.090 |
0.084 0.095 |
0.083 0.088 |
| 온도 (단위: °C): 녹는 점 끓는 점 |
1050 3198 |
1842 4788 |
1568 ? 4027 |
1132.2 4131 |
639 ? 4174 |
639.4 3228 |
1176 ? 2607 |
1340 3110 |
986 2627 |
900 ? 1470 |
860 ? 996 |
1530 — |
830 — |
830 — |
1630 — |
| 밀도 (단위: g/cm3) | 10.07 | 11.78 | 15.37 | 19.06 | 20.45 | 19.84 | 11.7 | 13.51 | 14.78 | 15.1 | 8.84 | 9.7 | 10.3 | 9.9 | |
| 평균 전극 전위 (단위: 볼트): E° (An4+/An0) E° (An3+/An0) |
— −2.13 |
−1.83 — |
−1.47 — |
−1.38 −1.66 |
−1.30 −1.79 |
−1.25 −2.00 |
−0.90 −2.07 |
−0.75 −2.06 |
−0.55 −1.96 |
−0.59 −1.97 |
−0.36 −1.98 |
−0.29 −1.96 |
— −1.74 |
— −1.20 |
— −2.10 |
| 색 [M(H2O)n]4+ [M(H2O)n]3+ |
— 무색 |
무색 청색 |
황색 어두운 청색 |
녹색 보라색 |
연두색 보라색 |
갈색 자주색 |
홍색 장미색 |
황색 무색 |
베이지색 연두색 |
녹색 녹색 |
— 분홍색 |
— — |
— — |
— — |
— — |
| 악티늄족 (Z) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 산화수 | |||||||||||||||
| +2 | Fm2+ | Md2+ | No2+ | ||||||||||||
| +3 | Ac3+ | Th3+ | Pa3+ | U3+ | Np3+ | Pu3+ | Am3+ | Cm3+ | Bk3+ | Cf3+ | Es3+ | Fm3+ | Md3+ | No3+ | Lr3+ |
| +4 | Th4+ | Pa4+ | U4+ | Np4+ | Pu4+ | Am4+ | Cm4+ | Bk4+ | Cf4+ | ||||||
| +5 | PaO₂⁺ | UOO⁺₂ | NpO⁺₂ | PuO⁺₂ | AmO⁺₂ | ||||||||||
| +6 | UO²⁺₂ | NpO²⁺₂ | PuO²⁺₂ | AmO²⁺₂ | |||||||||||
| +7 | NpO³⁺₂ | PuO³⁺₂ | AmO³⁻₅ |
물리적 성질[편집]
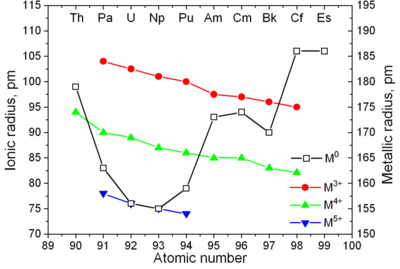
|
| 악티늄족의 금속 결합과 이온 반지름 |
악티늄족은 전형적인 금속이다. 모든 광물이 부드럽고 은빛을 띈다.(그러나 공기 중에서는 변색된다) 각각 큰 밀도와 가소성이 존재한다. 일부는 칼로 자를 수도 있다. 비저항은 15에서 150 사이의 µOhm·cm이다. 토륨의 경도는 마치 부드러운 강철과 비슷하다. 강하게 가열된 순수한 토륨은 종이처럼 굴릴 수 있거나 철사로 만들 수도 있다. 토륨은 밀도가 우라늄과 플루토늄의 절반 정도 된다. 그러나 우라늄과 플루토늄보다 단단하다. 모든 악티늄족은 방사성 원소이며, 상자성을 띄고, 이례적인 경우에는, 여러 결정질 상을 가지고 있다. 플루토늄은 7개, 그리고 우라늄, 넵투늄 그리고 캘리포늄은 3개이다. 프로탁티늄, 우라늄, 넵투늄, 그리고 플루토늄의 결정 구조는 란타넘족과 비슷하게 깨끗하지 않은 상사형이고 3d의 형태를 가지고 있어 전이 금속과 비슷하다.
모든 악티늄족은 자연 발화하며(특히 완전히 분열되었을 때), 공기와 접촉할 시 자연적으로 불이 붙는다. 악티늄족의 녹는점은 f-전자의 숫자의 상관성이 잘 보이지 않는다. 드물게 낮은 녹는점을 가진 넵투늄과 플루토늄은 (~640 °C) 5f와 6d의 궤도 함수와 방향성 결합의 위치에 의한 혼성(混成)에 의해 낮은 녹는점이 나온다고 설명되었다.
| 란타넘족 | Ln3+, Å | 악티늄족 | An3+, Å | An4+, Å |
|---|---|---|---|---|
| 란타넘 | 1.061 | 악티늄 | 1.11 | – |
| 세륨 | 1.034 | 토륨 | 1.08 | 0.99 |
| 프라세오디뮴 | 1.013 | 프로탁티늄 | 1.05 | 0.93 |
| 네오디뮴 | 0.995 | 우라늄 | 1.03 | 0.93 |
| 프로메튬 | 0.979 | 넵투늄 | 1.01 | 0.92 |
| 사마륨 | 0.964 | 플루토늄 | 1.00 | 0.90 |
| 유로퓸 | 0.950 | 아메리슘 | 0.99 | 0.89 |
| 가돌리늄 | 0.938 | 퀴륨 | 0.98 | 0.88 |
| 터븀 | 0.923 | 버클륨 | – | – |
| 디스프로슘 | 0.908 | 캘리포늄 | – | – |
| 홀뮴 | 0.894 | 아인슈타이늄 | – | – |
| 어븀 | 0.881 | 페르뮴 | – | – |
| 툴륨 | 0.869 | 멘델레븀 | – | – |
| 이터븀 | 0.858 | 노벨륨 | – | – |
| 루테튬 | 0.848 | 로렌슘 | – | – |
화학적 성질[편집]
란타넘족과 같이, 모든 악티늄족은 할로겐과 칼코겐에 큰 화학적 반응을 보인다. 그러나, 악티늄족이 좀 더 강하게 나타난다. 악티늄족은 적은 수의 5f-전자껍질을 가진 족으로, 혼성되기 쉽다. 이것은 7s, 6d 전자껍질과, 5f의 전자 에너지와 유사성을 가지고 있는 것을 설명하는 것이다. 대부분의 악티늄족들이 원자가 형태에서 더 큰 다양성을 보인다. 그리고 그 중 가장 안정한 것은, 우라늄 +6가, 프로탁티늄과 넵투늄 +5가, 토륨과 플루토늄 +4가, 그리고 악티늄 외의 원소 +3가가 있다.
화학적으로, 악티늄은 란타넘과 비슷한 성질을 띈다. 이것은 비슷한 크기의 이온 반지름과 전자 구조로 알 수 있다. 란타넘과 같이, 악티늄도 +3까지의 산화 상태를 가지고 있다. 그러나 악티늄은 반응이 덜하고 더욱 확연한 염기성을 가지고 있다. 악티늄족의 3+ 산화 상태 중 가장 산성이 적은 것은 Ac3+이다. 가수분해가 약한 성질을 가지고 있다.
토륨은 화학적으로 볼 때 더욱 반응적이다. 그로 인해 6d와 5f 껍질에서의 전자가 부족한 편이며, 4+ 이상의 토륨 화합물은 무색을 띈다. pH가 3보다 낮을 때, 염기성 토륨 용액은 양이온의 성질이 가장 크게 나타난다([Th(H2O)8]4+). Th4+ 이온은 비교적 큰 편이며, 배위수에 따라 0.95부터 1.14 Å 사이의 반지름을 가진다. 결과적으로, 염기성 토륨은 약한 가수분해 성질을 가지고 있다. 염기성 토륨의 독특한 성질은 물 뿐만이 아닌 액체에서의 가용성이 크다는 것이지만, 유기적 극성 용액의 성질도 가진다.
프로트악티늄은 2+ 이상의 성질을 보인다. +5 화합물이 가장 안정적이며, 프로트악티늄(V)의 +4 화합물은 쉽게 산화된다. 그러므로 용액에서의 +4 프로트악티늄은 수소 대기에서 강한 환원제에 의해 얻을 수 있다. +4 프로트악티늄은 화학적으로 우라늄(IV)과 토륨(IV)과 비슷한 성질을 가진다. 프로트악티늄(IV)의 플루오린산염, 인산염, 차인산염, 아이오딘산염 그리고 페닐아르손산염은 불용성이고 산을 중화시킨다. 프로트악티늄은 가용성이 있는 탄산염의 형태로 변한다. 5+의 성질을 가지고 있는 프로트악티늄의 가수분해성 성질은 탄탈럼(V)과 나이오븀(V)과 비슷하다. 프로트악티늄의 복합적 성질은 프로트악티늄의 5f 껍질을 채우는 결과가 나온다.
우라늄은 3+에서 6+까지의 성질을 보인다. 이 중에서는 6+이 제일 안정하다. 6+의 상태에서, 우라늄은 6족 원소와 비슷한 성질을 가진다. 많은 양의 우라늄(IV)과 우라늄(VI)의 화합물은 비화학적 화합물이다. 특징 중 하나는, 다양한 구조를 가지고 있다. 예시로, 사실상으로 이산화우라늄의 화학식은 UO2+x이다. 상황에 따라 'x'가 −0.4와 0.32로 달라진다. 우라늄(VI) 화합물은 약한 산화제의 반응을 가진다. 대부분의 화합물은 선형 우라닐족을 포함하고 있다. (UO₂²⁺). 4에서 6 사이의 리간드는 우라닐족을 수직 적도면에 수용할 수 있다. 우라닐족은 산소-전자 주개와 질소-전자 주개와 함께 굳은 산의 역할을 하며 강하고 복합적인 모습을 한다. NpO₂²⁺과 PuO₂²⁺ 역시 넵투늄과 플루토늄의 6+ 상태이다. 우라늄(IV) 화합물은 환원적인 성질을 보이며, 특징 중 하나는, 대기 중의 산소에 의해 잘 산화된다는 것이다. 우라늄(III)은 매우 강한 환원물이다. 그래서 d-껍질로 존재하고, 우라늄 (또한 많은 악티늄족)은 유기 금속 화합물이다. 대표적으로 UIII(C5H5)3과 UIV(C5H5)4이 존재한다.
넵투늄은 3+에서 7+의 성질을 보인다. 이것은 동시에 용액에서 관찰할 수 있다. 용액에서 가장 안정한 성질은 +5이다. 하지만 고체 넵투늄 화합물에서는 +4 성질이 가장 안정하다. 넵투늄 금속은 매우 반응이 크다. 넵투늄의 이온은 가수분해하기 쉽고 배위 화합물을 형성한다.
플루토늄 역시 원자가에서 3+에서 7+ 상태가 존재하며, 그러므로 우라늄과 넵투늄과 화학적으로 비슷한 성질을 띄고 있다. 이것은 매우 반응적이며, 대기에서 산화 피막을 만든다. 플루토늄은 25–50°C까지 떨어진 온도에서 수소와 반응한다. 또한 이것은 할로겐화물과 금속간화합물의 형태도 띈다. 다른 산화 상태의 플루토늄 이온의 가수분해 반응은 상당히 다양하다. 플루토늄(V)은 중합 반응을 일으킬 수 있다.
악티늄족의 화합물 중 가장 다양한 것은 아메리슘이다. 이것은 2+에서 6+까지의 성질을 가진다. 2+의 아메리슘은 오직 건조한 화합물과 비수용액에서 얻을 수 있다.(아세토나이트릴) 산화 상태가 +3, +5 그리고 +6인 것은 전형적인 수용액에서 발견되지만, 고체 상태에도 들어있다. 4+의 아메리슘은 복합적인 수용액 또는 안정적인 고체 화합물의 형태를 가진다 (이산화, 플루오린화 그리고 수산화). 알칼리성 아메리슘은 6+의 산화 상태로 산화할 수 있다고 보고되었지만, 이 자료들은 잘못되었다고 입증되었다. 수용액에서의 아메리슘의 가장 안전한 원자가는 3+이고, 고체 화합물에서는 3+ 또는 4+이다.
로렌슘까지의 원소 (예외적으로 노벨륨)는 3+이 가장 안정하다. 퀴륨은 고체 화합물로 4+가 가능하고(플루오린화, 이산화), 버클륨은, 3+의 성질을 따라가지만, 4+의 성질도 보인다. 3+의 성질이 안정하지만, 고체 플루오린화물, 고체 이산화물에서는 4+의 성질도 보인다. 수용액에서의 Bk4+의 안정성은 Ce4+의 성질과 비슷하다. 캘리포늄, 아인슈타이늄, 페르뮴에서는 오직 3+의 성질만 발견되었다. 2+의 성질은 멘델레븀과 노벨륨에서 발견되었으며, 노벨륨은 2+의 성질이 3+의 성질보다 더 안정하다는 것이 입증되었다. 로렌슘에서는 수용액, 고체 화합물 둘 다 3+의 성질이 가장 안정하다는 것을 보여주었다.
우라늄부터 아메리슘까지의 An4+ 이온의 환원 능력을 더 늘리기 위해 쓰이는 산화 환원 전위는 () 우라늄에서는 -0.32 V부터 0.34 V(넵투늄) 그리고 1.04 V (플루토늄)을 거쳐 1.34 V (아메리슘)까지 늘어난다. 모든 악티늄족 이온은 검은색의 염기성을 띄는 AnH3 수소화물의 형태이다. 또한 악티늄족은 탄화물도 만들어낸다. 탄화물을 만들어내는 일반적인 방식은 AnC 또는 AnC2 (우라늄일때는 U2C3)이 가능하다. 황화물 역시 An2S3과 AnS2로 만들어낼 수 있다.
화합물[편집]
산화물과 수산화물[편집]
| 화합물 | 색 | 결정 균형, 구조 | 격자 상수, Å | 밀도, g/cm3 | 온도, °C | ||
|---|---|---|---|---|---|---|---|
| a | b | c | |||||
| Ac2O3 | 백색 | 육방정계, La2O3 | 4.07 | - | 6.29 | 9.19 | – |
| PaO2 | - | 입방정계, CaF2 | 5.505 | - | - | - | - |
| Pa2O5 | 백색 | 입방정계, CaF2 입방정계 정방정계 육방정계 능면체 사방정계 |
5.446 10.891 5.429 3.817 5.425 6.92 |
- - - - - 4.02 |
- 10.992 5.503 13.22 - 4. 18 |
- | 700 700–1100 1000 1000–1200 1240–1400 – |
| ThO2 | 무색 | 입방정계 | 5.59 | - | - | 9.87 | – |
| UO2 | 흑색-갈색 | 입방정계 | 5.47 | - | - | 10.9 | – |
| NpO2 | 녹갈색 | 입방정떨지말 | 5.424 | - | - | 11.1 | – |
| PuO | 흑색 | 입방정계, NaCl | 4.96 | - | - | 13.9 | – |
| PuO2 | 올리브색 | 입방정계 | 5.39 | - | - | 11.44 | – |
| Am2O3 | 적갈색 적갈색 |
입방정계, Mn2O3 육방정계, La2O3 |
11.03 3.817 |
- | - 5.971 |
10.57 11.7 |
– |
| AmO2 | 흑색 | 입방정계, CaF2 | 5.376 | - | - | - | - |
| Cm2O3 | 백색 - - |
입방정계, Mn2O2 육방정계, LaCl3 단사정계, Sm2O3 |
11.01 3.80 14.28 |
- - 3.65 |
- 6 8.9 |
11.7 | – |
| CmO2 | 흑색 | 입방정계, CaF2 | 5.37 | - | - | - | - |
| Bk2O3 | 밝은 갈색 | 입방정계, Mn2O3 | 10.886 | - | - | - | - |
| BkO2 | 적갈색 | 입방정계, CaF2 | 5.33 | - | - | - | - |
| Cf2O3 | 무색 노르스름한 색 - |
입방정계, Mn2O3 단사정계, Sm2O3 육방정계, La2O3 |
10.79 14.12 3.72 |
- 3.59 - |
- 8.80 5.96 |
- | - |
| CfO2 | 흑색 | 입방정계 | 5.31 | - | - | - | - |
| Es2O3 | - | 입방정계, Mn2O3 단사정계 육방정계, La2O3 |
10.07 14.1 3.7 |
- 3.59 - |
- 8.80 6 |
- | - |
| 산화 형태 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| +3 | Pu2O3 | Am2O3 | Cm2O3 | Bk2O3 | Cf2O3 | Es2O3 | |||||
| +4 | ThO2 | PaO2 | UO2 | NpO2 | PuO2 | AmO2 | CmO2 | BkO2 | CfO2 | ||
| +5 | Pa2O5 | U2O5 | Np2O5 | ||||||||
| +6 | U3O8 | ||||||||||
| UO3 |
| 화학식 | ThO2 | PaO2 | UO2 | NpO2 | PuO2 | AmO2 | CmO2 | BkO2 | CfO2 |
| CAS 등록번호 | 1314-20-1 | 12036-03-2 | 1344-57-6 | 12035-79-9 | 12059-95-9 | 12005-67-3 | 12016-67-0 | 12010-84-3 | 12015-10-0 |
| 몰 질량 | 264.04 | 263.035 | 270.03 | 269.047 | 276.063 | 275.06 | 270–284** | 279.069 | 283.078 |
| 녹는점 | 3390 °C | 2865 °C | 2547 °C | 2400 °C | 2175 °C | ||||
| 결정 구조 | 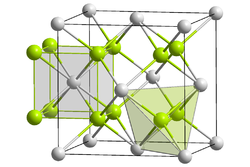 An4+: __ / O2−: __ | ||||||||
| 공간군 | Fm3‾m | ||||||||
| 배위수 | An[8], O[4] | ||||||||
- An – 악티늄족
**동위원소에 따라서 결정된다.
어떤 악티늄족들은 An2O3, AnO2, An2O5 and AnO3처럼 산화 형태로 존재할 수 있다. 모든 악티늄족, 그리고 악티늄족의 산화물(AnO3)은 양쪽성을 가지고 있고, An2O3, AnO2 그리고 An2O5는 염기성을 나타낸다. 염기성을 나타내는 악티늄족의 산화물은 물에 큰 반응을 한다.
- An2O3 + 3 H2O → 2 An(OH)3
이 염기성 물질은 물속에서 잘 녹지 않고, 이 물질들의 활동은 희토류 원소의 수산화물과 비슷하다. 가장 강한 염기성을 나타내는 화합물의 원소는 악티늄이다. 악티늄의 모든 화합물의 색은 무색이지만, 황화 악티늄은 검은색으로 예외다 (Ac2S3). 4+ 이산화 악티늄족의 결정 형태는 입방정계이며, 플루오린화 칼슘과 같다.
토륨이 산화할 때는 오직 이산화 형태로만 산화가 가능하다.
이산화토륨은 산화된 화합물 중에서 가장 높은 녹는점을 가진 내화 금속이다(3390 °C). 텅스텐에 0.8–1%의 ThO2을 넣으면 텅스텐의 구조가 안정되며, 그로 인해 필라멘트의 역학적 안정성이 더 나아져 진동에도 더 잘 버틸 수 있게 된다. ThO2를 산성 물질로 용해시킬 때, 온도가 500–600 °C까지 올라간다. 600 °C 이상까지 가열하면 ThO2의 다른 형태를 생산하는데, 이것은 산성 물질에 매우 큰 저항을 일으킨다. 소량의 플루오린화 이온은 촉매 작용을 하여 이산화토륨이 산성 물질에 용해되게 한다.
프로트악티늄의 산화물은 2개가 발견되었다(PaO2 (흑색) 그리고 Pa2O5 (백색)). 전자는 ThO2와 동형이며, 후자는 획득하기 쉽다. 전자와 후자 모두 염기성이며, Pa(OH)5는 약한 가용성을 가진 염기물이다.
우라늄을 특정 염기물로 분해할 때(예시로 UO2(NO3)·6H2O로 공기 중에서 400 °C로 분해하였을 때), 주황색이나 황색인 UO3을 만든다. 이 산화물은 양쪽성을 가지고 있고 여러 수산화물의 형태를 하고 있으며, UO2(OH)2형태일 때 가장 안정하다. 우라늄(VI) 산화물과 수소의 반응은 이산화우라늄을 만들고, 이것은 ThO2와 성질이 비슷하다. 이 산화물은 또한 염기성 물질이고 수산화우라늄(U(OH)4)과 일치한다.
플루토늄, 넵투늄, 아메리슘은 각각 두 개의 염기성 산화물의 형태로 변한다. (An2O3와 AnO2). 삼산화넵투늄은 불안정하다. 그러므로, 현재로써는 오직 Np3O8만 획득할 수 있는 것이다. 그러나, 화학식이 AnO2와 An2O3인 넵투늄과 플루토늄의 산화물은 특징이 잘 나타난다.
염기 화합물[편집]
| 화학식 | AcCl3 | UCl3 | NpCl3 | PuCl3 | AmCl3 | CmCl3 | BkCl3 | CfCl3 |
| CAS 등록번호 | 22986-54-5 | 10025-93-1 | 20737-06-8 | 13569-62-5 | 13464-46-5 | 13537-20-7 | 13536-46-4 | 13536-90-8 |
| 원자량 | 333.386 | 344.387 | 343.406 | 350.32 | 349.42 | 344–358** | 353.428 | 357.438 |
| 녹는점 | 837 °C | 800 °C | 767 °C | 715 °C | 695 °C | 603 °C | 545 °C | |
| 끓는점 | 1657 °C | 1767 °C | 850 °C | |||||
| 결정 구조 | 삼염화우라늄의 결정 구조 An3+: __ / Cl−: __ | |||||||
| 공간군 | P63/m | |||||||
| 배위수 | An*[9], Cl [3] | |||||||
| 격자 상수 | a = 762 pm c = 455 pm |
a = 745.2 pm c = 432.8 pm |
a = 739.4 pm c = 424.3 pm |
a = 738.2 pm c = 421.4 pm |
a = 726 pm c = 414 pm |
a = 738.2 pm c = 412.7 pm |
a = 738 pm c = 409 pm | |
- *An – 악티늄족
**동위원소에 따라서 표기함.
| 화합물 | 색 | 결정 균형, 종류 | 격자상수, Å | 밀도, g/cm3 | ||
|---|---|---|---|---|---|---|
| a | b | c | ||||
| AcF3 | 백색 | 육방정계, LaF3 | 4.27 | - | 7.53 | 7.88 |
| PaF4 | 고동색 | 단사정계 | 12.7 | 10.7 | 8.42 | – |
| PaF5 | 흑색 | 정방정계, β-UF5 | 11.53 | - | 5.19 | – |
| ThF4 | 무색 | 단사정계 | 13 | 10.99 | 8.58 | 5.71 |
| UF3 | 붉은 보라색 | 육방정계 | 7.18 | - | 7.34 | 8.54 |
| UF4 | 녹색 | 단사정계 | 11.27 | 10.75 | 8.40 | 6.72 |
| α-UF5 | 푸르스름한 색 | 정방정계 | 6.52 | - | 4.47 | 5.81 |
| β-UF5 | 푸르스름한 색 | 정방정계 | 11.47 | - | 5.20 | 6.45 |
| UF6 | 노르스름한 색 | 사방정계 | 9.92 | 8.95 | 5.19 | 5.06 |
| NpF3 | 흑색 아니면 보라색 | 육방정계 | 7.129 | - | 7.288 | 9.12 |
| NpF4 | 밝은 녹색 | 단사정계 | 12.67 | 10.62 | 8.41 | 6.8 |
| NpF6 | 주황색 | 사방정계 | 9.91 | 8.97 | 5.21 | 5 |
| PuF3 | 자주-파란색 | 삼방정계 | 7.09 | - | 7.25 | 9.32 |
| PuF4 | 담갈색 | 단사정계 | 12.59 | 10.57 | 8.28 | 6.96 |
| PuF6 | 홍색-갈색 | 사방정계 | 9.95 | 9.02 | 3.26 | 4.86 |
| AmF3 | 분홍 아니면 밝은 베이지색 | 육방정계, LaF3 | 7.04 | - | 7.255 | 9.53 |
| AmF4 | 주황-홍색 | 단사정계 | 12.53 | 10.51 | 8.20 | – |
| CmF3 | 갈색에서 백색 | 육방정계 | 4.041 | - | 7.179 | 9.7 |
| CmF4 | 황색 | 단사정계, UF4 | 12.51 | 10.51 | 8.20 | – |
| BkF3 | 연두색 | 삼방정계, LaF3 사방정계, YF3 |
6.97 6.7 |
- 7.09 |
7.14 4.41 |
10.15 9.7 |
| BkF4 | - | 단사정계, UF4 | 12.47 | 10.58 | 8.17 | – |
| CfF3 | - - |
삼방정계, LaF3 사방정계, YF3 |
6. 94 6.65 |
- 7.04 |
7.10 4.39 |
– |
| CfF4 | - - |
단사정계, UF4 단사정계, UF4 |
1.242 1.233 |
1.047 1.040 |
8.126 8.113 |
– |
악티늄족은 염과 할로겐과 큰 반응을 일으킨다. 공식은 MX3과 MX4 (X = 할로겐)이다. 첫 버클륨 화합물은, BkCl3이다. 이 물질은 1962년에 3나노그램 정도 합성되었다. 희토류 원소의 할로겐 화합물 같은 것으로는, 악티늄족 염화물, 브로민화물, 그리고 아이오딘화물은 수용성이고, 플루오린화물은 비수용성이다. 우라늄은 주로 육플루오린화를 하는데, 56.5 °C가 되면 승화를 한다. 이 물질의 휘발성은, 기체 원심 분리기 또는 가스확산법으로 우라늄 동위원소로 분리할 수 있다. 육플루오린화 악티늄족은 무수물의 성질을 가지고 있다. 그것들은 수분에 매우 민감하며 가수분해를 한다.(AnO2F2) 오염화우라늄과 흑색 육염화우라늄은 인공 합성했지만, 둘 다 불안정하다.
산성에서의 악티늄족은 염을 생성하고, 만약 산성 물질이 산화되지 않는다면 악티늄족 염은 낮은 원자가 상태를 가진다:
- U + 2 H2SO4 → U (SO4)2 + 2 H2
- 2 Pu + 6 HCl → 2 PuCl3 + 3 H2
그러나, 이 반응에서는 무한한 수소가 있으면 금속에 반응을 하고 수소화물의 형태를 하게 된다. 우라늄은 토륨보다 산과 물에 더 잘 반응한다.
악티늄족 염은 수산화물을 산으로 용해하는 과정에서도 얻을 수 있다. 악티늄족의 질산염, 염화물, 황산염 그리고 과염소산염은 가용성이 있다. 수용액에서 결정을 만들 때, 악티늄족 염은 수소화물의 형태를 한다(Th(NO3)4·6H2O Th(SO4)2·9H2O 그리고 Pu2(SO4)3·7H2O). 높은 원자가를 지닌 악티늄족 염들은 쉽게 가수분해된다. 그래서, 토륨의 무색 황산염, 염화물, 과염소산염 그리고 질산염은 Th(OH)2SO4 and Th(OH)3NO3의 화학식을 가진 염기성 염으로 형태를 바꾼다. 악티늄족의 3+와 4+의 가용성과 불용성은 란타넘족 염과 비슷하다. 그래서 악티늄족의 인산염, 플루오린화염, 옥살산염, 아인오딘화염 그리고 탄산염은 물에 약한 가용성을 가진다; 악티늄족 염은 수소화물 같은 침전물이 생긴다. (ThF4·3H2O 그리고 Th(CrO4)2·3H2O)
(AnO22+-의 양이온을 제외하고)산화 상태가 6+인 악티늄족은, [AnO4]2−와 [An2O7]2− 그리고 다른 복합적 음이온의 형태를 한다. 예시적으로, 우라늄, 넵투늄 그리고 플루토늄은 form salts of the Na2UO4 (우라늄산염) 그리고 (NH4)2U2O7 (중우라늄산염) 종류의 형태의 염을 가진다. 란타넘족과 비교하면, 악티늄족이 더 쉽게 배위 화합물의 형태를 가지고, 이 능력은 악티늄족의 원자가를 늘린다. 3+의 악티늄족은 플루오린화 배위 화합물의 형태를 가지지 않는 반면, 4+의 토륨은 복잡한 K2ThF6, KThF5, 그리고 K5ThF9의 형태를 한다. 또한 토륨은 황산염과 (예시로 Na2SO4·Th (SO4)2·5H2O), 질산염 그리고 티오시안산염의 형태도 가진다. 토륨의 배위수가 12일 때 일반적인 화학식이 An2Th(NO3)6·nH2O인 염은 배위 화합물로 존재한다. 이것은 악티늄족의 5+와 6+의 복합적 화합물 염보다 더욱 생산하기 쉽다. 악티늄족에서 가장 안정한 배위 화합물은 반응로에서 디케톤과 반응하여 만들어지는 토륨 5+와 우라늄 5+이다. 또한, 아세틸아세톤과도 합성하여 생산이 가능하다.
적용[편집]
악티늄족이 일상생활에 적용되는 예로는, 연기 감지기 (아메리슘) 또 악티늄족은 주로 핵 무기나 핵 반응기에서 연료로 쓰인다. 앞에서 말한 연기 감지기와 가스 맨틀은 악티늄족이 스스로 핵연쇄 반응을 한다는 전제 하에 악티늄족이 핵반응을 하면서 막대한 에너지를 방출하는 것을 활용한 대표적인 예이다.

원자력 발전에 가장 필요하면서 가장 중요한 것은 바로 우라늄-235이다. 이것은 열중성자로에도 쓰이며, 우라늄-235는 자연적으로는 0.72%밖에 존재하지 않는다. 이 동위원소는 많은 에너지를 배출하면서 강한 힘으로 열중성자를 흡수한다. 1g의 우라늄-235가 한 번 핵분열을 했을 시의 에너지는 1일에 1MW(메가와트)로 변환된다. 중요한 것은, 235U은 235U가 흡수한 중성자보다 더 많은 양의 중성자를 발사한다는 것이다. 임계 질량에 도달하면, 235U는 스스로 핵연쇄 반응을 하게 된다. 일반적으로, 2-3개의 중성자와 함께 우라늄의 핵은 두 조각으로 나뉜다. 예시적으로:
우라늄-235 말고도 원자력 발전에 많이 쓰이는 것은 토륨-232와 토륨 연료 사이클에서 나온 결과물인, 우라늄-233이 많이 쓰인다.
| 핵 반응로 |
| 대부분의 2세대 반응로는 여러 개의 속이 빈 금속 막대를 가지고 있는데, 금속 막대는 주로 지르코늄 합금으로 만들고, 핵 연료 펠릿으로 채워져 있다 – 대부분 산화물, 탄화물, 질화물 또는 일황화우라늄, 플루토늄 또는 토륨, 또는 그것들의 혼합물(MOX 연료로도 불린다)으로 되어있다. 대표적인 연료로는 우라늄-235의 산화물이 있다.
빠른 중성자는 감속제에 의해 느려진다. 감속제는 물을 포함하는 재료로, 주로 탄소, 중수소, 또는 베릴륨으로 되어있는데, 열중성자처럼 우라늄-235과의 상호 작용의 효율을 높이는 역할을 한다. 핵 반응의 속도는 붕소나 카드뮴 또는 액체 흡수제(주로 붕산)로 만들어진 추가적인 막대에 의해 조정된다. 플루토늄을 만드는 반응로는 증식로라는 이름으로 불린다; 증식로는 디자인이 다르고 빠른 중성자를 사용한다. |
우라늄의 핵분열 반응 중 중성자 배출은 핵연쇄 반응에서만 중요한 것은 아니다. 중성자 배출은 더 무거운 악티늄족을 만드는 데도 중요한 역할을 한다. 우라늄-239는 β-붕괴를 거치면서 플루토늄-239로 변환된다. 우라늄-235와 같이 자발 핵분열을 할 수 있다. 세계에서 처음 만들어진 핵 반응로는 원자력 에너지를 위해서 만들어진 것이 아닌, 사실은 핵무기에 사용할 플루토늄-239를 만들기 위해서 만들어졌다.
전체 생산된 토륨의 절반은 발광하는 성질을 이용하여 가스 맨틀로 쓰인다. 토륨은 또한 여러 가지 금속이 섞인 합금을 만들 수도 있다. 합금은 마그네슘과 아연으로 만들 수 있다. Mg-Th 합금은 가볍고 단단하지만, 높은 녹는점과 유연성으로 인해 항공 산업과 미사일에 폭넓게 쓰이고 있다. 또한 토륨은 긴 평균 수명과 방출에 좋은 낮은 전위 장벽, 그리고 강한 전자 방출 성질을 가지고 있다. 토륨과 우라늄의 동위 원소들은 항성을 포함하여 과거의 시간대를 추측하는데 다양하게 쓰이고 있다.
플루토늄은 대표적으로 핵 무기에 쓰인다. 이것은 플루토늄-239 동위 원소가 핵분열할 때까지의 짧은 시간과 핵분열의 위력을 이용한 것이다. 플루토늄을 기반으로 한 설계는 우라늄-235의 임계 질량을 ⅓로 줄일 수 있다. 맨해튼 계획 중에 평소보다 상당히 높은 밀도로 압축한 플루토늄의 폭발을 이용하기 위해 "팻 맨"과 같은 여러 플루토늄 폭탄이 만들어졌다. 이것은 반응을 시작하기 위함과 효율성을 높이기 위해 중앙 중성자 원과 조합되어 있다. 그러므로 TNT 기준 20킬로톤의 수율 핵실험을 하기 위해서는 오직 6.2kg의 플루토늄만 있으면 가능하다. (핵무기 설계를 참조하자.) 가설에 따르면, 적어도 4kg의 플루토늄만 있어도 핵무기를 만들 수 있는데, 이 양으로는 매우 복잡한 설계와 조립을 거친 하나의 폭탄을 만들 수도 있다.
플루토늄-238은 어쩌면 핵반응로에서는 우라늄-235보다 더 효율적인 동위 원소가 될 수 있다. 왜냐하면 플루토늄-238은 우라늄-235보다 더욱 작은 임계 질량을 가지고 있지만 핵분열 연쇄 반응이 조종 막대에 의해 멈출 때까지 끊임없이 붕괴하여 많은 양의 열 에너지를 생산하기 때문이다.(0.56 W/g) 이것의 용도는 한정적인데, 왜냐하면 플루토늄-238의 높은 가격 때문이다.(1g당 약 1,100,000원) 이 동위 원소는 우주에서 인공 위성과 우주 정거장에서 열전퇴 기능과 물을 증류하는 기능에 쓰인다. 또한 갈릴레오와 아폴로 우주선 (예: 아폴로 14호)에서도 킬로그램 정도의 무게인 산화플루토늄-238로 히터를 작동시켰다; 또한 이 열은 열전퇴와 함께 전기로 바뀌기도 한다. 플루토늄-238의 붕괴에서는 거의 해롭지 않은 알파 입자를 방사하고, 감마선 조사를 동반하지 않는다. 그러므로, 이 동위 원소는(~160 mg) 원자력 심장페이스메이커의 에너지원에 사용된다. 원자력 심장페이스메이커에서의 에너지는 일반 배터리보다 5배 더 길다.
악티늄-227은 중성자원에 사용된다. 이것의 높은 비에너지와(14.5 W/g) 열적으로 안정한 화합물의 상당량을 획득할 가능성은 오래 지속되는 열전 발전기를 원격 조정하기에 좋다.228Ac는 방사능을 화학적으로 연구할 때의 재료로 쓰이는데, 악티늄-228을 쓰는 이유는 이것이 높은 에너지를 가진 전자를(2.18MeV) 방사하고 이 전자가 쉽게 감지되기 때문이다. 228Ac-228Ra 혼합물은 산업과 약에서의 강렬한 감마선원에 폭넓게 사용된다.
내구성이 좋은 결정체를 가진 비활성 매질과 악티늄족을 첨가한 자체발광 금속의 발명은 악티늄족의 활용에서 새로운 방법으로 알려지고 있다. 알파 입자를 방사하는 방사성 핵종은 빛을 받는 일부 유리와 결정에 사용된다.(오역 있을 수 있음)
독성[편집]
방사성 물질은 인간의 건강에 피해를 주는데, 처음에는 전체적 피부 오염, 다음에는 방사성 동위원소가 흡수되어 체내 피폭이 일어나고, 마지막에는 β-입자와 γ-선에 의해 완전히 체외 피폭이 된다. 라듐과 초우라늄 원소와 함께 있을 경우, 악티늄은 특유의 α-선으로 인해 가장 위험한 방사성 독 중 하나다. 악티늄의 중요한 위험 요소는 해골 표면에 축적되고 잔류하여 뼈를 약하게 하는 것이다. 독의 시원기가 되면, 악티늄은 간에도 축적된다. 또다른 악티늄의 위험 요소는 악티늄이 배설되는 것보다 방사성 붕괴를 빨리 겪는다. 소화관에서 흡착되는 악티늄의 양은 라듐보다 훨씬 작다.(~0.05%)
프로트악티늄은 인체에서 콩팥과 뼈에 축적된다. 인체에서 프로트악티늄의 최대로 안정한 양은 0.03 µCi인데, 이것은 0.5μg의 231Pa에 해당하는 것이다. 에어로졸같이 대기 중에 존재하는 것으로 추정되는 이 동위원소는, 시안화수소(청산가리)의 2.5×10⁸배의 독을 가지고 있다.
음식이나 피(예: 상처 등) 또는 공기를 통하여 인체에 들어오는 플루토늄은, 주로 폐, 간 그리고 뼈에 축적된다. 그래서 다른 인체 기관에는 단지 10%만 축적된다. 플루토늄은 인체에 10년 이상 잔류한다. 체내에서의 플루토늄의 축적 시간이 긴 이유는 완전히 밝혀지지 않았지만, 플루토늄의 가용성이 매우 약해서 축적 시간이 긴 것으로 추측되고 있다. 플루토늄의 일부 동위 원소는 이온화된 α-선을 방출하는데, 이것이 주변의 세포들에 피해를 준다. 추측으로는 플루토늄의 평균 치사량은 (LD50)개에게 플루토늄이 들어있는 약물을 정맥에 주사하고 나서 30일이 지난 뒤 치사량을 확인해 보니 인체 1kg당 0.32mg인것으로 추측되었고, 70kg인 사람을 기준으로 치사량은 거의 22mg인것으로 추측되었다. (그러나, 호흡기가 플루토늄에 노출될 시 거의 4배 강력해진다.) 또다른 추측으로는 플루토늄은 라듐보다 50배 독이 약하다고 추측하였고, 그렇게 되면 체내에 허용되는 축적량은 5 µg 또는 0.3 µCi가 되는 것이다. 이 정도의 양은 현미경으로도 거의 보이지 않는다. 동물에게 실험하고 나서, 플루토늄의 최대 허용 수치는 0.65 µg 또는 0.04 µCi로 변경되었다. 또한 동물 실험은 플루토늄의 가장 위험한 노출 방법은 호흡기 노출이었다는 것이 밝혀졌는데, 호흡기에만 약 5-25%의 플루토늄이 호흡기에 남아있었다. 플루토늄 화합물이 잔류하는 양은 입자의 크기와 가용성에 따라 결정된다. 플루토늄은 폐나 림프계에 모이거나, 피에 흡수되어 간과 뼈로 이동하여 모인다. 음식을 통해서 흡수되는 경로는 많지 않은 경우다. 이때는 오직 0.05%의 가용성 플루토늄과 0.01%의 불용성 플루토늄만이 피에 흡수되고, 전체가 배설된다. 손상된 피부를 통해 플루토늄이 노출된 경우는 플루토늄의 거의 100%가 잔류한다. 악티늄족을 핵 연료로 이용할 때는, 방사능원을 차단하거나 방사성 물질을 막을 수 있는 고급 광물(예로 들자면 큰 잠재적 이득이 있는 자체 발광 결정 등)을 사용해야 한다. 그러나, 악티늄족의 강한 방사능독으로 인해 자연에서의 이동과 악티늄족에 깊은 우려가 있기도 하다. 혼합산화물핵연료(MOX)에서 화학적으로 불안정한 형태를 가진 악티늄족의 사용과 방사능 원천을 차단하는 것으로는 현대 안전 기준에는 적절하지 않다. 현재 안정되고 내구성이 좋은 악티늄족과 관련된 물질을 제작하는 것에 도전하고 있다. 이것은 안전한 창고에 들어있어야 하고, 사용하고 나서 최종 처분할 수 있어야 한다. 악티늄족 고체 용액의 적용의 열쇠는 바로 내구성이 좋은 결정체의 상이다.
참고자료[편집]
- 〈악티늄족〉, 《위키백과》
같이 보기[편집]

 위키원
위키원



![{\displaystyle \mathrm {{}_{92}^{238}U+{}_{0}^{1}n\ {\xrightarrow {\ }}\ {}_{92}^{239}U\ {\xrightarrow[{23.5\ min}]{\beta ^{-}}}\ {}_{93}^{239}Np\ {\xrightarrow[{2.3\ days}]{\beta ^{-}}}\ {}_{94}^{239}Pu\ {\xrightarrow[{2.4\cdot 10^{4}\ years}]{\alpha }}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8a46a4df291b4030f17911182c2baed017886104)