EGF
EGF는 'Epidermal Growth Factor'의 약자로 상피세포 성장인자, 상피 성장인자라고 불린다. 상피 혹은 외피 세포에서 유도되는 단백질로 일종의 리간드(ligand)로 작용하여 상피 성장인자 수용체(Epidermal growth factor receptor; EGFR)에 결합함으로써 세포 성장과 분화 및 해당작용(glycolysis) 등에 기여한다.
목차
개요[편집]
EGF는 인체의 자연적인 상처치유 과정에서 새살(육아조직)을 돋게 하고 혈관을 재생시키는 몸 안의 상처치유 물질이다. 주로 사람의 체액에 고루 분포되어 있고 53개의 아미노산으로 이루어져 있다. 미국의 생물학자 스탠리· 코헨(Stanley Cohen) 박사에 의해 발견되었다. 코헨 박사는 동물이 상처를 혀로 핥아주기만 하면 아무는 것에 착안하여 생쥐 침샘 연구를 시작했다. 생쥐의 턱밑 샘 추출물을 갓 태어난 생쥐에게 주사하고 그 반응을 관찰하는 실험인데, 주사를 맞은 생쥐가 보통 생쥐보다 눈을 빨리 뜨고 이가 빨리 자란다는 사실을 발견한 것에 착안 하여 EGF 성분을 발견해 냈다.
EGF는 3대 효과가 있다. 상처부위에 있는 상피세포를 증식시켜 살갗을 빨리 덮는 재상피화가 그 첫 번째. 살갗 밑에 있는 조직(진피조직)의 섬유 아세포를 증식하고 새살을 채워주는 육아조직 증식이 두 번째다. 마지막은 내피 세포의 재생을 촉진하여 빠르게 혈관을 생성하는 기능이다. EGF는 피부의 표면에 있는 수용체와 결합되어 새로운 세포의 생산을 촉진하며 체내에서 형성되는 단백질의 일종이다. 정식 명칭은 히토 올리고펩티드-1(HUMAN OLIGOPEPTIDE-1) 라고 한다. 이 발견에 의해 스탠리 코헨 박사는 노벨 의학 생리학상을 수상 했다. EGF는 주로 화상 등의 피부 재생 분야에서 쓰이고 있다. EGF는 지금까지 일본에서도 화장품 성분에 대한 정식 명칭이 없었기 때문에 화장품에 배합 할 수 없었지만 2005년 가을부터 정식으로 성분 표시 히토 올리고펩티드-1 (HUMAN OLIGOPEPTIDE-1)으로 등록되어, 현재에는 EGF 를 포함하고 있는 화장품이 시중에 다량 출시 되고 있다.
EGF 구조와 단백질군(family)[편집]
상피 성장인자는 총 53개의 아미노산으로 이루어져 있으며 분자량 6 kDa의 작은 폴리펩티드이다(그림 1). EGF는 6개의 보존된 시스테인 잔기를 지니고 있는데, 이들은 모두 3개의 분자내 이황화결합 (intramolecular disulfide bond)을 만들 수 있다. EGF는 소변, 타액, 유액, 혈장 등에서 모두 발견된다. EGF는 테스토스테론에 의해 자극되어 생성될 수 있다.
- EGF-단백질군(family) / EGF-유사 도메인(EGF-like domain)
EGF는 EGF-가계로 구분되는 단백질 무리의 일종이다. EGF-단백질군에 속하는 단백질들은 매우 유사한 구조적 기능적 특성을 공유한다. EGF 외에도 다른 단백질의 종류는 다음과 같다.
- 헤파린-결합 EGF-유사 성장인자 (Heparin-binding EGF-like growth factor; HB-EGF)
- 형질전환 성장인자(transforming growth factor-α; TGF-α)
- 암피레귤린(AR; amphiregulin), 에피레귤린(EPR; epiregulin), 에피겐(epigen)
- 베타셀률린(BTC; betacellulin), 뉴레귤린-1(NRG1; neuregulin-1), NRG2, NRG3, NRG4
가계 내 모든 구성요소 단백질들은 다음과 같이 잘 보존된 아미노산 서열의 한 개 이상 반복되는 구조를 갖는다(X는 어떤 아미노산이든 올 수 있는 위치를 말함): CX⁷CX₄-₅CX₁₀-₁₃CXCX₈GXRC
이 염기서열은 역시 6개의 시스테인 잔기를 가지며 이들은 3개의 분자내 이황화결합을 할 수 있다. 이러한 구조적 특성은 EGF-단백질군과 세포 표면 수용체 간의 고친화적 결합에 매우 필수적인 역할을 한다.
발견[편집]
상피 성장인자는 1950년대 반더빌트 대학(Vanderbilt University)의 스텐리 코헨(Stanley Cohen)과 동료에 의해 처음 발견되었다. EGF와 그 수용체를 발견한 공로로 1986년 스텐리 코헨은 노벨생리의학상을 수상하였다.
EGF는 본래 쥐의 턱밑샘(submaxillary gland)과 사람의 소변에서 분비되는 펩티드로 발견되었다. 이 후 턱밑샘, 귀밑샘(parotid gland)과 같은 인체 여러 조직에서 발견되었다. 인간의 상피 성장인자는 초기에는 유로게스트론(urogastrone)이라고 명명하였다.
기능[편집]
상피 세포 또는 외피 세포에서 유도된 상피 성장인자는 이에 대한 수용체에 결합함으로 세포 성장과 분화 그리고 해당작용(glycolysis)등에 기여한다. 침샘 상피 성장인자는 구강-식도와 위 조직 완전성(integrity) 유지에 매우 중요한 역할을 하며 또한 구강과 위식도 궤양의 치료, 위산 분비의 억제, DNA 합성의 자극, 점막의 보호 등에 기여한다.
- 세포 성장, 증식 및 분화
상피 성장인자는 상피 성장인자 수용체에 결합 후, 신호전달을 통해 세포의 성장과 분화에 관련된 DNA 합성과 단백질 합성 증가를 유도하는 신호 전달 인자이다. 상피 성장인자가 세포막을 교차하는 상피성장인자 수용체에 특이적으로 결합하면 세포 내부로 급격한 생존과 분화 신호를 개시한다 (오른쪽 그림2). 만약, 상피성장인자 수용체가 변형되어 항상 활성화된 상태로 있거나 발현 조절에 대한 기능 이상이 생기면 세포 증식이 계속적으로 일어나 종양발생의 원인이 된다.
신호전달 경로[편집]
상피성장인자 수용체(EGFR)와 EGF의 결합[편집]
상피성장인자 수용체(EGFR)는 분자량이 약 170 kDa이며, 세포막을 관통하는 막단백질이다. 세포막 밖에 존재하는 단백질이자 리간드(ligand)인 상피성장인자(EGF)와 결합하는 수용체이다. 단백질인산화효소(kinase)란 인산기를 특정 단백질에게 붙이는 인산화반응을 촉매하는 효소를 말하는데, 상피성장인자 수용체 역시 단백질인산화효소로서 티로신 잔기에 인산화를 시키는 효소활성을 가진다. 이 수용체의 N-말단은 세포 밖에 위치하며 상피성장인자가 결합하는 부위를 지니고 있고 C-말단은 세포질에서 위치하며 단백질인산화효소 활성을 가진다 (그림 2).
EGFR 내부 신호전달과 Ras-Raf-ERK 경로의 활성[편집]
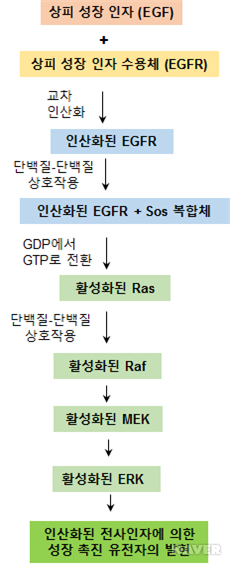
EGFR은 평소에는 비활성 상태인 두 개의 단량체(monomer) 형태로 존재하다가 리간드인 EGF가 결합하면 활성화된 동형이량체(homodimer)로 전이된다. 이 때 형성된 동형이량체의 두 개의 C-말단 부위는 서로 교차작용해서 5개 이상의 티로신 잔기를 서로 인산화시켜 세포 내부에 티로신-특이적 단백질인산화효소 활성을 유도한다. 연이어, 인산화된 티로신에 결합하는 SH2 영역을 지니는 어댑터 분자인 Grb-2 단백질과 상호작용이 일어난다 (그림2). Grb-2의 활성화는 SOS 단백질과 상호작용을 촉진하고, GTP와 GDP간의 교환을 촉진하는 SOS의 작용에 의해 Ras 단백질을 활성화 시킨다. Ras는 작은 G단백질(small G proteins)들 중 하나로서 비활성화 상태에서는 GDP가 결합되어 있지만 SOS에 의해 GDP가 탈리되고 GTP가 결합되면 활성화된다(그림2). 이때 Ras의 구조가 변경되고 하위 분자로 신호전달을 촉진한다.
GTP가 결합된 활성 Ras는 Raf 단백질인산화효소에 결합을 촉진하여 이를 활성화한다 (그림 3). Ras에 의해 활성화된 Raf는 교대로 MEK 단백질인산화효소를 활성화한다. 그리고 활성화된 MEK는 하위 분자인 ERK (extracellular signal-regulated kinase)의 활성화를 유도한다 (그림3). ERK는 MAPK (mitogen-activated protein kinase) 중 하나로서 세포분열을 촉발하는 다양한 미토겐(mitogen)에 의해 활성화되는 단백질인산화효소이다. MEK 중 하나인 Raf에 의해 활성화된 ERK는 핵 내에서 세포 성장에 관련된 여러 전사인자들을 인산화하고 활성화한다 (그림 3).
탈인산화효소에 의한 활성 종료[편집]
EGF 신호 전달 경로에 수반되는 많은 단백질들은 주로 인산화를 통해 활성화되기 때문에, 이들 인산기를 탈리하는 효소인 탈인산화효소(phosphatase)의 활성은 EGF 신호 전달을 차단하는데 중요하다. 실제 EGF 신호 전달에 수반되는 단백질인산화효소 중 일부는 과도한 신호 전달을 막기 위해 탈인산화효소의 활성을 유도하기도 한다. 그 중 하나로 Ras 자체도 본연의 GTP 가수분해효소(GTPase) 활성을 지니고 있다. GTP가 결합된 활성 Ras는 자체 내 GTP 가수분해효소 작용으로 GTP를 GDP 로 전환시켜 스스로 비활성을 유도하기도 한다.
EGF/EGFR과 질환[편집]
EGFR은 다양한 종양의 발생과 전이에 중요한 역할을 하는 것으로 보고되었다. EGFR과 EGF-유사 펩티드(EGF-like peptides)는 사람 종양에서 종종 과발현 되어 있으며 생체 혹은 시험관 수준의 연구를 통해 이들 단백질과 암발생은 매우 밀접한 관련성이 있음이 입증되었다. EGFR 유전자의 증폭, EGFR 티로신 키나아제 도메인의 돌연변이들이 실제 암 환자에게서 자주 발견된다. 따라서 EGFR 신호를 차단하거나 세포 내부의 티로신 의존적 단백질인산화효소 활성을 억제하고자 하는 시도는 EGFR을 발현하는 암 성장을 억제할 수 있다. 흥미롭게도 이들 EGFR의 유전적 변이와 항 EGFR 치료제 반응성과도 밀접한 연관성이 있음이 밝혀졌으며, 이것은 개인별 맞춤의학치료(personalized medicine)에 의한 암 치료의 한 예가 될 수 있다.
한편 EGFR과 다른 수용체 티로신 의존적 단백질인산화효소의 신호전달 결핍은 알츠하이머병(Alzheimer's disease)과 유관하다고 보고되었다.
EGF-EGFR 경로가 병리적으로 작용하는 것만은 아니며 EGF 자체를 이용하여 인체 질병을 치료하려는 시도도 있다. 사람 재조합 성장인자인 Heberprot-P를 이용하여 당뇨 합병증으로 인한 발 궤양 치료제로서의 가능성에 대한 연구가 시도되고 있다. 상처부위에 주사하거나 국소적으로 사용될 수 있으며 안정성이나 효능에 대한 연구가 진행 중이다.
참고자료[편집]
- 〈상피 성장인자〉, 《분자·세포생물학백과》
- 자연과학연구소, 〈<분자생물학>EGF - 상피세포 성장인자〉, 《네이버 블로그》, 2018-02-20
같이 보기[편집]

 위키원
위키원