"삼투압"의 두 판 사이의 차이
(새 문서: 썸네일|300픽셀|'''삼투압''' 파일:삼투압에 의한 현상의 예. 용액의 종류에 따라 적혈구의 모양이 달라진다..png|썸네일|...) |
|||
| (다른 사용자 한 명의 중간 판 하나는 보이지 않습니다) | |||
| 4번째 줄: | 4번째 줄: | ||
1886년 야코부스 반트호프(Jacobus Henricus van't Hoff, 1852-1911)가 용액 속에 녹아 있는 물질의 움직임들이 기체분자의 움직임과 비슷하게 작용하여 반투과성 막에 압력을 가하고 있음을 발견하고 기압과 용질의 부피, 농도, 절대온도를 통하여 그 값을 구할 수 있음을 이론적으로 증명하였다. 이러한 삼투압은 물이 반투과성 막을 통과하려는 힘에 의해 발생하는 것으로 용액의 농도 차이와 그 절대온도에 비례한다. | 1886년 야코부스 반트호프(Jacobus Henricus van't Hoff, 1852-1911)가 용액 속에 녹아 있는 물질의 움직임들이 기체분자의 움직임과 비슷하게 작용하여 반투과성 막에 압력을 가하고 있음을 발견하고 기압과 용질의 부피, 농도, 절대온도를 통하여 그 값을 구할 수 있음을 이론적으로 증명하였다. 이러한 삼투압은 물이 반투과성 막을 통과하려는 힘에 의해 발생하는 것으로 용액의 농도 차이와 그 절대온도에 비례한다. | ||
| − | |||
| − | |||
| − | |||
== 반트호프(van 't Hoff)의 법칙 == | == 반트호프(van 't Hoff)의 법칙 == | ||
| 46번째 줄: | 43번째 줄: | ||
* 입 안에 사탕을 넣고 있으면 입 안의 수분이 사탕으로 빠져나가 거칠어진다. | * 입 안에 사탕을 넣고 있으면 입 안의 수분이 사탕으로 빠져나가 거칠어진다. | ||
* 바다에 표류할 때 수분 공급처가 없다고 바닷물을 마시면 안된다. 삼투 현상으로 오히려 더 탈수가 진행된다. 바닷물의 무기 염류 농도가 우리 몸의 체내 무기 염류 농도의 세 배가 넘기 때문. | * 바다에 표류할 때 수분 공급처가 없다고 바닷물을 마시면 안된다. 삼투 현상으로 오히려 더 탈수가 진행된다. 바닷물의 무기 염류 농도가 우리 몸의 체내 무기 염류 농도의 세 배가 넘기 때문. | ||
| − | + | ||
== 참고자료 == | == 참고자료 == | ||
2023년 9월 5일 (화) 09:00 기준 최신판
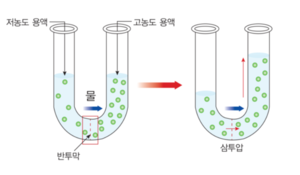
삼투압(Pression osmotique , Osmotische Druck , Osmotic Pressure)은 삼투현상을 통하여 물이 농도가 낮은 쪽에서 높은 쪽으로 이동할 때 생겨나는 압력을 말한다.용매를 잘 통과시키면서 용질은 통과시키지 않는 반투막에 의해 용액이 순수용매와 분리되어 있다면, 순수용매 쪽에서 용액쪽으로 용매가 이동하는 삼투현상이 일어나게 된다. 이 때에 반투막을 통과하여 들어오려는 유체를 막는 데에 필요한 최소 압력을 삼투압이라고 한다. 삼투압은 용질의 종류에 관계없이 농도에만 의존하므로 총괄성질(colligative property)로 분류된다.
1886년 야코부스 반트호프(Jacobus Henricus van't Hoff, 1852-1911)가 용액 속에 녹아 있는 물질의 움직임들이 기체분자의 움직임과 비슷하게 작용하여 반투과성 막에 압력을 가하고 있음을 발견하고 기압과 용질의 부피, 농도, 절대온도를 통하여 그 값을 구할 수 있음을 이론적으로 증명하였다. 이러한 삼투압은 물이 반투과성 막을 통과하려는 힘에 의해 발생하는 것으로 용액의 농도 차이와 그 절대온도에 비례한다.
반트호프(van 't Hoff)의 법칙[편집]
네덜란드의 화학자이자 첫번째 노벨 화학상 수상자인 판트호프는 삼투압을 아래와 같이 나타낼 수 있음을 밝혀내었다.
Ⅱ= cRT
여기서 좌변의 Ⅱ는 삼투압, c는 용질의 몰농도, R은 기체상수, 그리고 T는 절대온도를 의미한다. 이 식에 나타난 바와 같이 삼투압은 용질의 종류에는 상관없이 그 농도에만 의존하므로 삼투압은 총괄성질(colligative property)임을 알 수 있다.
위 식은 이상기체의 상태방정식 의 이상용액 버전으로 볼 수 있으며, 따라서 용액의 농도가 충분히 낮은 경우에만 맞는 것으로 보아야 한다.
또한 용질의 총질량(w)을 아는 경우 위 식을 통하여 용질의 분자량(M)을 아래와 같이 계산할 수 있다.
ⅡⅤ = nRT = ⍵/M ∙ RT
→ M = ⍵RT/ⅡⅤ
여기서 n은 용질의 몰수, V는 용액의 부피를 나타낸다.
생체안의 삼투현상[편집]
생체내부에 존재하는 막은 일반적으로 반투막으로서, 이온, 단백질 등 전하를 띠거나 크기가 큰 입자들은 통과시키지 않고 무극성인 지질(lipid)이나 작은 분자들 (산소, 이산화탄소 등)은 잘 통과시킨다. 물분자의 경우, 아쿠아포린이라는 채널단백질이 세포막에 존재하여 그 도움으로 자유롭게 세포막을 드나들 수 있다.
적혈구의 형태[편집]
세포가 염도가 낮은 저장액(hypotonic)에 담겨있는 경우에는 물을 빨아들이고, 반대로 세포가 고염도의 고장액(hypertonic)에 담겨있는 경우는 물이 밖으로 빠져나가는 작용이 삼투현상에 의해 발생하게 된다. 실제로 적혈구의 형태를 관찰해보면, 주위의 염분농도가 높을때는 물이 빠져나가 쭈글쭈글해지고, 낮을 때에는 물이 흡수되어 부풀어오르는 것을 볼 수 있다. 따라서 생체의 혈관에 주입하는 생리식염수나 링거액은 혈액과 염분농도를 맞춘 등장액(isotonic)이어야 한다.
식물의 줄기와 뿌리[편집]
삼투현상은 식물의 줄기를 튼튼하게 지탱해주는 원리이기도 하며, 뿌리에서 물이 흡수되는 원리이기도 하다. 식물은 능동적으로 뿌리세포의 내부를 높은 농도의 수용액으로 유지하므로, 외부에 존재하는 순수한 물은 삼투압에 의해 뿌리내부로 스며든다.
삼투현상의 예[편집]
- 김장할 때, 배추를 소금에 절여놓으면 배추 안에 있던 수분이 소금이 있는 바깥쪽으로 빠져나온다.
- 달팽이에게 소금을 뿌리면 삼투 현상에 의해 몸에 있던 수분이 밖으로 다 빠져나와 죽게 된다.
- 적혈구를 농도가 진한 고장액(hypertonic)에 담가 놓으면 수분이 밖으로 빠져나가 쪼그라든다. 반대로 농도가 묽은 저장액(hypotonic)에 담가 놓으면 수분이 적혈구로 들어와 결국 터지는 용혈 현상이 일어난다. 따라서 용액을 혈관에 주사할 때는 반드시 등장액(isotonic)을 사용해야만 한다. 농도가 혈액보다 진하거나 묽으면 조직이 괴사할 수 있다.
- 동물 소화기관도 마찬가지. 소화된 음식에서 물과 함께 그 속에 있는 영양분이 삼투압을 통해 소화관을 싸고 있는 혈관으로 이동하는 것.
- 물중독은 물을 급하게 많이 마시게 될 경우 혈액이 희석되고 신체의 수분이 오히려 흡수되지 않고 고여서 뇌부종 등의 합병증까지 유발하는 질환이다.
- 투석은 낮은 투석액의 농도로 삼투에 의해 피 속의 수분이 빠져나가지 않도록 투석액의 농도를 조절해야한다.
- 양서류가 바닷물에 입수하면 몸이 쪼그라들어 죽는다. 양서류 체내 농도보다 바닷물의 농도가 훨씬 높기 때문에 체내 수분 입자가 피부를 통해 전부 빠져나가기 때문이다. 위의 적혈구와 비슷한 원리. 그런데 올챙이 시절을 바다에서 지내는 개구리가 딱 한 종류 있다고 한다.
- 맛조개가 서식하는 구멍에 소금을 투입하면 삼투 현상을 견디지 못하고 밖으로 나온다.
- 입 안에 사탕을 넣고 있으면 입 안의 수분이 사탕으로 빠져나가 거칠어진다.
- 바다에 표류할 때 수분 공급처가 없다고 바닷물을 마시면 안된다. 삼투 현상으로 오히려 더 탈수가 진행된다. 바닷물의 무기 염류 농도가 우리 몸의 체내 무기 염류 농도의 세 배가 넘기 때문.
참고자료[편집]
같이 보기[편집]

 위키원
위키원