단백질(Protein, 蛋白質)은 생명체를 구성하는 고분자 유기 물질이다. 단백질의 구성단위 물질은 아미노산이다.
단백질 영어명 프로틴(protein)은 그리스어의 proteios(중요한 것)에서 유래된 것이다. 단백질의 한자 표기에서 단(蛋)이 새알을 뜻하는 것에서 알 수 있듯, 단백질은 달걀 등의 새알의 흰자위를 이루는 주요 성분이다. 단백질이라는 한자어는 독일어에서 비롯되었는데, 독일어를 직역하면 "흰자 물질"이라는 뜻이다.
단백질은 아미노산(amino acid) 사이의 펩타이드 결합으로 형성된다. 단백질을 이루고 있는 20가지의 서로 다른 아미노산들이 펩타이드 결합으로 길게 연결된 것을 폴리펩타이드라고 하며 폴리펩타이드 사슬이 4차 구조를 이루어 고유한 기능을 갖게 되었을 때 단백질이라고 부른다. 단백질과 폴리펩타이드는 엄밀히 말하면 다른 분자이지만 경우에 따라 구분 없이 쓰이기도 한다. 일반적으로는 분자량이 비교적 작으면 폴리펩타이드라고 하며, 분자량이 매우 크면 단백질이라고 한다.
생명체 내에는 많은 종류의 단백질이 있고, 생물의 구성, 성장, 생존을 위한 생리적 기능에 중요한 역할을 수행한다. 화학식은 (NH₂CHRnCOOH)n이다.
아미노산[편집]
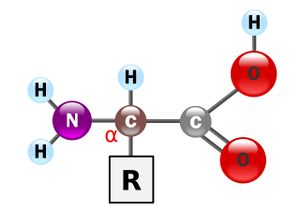
아미노산(amino acid)은 단백질의 기본 구성단위이며 염기성 아미노기와 산성 카복실기 모두 포함하는 유기산이다. 아미노산은 수용액에서는 양쪽성을 가지고 있다. 화학식은 NH₂CHRnCOOH(n=1~20)이다. Rn의 종류에 따라서 20가지의 아미노산이 존재한다.
아미노산은 아미노기와 카복실기를 모두 포함하고 있기에 중성에서 쯔비터 이온(zwitter, 한 분자내에 양전하와 음전하를 모두 소유)으로 존재하며, 공명(resonance) 안정화를 취한다. 여기서 'R'은 곁사슬을 나타내고, 곁사슬에 따라 무슨 아미노산인지가 결정된다. 아미노산은 곁사슬의 성질에 따라 소수성(비극성), 친수성(극성), 염기성, 산성의 네 가지 종류로 구분된다.
생화학에선 흔히 α-아미노산을 간단히 아미노산이라 부른다. α-아미노산은 아미노기와 카복실기가 하나의 탄소에 붙어있다.
단백질 합성에는 20가지 아미노산이 모두 필요하기 때문에 한 가지라도 결핍되거나 공급이 부족하면 단백질 합성이 저해된다.
필수 아미노산이란 생체 내에서 합성이 되지 않거나 합성하기가 어려워서 음식물로 섭취해야 하는 아미노산을 말한다. 또 체내에서 합성이 되더라도 필요량만큼 합성이 되지 않는 아미노산도 포함된다. 성인은 9가지, 영유아는 10가지 필수 아미노산이 있다.
단백질의 구조[편집]
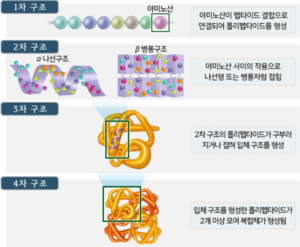
단백질은 고유한 3차원 구조로 접히는(Folding) 폴리펩타이드 사슬을 말한다. 단백질이 자연 상태에서 접히는 구조는 단백질의 이 폴리펩타이드를 이루는 아미노산들의 서열(sequence)에 의해 결정된다. 생화학자들은 단백질의 구조를 4개의 단계로 나누어 설명한다.
1차 구조[편집]
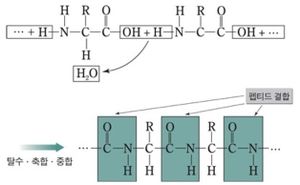
단백질의 고유한 아미노산 서열 순서로 아미노산이 펩타이드 결합(peptide bond)으로 연결되여 있는 배열순서를 1차구조라고 한다. 펩타이드 결합은 이웃한 아미노산의 카르복실기(-COOH)과 아미노기(-NH₂)사이에서 물 분자(H₂O)가 빠지면서 생성된다. 단백질의 양쪽 말단의 한쪽 부분은 N말단(아미노말단)이라고 하고 반대쪽을 C말단(카르복실말단)이라고 부른다. 각 단백질은 고유한 아미노산 서열을 가짐으로써 생체 내에서 중요한 성질을 가지게 된다.
2차 구조[편집]
단백질의 2차 구조는 뼈대(Backbone Chain)에 의해 형성된다. 뼈대에 속해있는 모든 아미노산이 갖고 있는 카보닐기의 산소 원자와 아민기의 수소 원자 사이에 수소결합이 형성되어 열역학적으로 안정한 상태(가장 낮은 자유에너지를 가진 상태)를 갖게 된다. 이때 단백질의 2차 구조가 주로 알파나선(α-helix)이나 베타 면(β-sheet)의 모양을 취하게 되는 이유는 폴리펩타이드 위에서 바로 옆에 위치한 두 아미노산 사이에서 곁사슬과 뼈대의 원자들끼리 서로 밀어내는 힘을 최소화 하는 안정한 모양이 알파나선이나 베타 면의 모양을 이루기 때문이다. 이는 뼈대의 수소결합(hydrogen bond)에 의한 일차적 접힘(folding)으로 가장 안정한 2차구조가 알파 나선이나 베타면의 모양을 이룸을 나타낸다.
3차 구조[편집]
2차구조를 가진 단백질이 다시 공간적으로 특징적인 굽힘과 접힘으로 이루어지는 입체구조 이다. 단백질의 3차 구조는 단백질을 이루는 곁사슬들의 소수성 결합에 의해 결정된다. 디설피드 결합이나 수소 결합등이 3차 구조를 더 안정시켜 주지만 3차 구조를 결정하는 가장 중요한 힘은 소수성 결합이다.
4차 구조[편집]
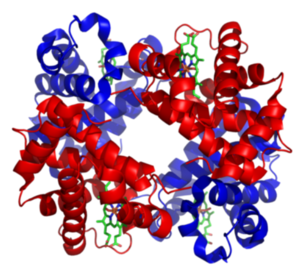
단백질의 4차 구조는 3차 구조를 이루고 있는 독립적인 단백질 여러 개가 모여서 만든 구조이다. 즉 많은 단백질들의 구조 형성 단계로 이는 다수의 폴리펩타이드가 상호작용하여 만들어진 단백질 모양을 가리킨다. 일정한 구조의 결합체가 형성되는 과정에는 여러 영역을 갖는 단백질 분자 간의 비공유결합이 관여한다.
4개의 단백질이 모여서 만들어진 헤모글로빈의 구조가 대표적인 4차 구조라고 할 수 있다. 4차 구조는 상호작용을 하는 단백질의 특수한 구조로 매우 안정적이다.
단백질의 주요 기능[편집]
단백질은 다양한 기능을 가지며 효소, 구조, 수송, 저장, 신호, 수용체, 조절단백질 등 다양한 종류가 있다. 효소 단백질은 생화학 반응을 촉매하고 구조 단백질은 세포 내 물리적지지 역할을 한다. 수송 단백질은 작은 분자나 이온을 수송하는 역할을 한다. 저장 단백질은 특정 세포 내에서 작은 분자나 이온의 저장소로 작용하거나 단백질 합성을 위한 아미노산 저장소로 작용한다. 신호 단백질은 세포 간 또는 세포 내에서 정보를 전달해준다. 수용체 단백질은 세포 내 외부의 환경 또는 발생과정의 신호를 감지하여 이를 세포 안으로 전달하고 적절한 세포 반응이 일어나게 한다. 조절 단백질은 여러 반응을 조절하는 역할을 하는데 예로는 전사나 번역을 조절하는 기구와 결합하여 단백질 합성을 조절한다. 그 외에 생명체나 환경에 따라 기능이 매우 다양하다.
단백질 변성[편집]
단백질은 트립신이라는 단백질 분해효소의 작용에 의해 소화된다. 그런데 콩에는 트립신의 활동을 방해하는 콩트립신 저해제라는 단백질이 들어있어 콩을 날로 먹으면 소화가 잘 되지 않는다. 하지만 콩을 가열할 경우 이 단백질 성분이 변성되어 저해기능을 상실 함으로 트립신이 활성화되어 소화효소의 침입이 용이해진다.
단백질의 변성은 단백질이 물리적인 요인(가열, 건조, 교반, 압력, X선, 초음파, 진동, 동결)이나 화학적인 요인(산, 염기, 요소, 유기용매, 중금속, 계면활성제) 혹은 효소의 작용 등으로 원래의 성질을 잃어버리는 현상이다. 대부분의 변성된 단백질들은 재생되지 않는다.
연구 방법[편집]
단백질의 구조를 직접적으로 연구하는 방법은 X선 회절법이다. 단백질의 결정에 X선을 쬐어, 그 X선이 휘는 모양을 관측하여 구조에 대해 연구한다. 또한 고해상도의 원자간력 현미경(AFM; Atomic Force Microscope)을 이용하여 단백질의 구조를 직접적으로 관찰하기도 한다.
또한 단백질의 서열을 알기 위해서는 에드만 분해(Edman Degradation), 질량 분석법(Mass Spectrometry)등을 사용한다. 요즘에는 시간이 오래걸리는 에드만 분해보다는 질량 분석법을 주로 사용한다. 단백질 서열 분석에 질량 분석법을 사용하는 연구에 2002년 노벨 화학상이 시상되었다.
그 외에 전기영동(Electrophoresis), 분석(Assay)등 여러가지 다양한 방법들을 통해 단백질을 연구한다.
단백질은 18세기 앙투안 푸르크루아 등에 의해 독립적인 생물학적 분자들로 인식되었으며, 열기나 산(acid)을 이용한 치료를 통해 응고, 응집을 할 수 있는 분자의 능력으로 식별되었다.
단백질은 네덜란드의 화학자 헤라르뒤스 요하네스 멀더에 의해 처음 기술되었으며 1838년 스웨덴의 화학자 야코브 베르셀리우스에 의해 명명되었다.
바이러스 배터리[편집]

안젤라 벨처 (Angela Belcher)교수
바이러스는 유전자 정보가 담긴 물질을 단백질 껍질이 둘러싸고 있는 간단한 구조로 구성되어 있다.
MIT의 안젤라 벨처 교수 연구팀은 2006년 사이언스지에 바이러스로 합성한 이차전지 개념을 제시하였으며 2009년 MIT와 KAIST 공동연구진이 10나노미터에 불과한 M13 바이러스의 유전자를 조작해 고효율의 양극재료를 대량 생산하고 여기에 전기전도도가 우수한 탄소나노튜브(CNT)를 붙여 고출력 리튬 이차전지를 만드는데 성공했다고 발표했다. 2013년에는 유전자 변형 바이러스를 이용해 효율이 최대 3배 좋은 리튬공기전지용 나노촉매를 만드는 데 성공했다고 네이처 커뮤니케이션즈에 발표했다.
리튬공기전지는 현재 흔히 쓰이는 리튬이온전지보다 에너지 저장 효율이 최대 2~3배 좋을 것으로 기대되는 차세대 2차전지다. 화학적으로 안정되고 충전과 방전을 수천 번 반복할 수 있는 전극 재료를 개발하는 것이 상용화의 관건이다.[1]
참고자료[편집]
같이 보기[편집]
|
  이 단백질 문서는 원소에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요. 이 단백질 문서는 원소에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요.
|
| 산업 : 산업, 산업혁명, 기술, 제조, 기계, 전자제품, 정보통신, 반도체, 화학, 바이오, 건설, 유통, 서비스, 에너지, 전기, 소재, 원소 □■⊕, 환경, 직업, 화폐, 금융, 금융사, 부동산, 부동산 거래, 부동산 정책, 아파트, 건물, 토지
|
|
|
| 원소
|
갈륨 • 경수소 • 구리 • 규소 • 금 • 금속 • 금속이온 • 나트륨(소듐) • 나트륨이온 • 납 • 네오디뮴 • 네온 • 니켈 • 동소체 • 동위원소 • 라돈 • 라듐 • 란타넘 • 란타넘족 • 루비듐 • 루테늄 • 리튬 • 리튬메탈 • 리튬이온 • 마그네슘 • 망가니즈(망간) • 바나듐 • 바나듐이온 • 방사성 동위원소 • 백금 • 베릴륨 • 붕소 • 브로민 • 비소 • 비철금속 • 사마륨 • 산소 • 삼중수소 • 세슘 • 셀레늄 • 수소 • 수소이온 • 수은 • 스칸듐 • 아르곤 • 아연 • 아연이온 • 아이오딘(요오드) • 악티늄 • 악티늄족 • 안정 동위원소 • 알루미늄 • 염소 • 오가네손 • 우라늄 • 원소 • 원자 • 은 • 인 • 저마늄(게르마늄) • 전이금속 • 전이후금속 • 제논 • 족 • 주기 • 주기율표 • 주석 • 준금속 • 중금속 • 중수소 • 지르코늄 • 질소 • 철 • 초우라늄 • 카드뮴 • 칼륨(포타슘) • 칼슘 • 코발트 • 코페르니슘 • 크로뮴(크롬) • 크립톤 • 타이타늄(티타늄) • 탄소 • 탄소-14 • 텅스텐 • 토륨 • 팔라듐 • 플루오린 • 플루토늄 • 할로젠(할로겐) • 핵종 • 헬륨 • 헬륨3 • 황
|
|
|
| 화합물
|
LNO • pH • 갈륨비소 • 강 • 강철 • 경수 • 고분자 • 공유결합 • 과산화수소 • 과산화은 • 그래핀 • 금속결합 • 금속산화물 • 뉴세라믹 • 단백질 • 단일결합 • 두랄루민 • 디메틸 카보네이트 • 리튬 니켈 산화물 • 리튬산화물 • 리튬인산철 • 리튬 코발트 산화물 • 리튬 티타늄 산화물 • 메탄올 • 메탈실리콘 • 메테인 • 무기화합물 • 무쇠(주철) • 무수수산화리튬 • 물 • 반응식 • 벤젠 • 분자 • 분자량 • 분자식 • 불소 • 불화리튬(플루오린화 리튬) • 불화수소 • 붕산리튬 • 뷰텐(부틸렌) • 비금속 • 산 • 산성 • 산화물 • 산화은 • 산화제 • 산화철 • 산화칼슘 • 산화코발트 • 삼중결합 • 삼중수 • 선철 • 설탕 • 세라믹 • 셀룰로이드 • 소금 • 수산화나트륨 • 수산화니켈 • 수산화리튬 • 수산화물 • 수산화아연 • 수산화이온 • 수산화칼륨 • 수산화칼슘 • 수산화코발트 • 수증기 • 순물질 • 순철 • 실리카(이산화규소) • 실리콘 (규소) • 실험식 • 아미노산 • 아세테이트 • 아세트산 • 아세틸렌 • 아이소프렌(이소프렌) • 아크릴로나이트릴 • 알칼리 • 알칼리성 • 알코올 • 암모니아 • 얼음 • 에탄올 • 에테인 • 에틸렌 • 에틸렌 카보네이트 • 연철 • 염 • 염기 • 염기성 • 염산 • 염화나트륨 • 염화마그네슘 • 염화비닐라이덴 • 염화수소 • 염화칼륨 • 염화칼슘 • 올레핀 • 옹스트롬 • 요소 • 요소수 • 유기화합물 • 유리탄소 (free carbon) • 유리탄소 (glassy carbon) • 이산화망가니즈 • 이산화탄소 • 이산화티타늄 • 이소부틸렌(아이소뷰텐) • 이오노머 • 이온결합 • 이중결합 • 인산 • 인산리튬 • 인산염 • 인산철 • 인조흑연 • 일산화탄소 • 전기화학반응 • 중수 • 증류수 • 질산 • 질산나트륨 • 질산염 • 질산칼륨 • 질화리튬 • 질화물 • 천연흑연 • 청동 • 초분자 • 카르빈 • 카보네이트(탄산염) • 카본블랙 • 탄산 • 탄산나트륨 • 탄산리튬 • 탄산에틸렌 • 탄산이온 • 탄산칼륨 • 탄산칼슘 • 탄소강 • 탄소나노튜브 • 탄소화합물 • 탄화규소 • 탄화수소 • 특수강 • 페놀 • 페라이트 • 페로브스카이트 • 폴리부틸렌 • 폴리아미드 • 풀러렌 • 프로포폴 • 프로필렌 • 하이니켈 • 합금 • 홑원소물질 • 화학 • 화학결합 • 화학반응 • 화학반응식 • 화학식 • 화합물 • 환원제 • 황동 • 황산 • 황산니켈 • 황산망간 • 황산코발트 • 황화리튬 • 황화물 • 흑린 • 흑연
|
|
|
| 위키 : 자동차, 교통, 지역, 지도, 산업, 기업, 단체, 업무, 생활, 쇼핑, 블록체인, 암호화폐, 인공지능, 개발, 인물, 행사, 일반
|
|
| 생활 : 음식 □■⊕, 반찬, 후식, 의복, 주택, 여가, 관광지, 한국관광지, 세계관광지
|
|
|
| 음식
|
감칠맛 • 건강식품 • 구내식당 • 단맛 • 단백질 • 디너파티 • 레스토랑 • 레시피 • 만찬 • 맛 • 매운맛 • 메뉴 • 메뉴판 • 메인요리 • 바 • 발효 • 발효음식 • 밥집 • 배달음식 • 불포화지방 • 뷔페 • 비타민 • 서빙 • 설거지 • 소스 • 술집 • 스탠딩파티 • 식당 • 식료품 • 식사 • 식이섬유 • 식재료 • 식품 • 신맛 • 쓴맛 • 아침식사 • 양식 • 영양 • 영양분 • 영양사 • 요리 • 요리사 • 음식 • 음식점 • 이유식 • 일식 • 저녁식사 • 전채 • 점심식사 • 정식 • 조리 • 조찬모임 • 주방장 • 중식 • 지방 • 짠맛 • 찜 • 철분 • 케이터링 • 콜레스테롤 • 탄수화물 • 포화지방 • 핑거푸드 • 한식 • 함바집 • 홀서빙 • 회식
|
|
|
| 밥과 죽
|
가츠동 • 곡식 • 곤드레밥 • 국밥 • 굴국밥 • 규동 • 기장밥 • 김밥 • 김치가츠동 • 김치볶음밥 • 끼니 • 나물밥 • 누룽지 • 닭죽 • 더운밥 • 덮밥 • 도시락 • 돈까스카레밥 • 돌솥비빔밥 • 돼지국밥 • 리소토(리조또) • 메밀 • 밥 • 백반 • 보리 • 보리밥 • 볶음밥 • 부타동 • 비빔밥 • 삼선볶음밥 • 소머리국밥 • 솥밥 • 순대국밥 • 시래기국밥 • 쌀 • 쌀밥 • 쌀죽 • 쌈밥 • 야채죽 • 약밥 • 양장피 • 어죽 • 에비동 • 영양밥 • 오곡 • 오곡밥 • 오니기리 • 옥수수 • 우거지국밥 • 육수 • 율무밥 • 잡곡 • 잡곡밥 • 잣죽 • 장어덮밥 • 전복죽 • 전주비빔밥 • 조 • 조밥 • 주먹밥 • 죽 • 집밥 • 짜장밥 • 찬밥 • 찹쌀 • 찹쌀밥 • 초밥 • 충무김밥 • 카레밥 • 컵밥 • 콩나물국밥 • 콩밥 • 타락죽 • 텐동 • 팥죽 • 편의점 도시락 • 한솥밥 • 햇반 • 현미 • 현미밥 • 호밀 • 호박죽 • 회덮밥
|
|
|
| 면과 만두
|
가락국수 • 간짜장 • 갈비만두 • 건면 • 고기만두 • 골뱅이소면 • 국수 • 군만두 • 기스면 • 김치만두 • 김치말이국수 • 김치우동 • 나가사키짬뽕 • 냉면 • 닭국수 • 당면 • 돈코츠라멘 • 떡국 • 떡만둣국 • 떡볶이 • 라멘 • 라면 • 라면사리 • 라자냐 • 막국수 • 만두 • 만둣국 • 메밀국수 • 메밀면 • 면 • 묵밥 • 묵사발 • 물냉면 • 물만두 • 밀면 • 비빔국수 • 비빔냉면 • 삼선짜장 • 새우만두 • 생면 • 소면 • 소바 • 수제비 • 스파게티 • 쌀국수 • 안동국수 • 열무국수 • 옹심이 • 왕만두 • 우동 • 울면 • 유산슬 • 잔치국수 • 잡채 • 조랭이떡국 • 중화냉면(중국냉면) • 진주냉면 • 짜장라면 • 짜장면 • 짬뽕 • 쫄면 • 찐만두 • 초계국수 • 칼국수 • 컵라면 • 콩국수 • 튀김만두 • 파스타 • 팟타이 • 평양냉면 • 함흥냉면 • 해물짬뽕 • 회냉면
|
|
|
| 빵
|
건빵 • 꽃빵 • 난 • 단팥빵 • 도넛 • 마늘빵 • 바게트 • 반미 • 밥버거 • 베이글 • 발효빵 • 부리토 • 빵 • 샌드위치 • 소금빵 • 소보로빵 • 술빵 • 식빵 • 찐빵 • 카스텔라(카스테라) • 케사디야(퀘사디아) • 크루아상 • 크림빵 • 타코 • 토스트 • 파이 • 팥빵 • 페이스트리 • 피자 • 햄버거 • 호밀빵 • 호빵
|
|
|
| 위키 : 자동차, 교통, 지역, 지도, 산업, 기업, 단체, 업무, 생활, 쇼핑, 블록체인, 암호화폐, 인공지능, 개발, 인물, 행사, 일반
|
|
| 산업 : 산업, 산업혁명, 기술, 제조, 기계, 전자제품, 정보통신, 반도체, 화학, 바이오 □■⊕, 건설, 유통, 서비스, 에너지, 전기, 소재, 원소, 환경, 직업, 화폐, 금융, 금융사, 부동산, 부동산 거래, 부동산 정책, 아파트, 건물, 토지
|
|
|
| 바이오
|
BT • 그린바이오 • 레드바이오 • 바이오 • 바이오닉스 • 생명공학 • 생화학 • 화이트바이오
|
|
|
| 바이오기술
|
DNA • 감염 • 감염병 • 게놈 • 균 • 노화 • 노화시계 • 단백질 • 단일세포 • 대체육 • 디지털 치료제 • 마이크로바이옴 • 면역 • 면역세포 • 미생물 • 미세플라스틱 • 바이러스 • 배양 • 배양세포 • 배양육 • 백신 • 생물 • 생물학 • 생체 • 세균 • 세포 • 신경 • 신경세포 • 신약 • 신약개발 • 암백신 • 약 • 약물 • 약품 • 약학 • 역노화 • 영양 • 오가노이드 • 유기체 • 유전 • 유전공학 • 유전자 • 유전자가위 • 유전자편집 • 의약품 • 인공단백질 • 인공심장 • 인공장기 • 임상 • 임상시험 • 장기 • 줄기세포 • 펩티드 • 합성생물학 • 항생제 • 항체 • 핵산 • 효소
|
|
|
| 바이오산업
|
바이오경제 • 바이오공정 • 바이오기기 • 바이오 나노로봇 • 바이오농업 • 바이오 빅데이터 • 바이오산업 • 바이오서비스 • 바이오 서비스산업 • 바이오센서 • 바이오식품 • 바이오 식품산업 • 바이오에너지 • 바이오 에너지산업 • 바이오 의료기기 • 바이오 의료기기산업 • 바이오의약 • 바이오 의약산업 • 바이오자원 • 바이오 자원산업 • 바이오장비 • 바이오전자 • 바이오제품 • 바이오 헬스케어 • 바이오화학 • 바이오 화학산업 • 바이오환경 • 바이오 환경산업 • 보건의료산업 • 플랫폼 바이오
|
|
|
| 바이오 자원과 제품
|
농약 • 바이오농약 • 바이오디젤 • 바이오매스 • 바이오메탄올 • 바이오비료 • 바이오소재 • 바이오에탄올 • 바이오연료 • 바이오오일 • 바이오플라스틱 • 바이오항생제 • 바이오화장품
|
|
|
| 한국 바이오 회사
|
HK이노엔 • JW중외제약 • SK바이오사이언스 • SK바이오팜 • 광동제약 • 녹십자 • 대웅제약 • 대원제약 • 동국제약 • 동아에스티 • 동아제약 • 동화약품 • 보령 • 삼성바이오로직스㈜ • 삼진제약 • 셀트리온 • 셀트리온제약 • 에스티팜 • 유한양행 • 일동제약 • 일양약품 • 제뉴원사이언스 • 제일약품 • 종근당 • 파마리서치 • 한국유나이티드제약 • 한국휴텍스제약 • 한독 • 한미약품 • 휴온스
|
|
|
| 세계 바이오 회사
|
BMS • GSK • MSD • 노바티스 • 로슈 • 사노피 • 아스트라제네카 • 얀센 • 애브비 • 화이자
|
|
|
| 위키 : 자동차, 교통, 지역, 지도, 산업, 기업, 단체, 업무, 생활, 쇼핑, 블록체인, 암호화폐, 인공지능, 개발, 인물, 행사, 일반
|
|

 위키원
위키원