"흡열반응"의 두 판 사이의 차이
(새 문서: 썸네일|300픽셀|'''흡열반응'''(吸熱反應, endothermic reaction) '''흡열반응'''(吸熱反應, endothermic reaction)은 반응 시 주위에...) |
잔글 (→같이 보기) |
||
| 39번째 줄: | 39번째 줄: | ||
== 같이 보기 == | == 같이 보기 == | ||
| + | * [[흡열]] | ||
| + | * [[반응]] | ||
* [[발열반응]] | * [[발열반응]] | ||
* [[화학반응]] | * [[화학반응]] | ||
{{에너지|검토 필요}} | {{에너지|검토 필요}} | ||
2024년 11월 7일 (목) 23:50 기준 최신판
흡열반응(吸熱反應, endothermic reaction)은 반응 시 주위에서 열을 흡수하는 반응이다. 계의 엔탈피는 증가하여 ΔH > 0 이다. 에너지가 계에 쓰이는 반응이라고 해석할 수 있다. 그래서 결합이 끊어지거나 할 때 흡열 반응이 일어난다.
개요[편집]
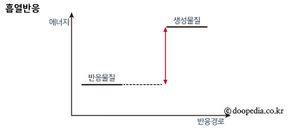
흡열반응은 반응물질의 에너지가 상대적으로 작고 생성물질의 에너지가 큰 경우로, 이 반응이 일어나려면 어떤 물질이 주위로부터 열에너지를 흡수해야 한다. 이 반응은 반응시 열을 방출하는 발열반응의 역반응이기도 하다.
흡열반응은 화학에서 계가 열을 흡수함으로써 진행되는 반응이다. 흡열 반응에 의해서 주위는 열을 뺏기고, 열이 반응에 사용됨에 따라서 생성물의 엔탈피는 반응물에 비하여 증가한다. 대표적인 흡열 반응으로는 융해와 기화 반응이 존재한다. 이때 전체적인 계의 온도는 대체로 내려가게 되므로, 인간은 땀의 기화를 통해서 체온을 조절할 수 있다.
병원 응급실에 고열환자가 오면 먼저 응급조치로 몸에 알코올을 묻힌다. 액체상태의 알코올을 몸에 묻히면 알코올이 기화해 날아가면서 몸에 있는 열을 빼앗아 체온이 내려가기 때문이다. 액체알코올이 기화하여 기체가 되는 반응은 주위로부터 열을 흡수하는 반응이고, 이러한 반응을 흡열반응이라 한다.
흡열반응의 원리[편집]
화학에서 에너지란 물질이 가진 고유한 특성이다. 모든 물질은 에너지를 가지고 있으며 그 양은 서로 다르다. 물질에 화학적 변화가 발생하면 에너지의 증감이 수반된다. 만약 반응물질의 에너지가 상대적으로 작고, 생성하고자 하는 물질의 에너지가 크다면 그 차이만큼의 에너지를 주위로부터 얻어와야 반응이 진행된다. 흡열반응은 이처럼 반응물이 가진 내부에너지보다 생성물이 가진 내부에너지가 커 주위로부터 열에너지를 흡수하면서 진행되는 반응이다. 반대로 반응물질의 에너지가 생성물의 에너지보다 커 열을 주위로 방출하면서 진행되는 반응은 발열반응이라 한다. 흡열반응의 역반응은 발열반응이며, 발열반응의 역반응은 흡열반응이다.
특징[편집]
압력이 일정한 화학 반응에서는 dG=dH-TdS이므로 dH가 0보다 클 때 자발적이라면 항상 엔트로피는 증가한다.
화학 평형의 관점에서 볼 때 열을 가해주면 흡열반응 쪽으로 정반응 우세가 된다.
당연하지만 흡열반응의 역반응은 발열 반응이다.
흡열반응의 이용[편집]
이러한 원리는 얼음팩과 같이 낮은 온도의 물질을 만드는 데 이용된다. 얼음팩은 액체와 고체가 따로 들어 있는 두 개의 칸으로 이루어져 있는데, 팩을 구부러트려 액체와 고체가 서로 만나게 하면 반응이 진행된다. 이 때 일어나는 반응이 흡열반응이기 때문에 반응물들은 주위의 열을 흡수하여 생성물을 만든다. 이렇게 열을 빼앗겨 온도가 낮아지면서 차가운 얼음이 만들어진다.
흡열반응과 온도의 관계[편집]
흡열반응은 주변의 온도를 높일수록 수월하게 진행된다. 염화암모늄, 질산암모늄 등 일반적으로 고체물질들은 용해과정이 흡열반응이다. 따라서 반응이 진행될수록 주변의 온도가 낮아지고, 주변으로부터 열을 흡수하기가 점점 어려워진다. 이때 온도를 높여주면 열을 흡수하는 것이 쉬워져 용해반응이 잘 일어난다. 또한 반응속도의 관점에서, 온도가 오르면 속도가 빨라져 더 빨리 녹는 효과도 있다. 즉 흡열반응에서 온도를 높여주면 더 많은 생성물을 빠르게 얻을 수 있다.
흡열반응과 발열반응의 차이점[편집]
흡열반응과 발열반응의 가장 큰 차이점은 에너지가 이동하는 방향이다. 흡열반응은 에너지를 흡수하여 주변 환경의 온도를 낮추고, 발열반응은 에너지를 방출하여 주변 환경의 온도를 높인다. 이러한 에너지 이동은 화학 반응의 결과물의 안정성과 반응의 속도에도 영향을 미친다.
응용[편집]
제일 유명하고 널리 쓰이는 흡열반응은 역시 냉매를 이용한 것, 즉 에어컨과 냉장고의 냉각 원리에 쓰이는 반응이다.
참고자료[편집]
- 〈흡열 반응〉, 《위키백과》
- 〈흡열반응〉, 《두산백과》
- 〈흡열 반응〉, 《나무위키》
- 리아, 〈발열반응과 흡열반응의 원리와 차이점, 예시를 통한 깊이 있는 탐구〉, 《네이버 블로그》, 2024-06-20
같이 보기[편집]

 위키원
위키원