증류
증류(蒸餾, distillation)는 액체 혼합물(액체에 액체가 혼합된 경우 혹은 고체 용질이 균일하게 녹아있는 용액)을 끓는점 차이를 이용하여 분리하는 방법이다. 증류를 통해 순수한 액체 물질을 얻을 수도 있고 (예: 바닷물을 끓인 후 식혀서 마실 물 얻기), 액체 물질의 순도를 조절할 수 있다(증류주의 알코올 함량을 높이는 방법). 증류는 다양한 산업 분야에서 널리 이용되는 중요한 분리 방법이고, 화학 조성을 변화시키지 않고 물리적인 성질을 이용해 분리하는 방법이다.
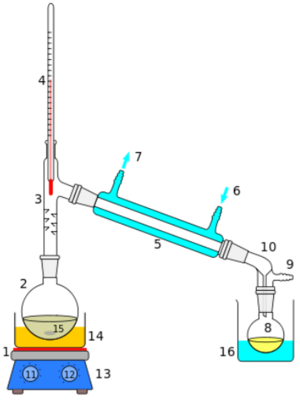
증류는 현재 화학공업에서 매우 중요한 방법의 하나이다. 증류장치에는 관(罐 ; 가마) · 응축기(凝縮器) · 회수기(回收器) 등 세 부분이 필요하다. 관은 원료액을 넣고 가열하는 것, 응축기는 발생한 증기로부터 열을 빼앗아 액화(液化)시키는 것, 회수기는 응축한 액체를 거두어 담는 것이다.
개요
증류는 상대휘발도(끓는점)의 차이를 이용하여 액체 상태의 혼합물을 분리하는 방법이다. 두 혼합물의 화학 반응 없이 물리적인 분리가 이루어지는 경우를 말한다.
영리적인 목적의 증류는 석유를 증류하여 휘발유, 경유, 등유와 같은 여러 종류의 연료로 분리하는 데에서부터, 공기를 증류하여 아르곤과 같은 특수한 기체를 얻는 데 이르기까지 광범위하게 사용된다.
고체와 액체의 혼합물은 무게, 입자의 크기, 용해도의 차이 등을 이용하여 분리시킬 수 있지만 물과 에틸알코올처럼 액체와 액체의 혼합물을 분리시킬 때나 소금물에서 물만을 분리해내는 경우 등은 다른 방법이 필요하다. 물질은 각각 일정한 끓는점을 가지고 있다. 따라서, 끓는점의 차이가 있는 혼합물을 가열하면 끓는점이 낮은 것이 먼저 증기가 되어 나오므로 이것을 냉각시켜 액체로 환원하여 모으면 분리시킬 수 있다. 이것을 증류라고 한다. 물의 끓는점은 1기압하에서 100°C, 메탄올(메틸알코올)은 64.7°C이므로 이 혼합물을 기열하면 메탄올이 먼저 증기가 되어 나온다. 단, 물도 다소 섞여 나오므로 한번의 증류로 완전히 분리하기는 어렵다. 처음에는 메탄올의 끓는점 부근의 온도 범위 내에서 나오는 증기를 모으고, 이것을 몇 번 되풀이하여 증류하면 차차 순수한 것을 얻을 수 있다. 이것을 재증류라고 한다. 증류의 초기에 나오는 증기에는 휘발성이 큰 불순물이나 증류 장치 내의 불순물이 섞여서 나오므로 이 부분을 버린다. 이것을 전류분이라고 한다. 또, 증류 플라스크 속의 액체를 완전히 증류하면 남아 있는 비휘발성인 불순물이 섞여 나올 가능성이 있으므로 조금 남겨서 버린다. 이것을 후류분이라고 한다.
기본 원리
예컨대 끓는점이 낮은 성분 A와 끓는점이 높은 성분 B로 이루어진 2성분계(成分系)의 혼합용액을 플라스크에 넣고 가열, 발생시킨 증기를 응축기에서 응축시키면 그 성분은 처음의 혼합용액보다 끓는점이 낮은 액체(따라서 휘발성이 풍부한 액체)로 되는 것이 보통이고, 플라스크 안에 남은 액체는 끓는점이 높아 잘 휘발하지 않는 성분이 많아진다.
이처럼 A, B의 휘발도의 차이를 이용, 증발 · 응축을 함께 해 혼합용액을 휘발하기 쉬운 부분과 잘 휘발하지 않는 부분으로 나눌 수 있다.
응축해서 얻은 액체를 유분(溜分) 또는 증류분, 증발하지 않고 남은 부분을 관잔(罐殘) 또는 잔류분이라 한다.
혼합증기가 일부분 응축하면, 생성된 액체상(液體相)과 잔존하는 기체상의 조성이 달라진다. 즉, 액체상은 원래의 혼합증기보다 끓는점이 높은 성분이 많아지고, 기체상은 끓는점이 낮은 성분이 많아진다. 이와 같이 일부분을 응축시켜 끓는점이 낮은 성분의 상대농도를 증가시키는 조작을 분축이라 한다.
분축에서 생긴 액체상을 다시 새로운 증기와 접촉시켜 증류하는 것을 정류(精溜)라고 한다.
증류의 역사
기원전 2000년경 오늘날의 이라크 지역인 메소포타미아의 바빌로니아에서 초기 증류 장치가 사용되었다.[2] 기원전 500년경 파키스탄에서 알코올의 분리를 위해 사용된 증류 장치가 발굴되기도 하였다. 증류기술이 고대 그리스에 전달된 것을 기원후 1세기 경으로 이후 그리스에서는 대량의 증류주가 제조되었다.
보다 완벽한 증류를 위한 개선은 8세기경의 중세 이슬람 화학자들에 의해 이루어졌다. 그들은 순수한 알코올과 에스터와 같은 물질의 공업적 정제를 위해 증류를 사용하였다. 중세 이슬람 화학자 중 한 사람인 자비르 이븐 하이얀이 고안한 여러 실험 도구와 방법들은 오늘날에도 여전히 사용된다.[5] 증류를 통하여 순수한 알콜을 증류한 최초의 화학자는 아부 유수프 야쿱 이븐 이샤크 알 킨디였다. 페르시아의 화학자 무함마드 이븐 자칼리야 알 라지는 세계 최초로 석유에서 등유를 증류하였다. 11세기 초 이븐 시나는 정유(精油)를 정제하기 위해 수증기 증류법을 사용하였다.
이후 12세기경 중세 유럽에 증류 기술이 전파되었다. 15세기 독일의 연금술사 브라운쉬바이그는 《증류 기술》을 저술하였다. 1512년 출판된 이 책은 증류만을 독자적으로 다룬 최초의 책으로 이후 여러 판본으로 번역되었다.
증류 기술의 발전은 증류주의 생산을 촉진시켰고 거대한 증류기를 이용한 스카치 위스키, 코냑, 데킬라, 보드카 등의 생산이 이어졌다.
증류법
① 분별증류(分別蒸溜) : 다성분의 혼합물을 가열해 끓는점마다 각각 회수기를 받쳐 성분을 분별, 채취하는 방법이다.
② 진공증류 : 압력이 보통 수 torr(토르 ; 1torr는 대략 수은주 1㎜의 압력)에서 수십torr 정도에서 이루어지는 증류이므로, 진공증류라기보다「감압증류」라고 하는 편이 옳다. 수류(水流)펌프 등을 이용해 실험실에서 흔히 이루어지지만, 공업적으로는 장치가 대규모적이어서 그다지 사용되지 않는다.
③ 수증기증류 : 물과는 전혀 혼합되지 않는 성분과 물의 혼합계와 평형을 이루는 증기압은 양쪽의 순수성분 증기압의 합이 된다. 이 합이 대기압과 같아지면 끓게 된다. 예컨대 물과 테레빈유(油)의 혼합물에 가열수증기를 불어넣으면 두 성분의 혼합물이 기화하므로 응축시켜 분리한다. 끓는점이 높아 가열해야만 분리되는 것도 비교적 저온으로 정제할 수 있다.
④ 분해증류 : 석유를 크래킹 했을 때의 생성물은 그 자체가 고온이므로 곧바로 정류탑으로 이끌어 증류조작을 한다. 그 조작을 분해증류라고 한다.
⑤ 추출증류 : 끓는점이 비슷한 성분의 혼합물에 사용되는 증류법이다. 공비(共沸)증류와는 달리 휘발성이 작은 제3의 성분을 첨가해 한 쪽의 증기압을 크게 내려 분리한다.
⑥ 평형(平衡)증류 : 플래시 증류라고도 한다. 반드시 성분의 분리를 목적으로 하지는 않고, 용액을 증기와 액체로 급속히 분리하는 방법이다. 고온으로 가열한 액체의 일부를 증기와 함께 채취해 감압하면, 용액은 자신의 증기와 평형을 유지하면서 급속히 증발한다. 석유공업에서의 파이프스틸 외에 해수의 탈염(脫鹽)이나 폐액의 처리 등에도 이용된다.
⑦ 공비증류 : 보통 증류로는 분리하기 어려운 혼합물을 분리할 때 제3의 성분을 첨가해 공비혼합물을 만들어 증류에 의해 분리하는 방법이다. 96% 에탄올에 벤젠을 첨가해 증류탈수를 하는 것이 그 좋은 예이다.
⑧ 정밀증류 : 다단(多段)의 정류탑을 사용, 약간의 끓는점의 차이를 이용해 혼합물 속의 성분을 분리하는 방법이다.
⑨ 비비등(非沸騰)증류 : 증류는 정제를 목적으로 하는데, 증류의 효율상 관의 내용물을 끓여 증기를 대량으로 생성시키는 조건에서 하는 것이 보통이다. 끓는점 이하에서도 어느 정도 높은 증기압을 가진 물질이면, 증기를 응축시킴으로써 정제도를 향상시킬 수 있다. 원자흡광(吸光) 등 고감도의 분석법에 사용되는 물 및 시약(試藥)의 조제에 흔히 사용되는 방법이다.
⑩ 분자(分子)증류 : 보통의 진공증류법으로는 증류할 수 없는, 끓는점이 높은 것에도 응용할 수 있는 증류법이다. 압력을 10~100μtorr(마이크로토르)로 해서 가열한다. 액면과 냉각면의 간격을 분자의 평균자유행로(平均自由行路 ; 계속되는 충돌 사이에 비상할 수 있는 거리의 평균)보다 작게 하면, 액면에서 일산(逸散)한 분자는 거의 다 냉각면에 보수(補修)되어 액화 · 응축이 일어난다. 평균자유행로는 분자량과 압력의 함수이므로 압력과 간격을 조정함으로써 다른 성분과의 분리가 가능해진다. 좀처럼 기화하지 않는 고분자 물질의 증류정제나, 고온에서 쉽게 분해되는 지용성(脂溶性) 비타민류의 증류 등에 사용된다.
원유의 증류
지각 속에서 얻어지는 원유는 천연가스, 나프타, 휘발유, 중유, 등유 등이 섞여 있는 혼합물이기 때문에, 대형 증류탑을 통해 분리하게 된다. 원유를 증류탑에 공급하고 가열해주면, 증류탑의 가장 높은 곳에서는 끓는점이 가장 낮은 LPG 등의 가스가 분리되고, 그 아래층에서는 가솔린이 분리된다. 증류탑의 아래로 내려올수록 끓는점이 증가하는 순서에 따라 나프타, 등유, 경유, 중유 등의 분리 되고, 가장 아랫부분에서 기화되지 않는 찌꺼기들인 아스팔트 성분이 남는다.
증류를 통한 바닷물의 분리
바닷물의 경우, 플라스크에 담아 가열하면 100℃가 조금 넘는 온도에서 물이 끓기 시작한다. 소금은 무려 800℃ 근처에서 녹고, 기화되려면 그보다 훨씬 높은 온도가 필요하기 때문에 100℃ 근처에서는 기화될 염려가 없다. 물은 기화하여 수증기가 되고 리비히냉각기 안의 유리관을 지나게 된다. 그러나 주변에 차가운 물이 흐르고 있기 때문에 금방 다시 액화되어 물이 된다. 삼각플라스크가 리비히냉각기보다 낮은 위치에 있기 때문에 물은 자연스럽게 아래쪽에 있는 삼각플라스크로 흘러 들어가게 되고, 바닷물로부터 순수한 물을 얻게 된다. 우리가 흔히 말하는 증류수는 바로 이러한 증류방법을 이용해 얻은 순수한 물을 말한다.
증류주
증류주는 발효로 얻은 양조주(또는 발효주)를 증류하여 알코올의 함량을 높인 술을 말한다. 양조주를 서서히 끓이게 되면 에탄올이 더 낮은 온도에서 끓기 때문에 주 성분인 에탄올의 증기가 발생하게 되고, 이를 냉각시켜 에탄올의 함량이 높은 술을 얻을 수 있다. 위스키, 브랜디, 진, 럼, 테킬라 등이 증류주의 범주에 속한다.
참고자료
같이 보기

 위키원
위키원