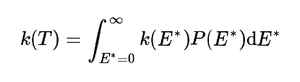열분해
열분해(熱分解, pyrolysis, thermal decomposition)는 물질에 높은 온도로 가열하여 일어나는 화학물질의 분해 반응을 가리킨다. 열분해는 일반적으로 430 °C (800 °F) 이상의 온도에서 운영된다. 이 용어의 영어 낱말 pyrolysis는 그리스어에서 파생한 형태소 pyr("불")과 lysis(분리)에서 만들어졌다.
나무를 태워 발생하는 열에너지는 열분해 반응의 대표적인 예이다.
목차
개요
열분해는 열에너지에 의해 일어나는 분해 반응이며, 분자의 내부 에너지가 특정 결합의 분해에 필요한 활성화 에너지보다 크면 그 결합이 분해될 수 있다. 그러나 실제 분해가 일어나는 속도는 여러 가지 요인에 의해서 달라질 수 있다. 열적 평형 상태의 물질에서 활성화 에너지보다 큰 에너지를 가진 분자의 비율은 활성화 에너지와 열에너지의 상대적 비율에 따라서 결정된다.
겉보기에 안정하게 보이는 물질은 대부분 결합 에너지와 활성화 에너지가 충분히 크기 때문에 상온에서는 활성화 에너지보다 큰 에너지를 가지는 분자의 비율이 매우 작다. 열분해가 일어나려면 그 비율이 충분히 클 정도로 온도가 높아야만 한다.
예를 들어 과산화 수소의 산소-산소 결합은 비교적 약한 결합이기 때문에 상온에서의 열에너지만으로도 분해가 잘 일어난다. 더욱이 이산화 망간과 같은 촉매를 사용하면 분해가 훨씬 더 빠르게 일어난다. 반면에 물에서 산소-수소의 결합 에너지는 상온의 열에너지보다 훨씬 더 크기 때문에 물은 상온에서 열분해되지 않는다.
처리
수많은 산업에서 이러한 처리는 430 °C (806 °F) 이상에서 이루어진다. 농업 쓰레기의 경우 일반적인 온도는 450 ~ 550 °C (840 ~ 1,000 °F)이다.
열분해 반응의 속도
린데만 메커니즘, RRKM 메커니즘 등의 단분자 반응(unimolecular reaction) 이론으로 특정 에너지 E*' 에 있어 분해가 일어날 때 반응 속도 상수 k(E*)를 계산할 수 있다. 또한 열에너지의 분포를 고려하면 특정 온도 T에서 열분해 반응이 일어나는 속도 상수 k(T)를 계산할 수 있다. 열분해 반응의 속도 상수가 매우 작은 경우에는 반응이 실질적으로 일어나지 않는다. 속도 상수가 충분히 큰 경우에만 열분해 반응이 일어난다.
- RRKM 이론
특정 에너지를 가진 분자의 단분자 반응속도를 계산하기 위한 이론이다. 이 이론의 개발자인 라이스(Oscar K. Rice), 램스퍼거(Herman C. Ramsperger), 카셀(Louis S. Kassel), 마커스(Rudolph A. Marcus)의 머리글자를 따서 RRKM 이론이라고 부른다. 어떤 분자가 특정 에너지 E*를 가지고 있을 때, 그 에너지에서 특정 결합이 분해되는 반응의 속도 상수 k(E*)'를 아래와 같이 계산할 수 있다.
k(E*)= W(E⁺)/hN*(E*)
여기서 E⁺는 총 에너지에서 분해 반응의 활성화 에너지를 뺀 잉여 에너지, W(E⁺)는 E⁺에서 가지고 있는 상태의 개수, h는 플랑크 상수, N*(E*)는 E⁺에서 상태 밀도(density of state, 단위 에너지 당 상태의 개수)이다. RRKM 이론에 따르면 총 에너지 E⁺가 클수록 분해 반응의 속도가 빨라진다.
- 특정 온도에서 열분해 반응의 속도
앞에서 계산한 k(E*)'에 그 에너지를 가질 확률인 볼츠만 분포 P(E*)를 곱해 모든 에너지에 대해 더해주면, 특정 온도 T에서의 속도 상수 k(T)를 계산할 수 있다. 어떤 계가 특정 온도 T로 표시할 수 있는 에너지 분포를 가지고 있을 때, 이 계에서 분해 반응이 진행되는 속도 상수가 k(T)이다. 온도 T가 높아질수록 더 큰 E⁺를 가지는 (따라서 반응 속도가 빠른) 분자들의 분포가 많아지므로, 온도가 높을수록 열분해 반응이 더 잘 일어난다.
열분해의 예
- 열분석법
열분해 반응을 이용하는 열 무게 분석법(thermal gravimetry)을 이용하면 분석 대상의 물리적 화학적 성질을 알 수 있다.
- 크래킹
원유를 분해해서 화학 산업의 주요 원료를 얻어내는 크래킹(cracking)은 대표적인 열분해 반응이다.
- 합성 가스
석탄이나 바이오매스를 열분해하여 메테인(CH4) 등의 합성가스(syngas)를 생산한다.
- 불
- 요리
- 나무를 숯으로 전환
- 코크스화
- 탄소 섬유
- 생물체 원료
- 플라스틱 쓰레기 처리
열분해 기술
친환경 소각 기술의 등장
열분해 소각 기술은 1960년대 초 미국에서 대기정화법(The Clean Air Act)이 발효되면서 기존 대기오염 발생 문제를 소각공정자체에서 최소화하기 위해 사용되기 시작했습니다. 폐기물을 투입-건조-건류 및 열분해 소각공정을 거치는 1차 열분해와 이 때 발생된 열분해 건류가스를 완전 소각시키는 2차 연소로 구분돼 있다. 열분해는 처음 열을 가할 때 별도의 에너지를 사용하는 것 외에는 오염물질이 나오지 않으며 잔류 소각재가 거의 발생하지 않아 친환경 소각 기술로 평가받고 있다.
폐플라스틱 열분해 유화기술
열분해를 이용한 폐플라스틱 유화기술은 오일쇼크가 있었던 1970년 대 초 폐기물을 통해 에너지를 회수하기 위한 목적으로 연구가 시작됐습니다. 최근 유가가 상승하면서 폐플라스틱의 유화기술에 더욱 관심이 높아졌다. 열분해유화기술은 폐플라스틱, 폐타이어, 폐비닐, 폐유, 폐고무 등 고문자 폐기물을 무산소 조건 하에 외부에서 열을 가하는 열분해 반응을 통해 액체연료로 변환시키는 방법이다. 열분해과정에서 다이옥신과 같은 유해물질이 발생하지 않고 폐기물이 발생하지 않아 친환경적이며 경제적인 재활용 기술이라 할 수 있다.
열분해 수소생산
지난 2019년 독일 마드리드 폴리텍 대학에서 천연가스를 고온으로 가열하는 열분해 기술을 이용해 수소를 처음 생산했는데 부산물로 고체 형태의 탄소만을 배출해 환경오염이 없고, 배출된 탄소는 전기자동차 배터리 제조 등에 이용이 가능해 친환경 수소생산 기술로 주목받았다. 국내에서도 폐플라스틱을 열분해해서 가스를 생산하고, 열분해 가스를 수소로 개질하는 기술을 개발하고 있다.
동영상
참고자료
- 〈열분해〉, 《위키백과》
- 〈열분해〉, 《화학백과》
- 한화솔루션 블로거, 〈쉽게 이해하는 화학용어 ① 열분해 기술 우리가 몰랐던 과학 이야기 (215)〉, 《세계일보》, 2023-11-15
같이 보기

 위키원
위키원