콜라겐
콜라겐(collagen)은 단백질의 일종으로서, 교원질(膠原質) 또는 아교질이라고 부르기도 한다.
목차
개요
콜라겐은 동물의 신체에 다양한 결합조직 (Connective tissues)의 세포밖 공간을 채우는 주요 조직 형성 단백질이다. 포유동물에서는 전체 단백질의 25 %에서 35 %를 차지하는 가장 풍부한 단백질이기도 하다. 무기화작용 (Mineralization)의 정도에 따라, 뼈에서처럼 단단하거나, 힘줄에서처럼 유연하거나, 연골에서 보이듯 단단한 부분부터 유연한 부분까지 구배되기도 한다. 콜라겐은 매우 긴 피브릴 (Fibril)의 형태로서, 힘줄이나, 인대, 피부와 같은 섬유조직 (Fibrous tissues)에서 흔히 찾아볼 수 있고, 각막, 연골, 뼈, 혈관, 소화관, 척추사이원반 (Intervertevral discs), 치아의 상아질에서도 발견된다. 근육조직에서는 근내막 (endomysium)의 주요 요소이다. 콜라겐은 근육조직의 1~2 %를 차지하고 강하고 힘줄이 많은 근육에서는 6 % 정도를 차지한다. 체내에서 가장 흔한 세포인 섬유아세포 (fibroblasts)가 콜라겐을 생성 분비한다. 요리, 혹은 식품과 의약산업에서 널리 이용되는 젤라틴은 콜라겐을 비가역적으로 가수분해 한 것이다 (시중에서 판매하는 젤라틴의 상당수는 돼지가죽, 뼈, 힘줄등을 물리/화학적으로 처리하여 만든다. 아이스크림, 젤리, 푸딩 등을 만드는 재료이고 의약 캡슐의 원료로도 사용된다. 그래서, 어떤 의약제나 건강보조식품 등의 설명서를 읽어보면 '동물유래'라고 표시 되어 있는 경우, 젤라틴 원료 의약 캡슐을 사용했기 때문일 수 있다.
특징
콜라겐 단백질은 여러 종류로 구분되어 있다. 현재까지 모두 28종류의 콜라겐 단백질이 발견되었으며, 그 중 인간에게서 흔히 볼 수 있는 것은 5종류이다. 종류에 따라 뼈나 피부, 연골, 결합 조직 등을 구성한다. 동물의 가죽이나 생선의 비늘도 콜라겐으로 이루어진 것이다. 또한 사람 눈을 이루는 안구의 성분, 특히 흰자위의 주성분도 콜라겐이다.
콜라겐은 일반적으로 물에 잘 녹지 않으며, 산이나 염기처리와 함께 가열하면 분해되어 젤라틴으로 변한다. 콜라겐과 젤라틴은 투명도에서 큰 차이가 있으며 콜라겐은 자기조립이 가능한 단백질이기 때문에 물 속에서 하이드로젤 상태를 이룬다. 젤라틴에 불순물이 섞인 것을 아교라고 부른다.
구조
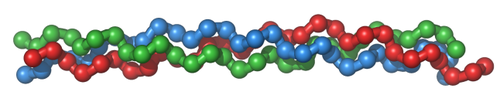
글리신, 하이드록시 라이신, 하이드록시 프롤린이 반복되는 구조를 지니며 type I, type II, type Ⅳ, type V를 포함하여 6종류 이상이 발견되어 왔다. 특히 라이신과 프롤린은 하이드록시레이스에 의해 수산화기가 붙기 때문에 강력한 수소결합을 형성한다. 해당 효소의 보효소가 아스코르빈산, 즉 비타민C이기 때문에 비타민C결핍의 증상으로 콜라겐 조직 약화가 관찰되며, 대개 콜라겐이 풍부한 혈관의 붕괴가 우선적으로 일어난다. 이와 관련된 유명한 질병이 바로 괴혈병.
세 종류의 아미노산이 반복된 사슬을 alpha chain이라 부르며, alpha chain 세 가닥이 감긴 것을 triple helix라고 부른다. 일반적으로 이 triple helix 끼리 가교 결합이 일어나면서 콜라겐의 복잡한 구조가 형성된다.
우리가 잘 모르는 사실이지만, 콜라겐은 자기 조립에 의한 복잡한 구조를 가지고 있고 생체 조직의 구조적 지지체 역할만이 아니라 세포의 분화, 부착, 이동에 중추적인 역할을 맡고 있다. 콜라겐이 만드는 독특한 사슬 구조는 second harmonic generation이라는 비선형광학적 현상을 보인다. 특히 type Ⅳ 콜라겐은 빗해파리나 해면 같은 최초의 동물들에게 공통적으로 발견되어 깃편모충이 콜라겐 Ⅳ를 합성하여 세포끼리 붙들면서 다세포 동물이 출현한것으로 보인다. 사실상 동물의 진화에 엄청난 역할을 한 셈.
콜라겐의 종류
인체 내 콜라겐의 90% 이상이 I형이지만, 2011년 현재 28종의 콜라겐이 형성되는 구조에 따라 식별이 되어 여러 그룹으로 나뉘어져 있다:
- Fibrillar
타입 I, II, III, V, XI
- Non-fibrillar
- Non-fibrillar FACIT (파쇄 트리플 헬기가 장착된 파이브릴 관련 콜라겐)(타입 IX, XII, XIV, XIX, XXI)
- 쇼트 체인(타입 VIII, X)
- 기저막(Basement membrane , 타입 IV)
- Multiplexin (멀티플렉스 , 인터럽션이 있는 다중 트리플 헬릭스 도메인, 타입 XV, XVIII)
- MACIT(막연관, Membrane Associated Collagens with interrupted Triple Helices, Type XIII, XVII)
- 기타(Type VI, VII)
가장 일반적인 다섯 가지 유형은 다음과 같다.
- ① I형 : 피부, 힘줄(tendon), 혈관계(vasculature), 장기, 뼈(뼈의 유기부분의 주성분)
- ② II형 : 연골(cartilage, 연골 주성분)
- ③ III형: 망상섬유(reticulate, 망상섬유 주성분), 일반적으로 유형 I과 함께 발견됨
- ③ IV형 : basal lamina 기저막의 상피막(basal lamina) 밀봉층을 형성한다.
- ⑤ V형: 세포 표면, 머리카락 및 태반
생합성
유전자 발현
대략 34 개의 콜라겐 형성 유전자가 존재하는데 특정 알파 펩타이드 (대게는 a 1,2,3) 형성에 관련된 유전자들이 mRNA를 전사 생성 발현으로부터 생합성이 시작된다.
프리-프로-펩타이드 형성
생성된 mRNA들은 세포질로 이동하여 리보좀과 결합, 펩타이드를 만드는 번역과정으로 들어간다. 막 생성된 단백질의 N-말단에는 신호펩타이드가 존재하여 mRNA와 리보좀이 결합된 번역기관을 소포체 (Endoplasmic reticulum)로 이동하게 하고 합성되는 프리-프로-펩타이드는 소포체 안으로 들어가게되고 번역후변형을 거쳐 프리-프로-콜라겐이 된다.
프리-프로-펩타이드에서 프로-콜라겐으로 전환
프리-프로-펩타이드에 3가지 번역후변형이 일어나 알파 펩타이드를 형성하게 한다.
(1) 신호펩타이드가 잘려나가면 프로펩타이드가 된다.
(2) 라이실 수산화 효소 (lysyl hydroxylase)와 프롤릴 수산화 효소 (prolyl hydroxylase)에 의하여 라이신 (lysine)과 프롤린(prolines)이 수산화 (hydroxylation)되면 알파 펩타이드의 교차연결 (cross-linking)이 일어나게 된다. 이 들 효소 반응은 비타민 C를 보조인자로 사용한다. 비타민 C 부족으로 괴혈병에 걸리면 프롤린과 라이신의 수산화가 잘 일어나지 않아 3개의 알파 펩타이드로 형성되는 3중나선이 느슨하게 조립되어 콜라젠 구조가 부실하게 된다 (그림 1). 그 결과 모세혈관이 약해져 피멍이 잘 들고, 특히 잇몸이 피가 나며 물러져 치아를 유실하는 결과를 낳게된다.
(3) 포도당이나 갈락토스 1개가 생성된 수산화라이신 (hydroxylysine)의 수산기에 공유결합하는 당화 (Glycosylation)가 일어난다. 수산화프롤린(hydroxyproline)에는 일어나지 않는다.
번역후 변형이 완료된 후, 3개의 수산화/당화된 프로펩타이드가 꼬여 3중나선의 프로콜라겐이 되는데, 프로콜라겐의 말단은 풀려있어서 나중에 자려나가면서 다듬어진다. 말단이 풀린 프로콜라겐은 이동막낭 안으로 포장되어 골지체로 옮겨가게 된다.
골지체에서의 변형
골지체에 도착한 프로콜라젠은 올리고당화 과정을 거치게 되고 이제 세포밖으로 나가는 분비막낭 안으로 포장된다.
트로포콜라겐 (Tropocollagen)
세포밖으로 분비된 프로콜라겐은 세포막에 연결된 콜라겐분해효소 (collagen peptidases)의 작용을 받아 느슨한 말단이 제거된 후 트로포콜라겐이 된다. 이 단계를 담당하는 유전자의 기능이 결여되면 피부가 지나치게 늘어나고, 취약하며, 잦은 출혈과 함께 관절 및 내장 기관의 선천성 이상을 수반하는 엘러스-단로스 증후근 (Ehlers-Danlos syndrome)을 보이게 된다.
콜라겐 피브릴 형성
세포외 구리이온의존성 효소인 라이실 산화 효소가 라이신과 수산화라이신에 작용하여 알데히드기 (carbonyl group)를 생성 알라이신 (allysine), 트로포콜라겐 사이에 공유결합이 일어나도록 한다. 이러한 트로포콜라겐의 고분자형태를 콜라젠 피브릴이라고 한다
분해
콜라겐은 특유의 구조 때문에 이론적으론 장기간 분해되지 않으나, 생체 내에선 노화와 같은 여러 요소로 분해가 촉진된다. 자연 노화 외의 요인으로는 첫 번째로 자외선이 있다. 자외선을 받으면 피부 섬유아세포는 콜라겐 합성을 멈춘다. 자외선은 또한 바로 뒤에 나오는 MMP(matrix metalloproteinase)의 합성을 촉진하는 작용도 한다. 두 번째로는 콜라겐 등을 분해하는 단백질 분해효소 MMP의 활성도가 있다. MMP는 수십 가지 종류가 있으며 각각의 효소는 서로 다른 특이성을 보인다. 가장 처음으로 콜라겐을 분해하기 시작하는 효소는 MMP-1이며, 피부가 노화됨에 따라 MMP-1의 합성량이 많아진다.
콜라겐 용도
- 심장에 응용(Cardiac applications
4개의 심장 판막 고리를 포함하는 콜라겐 심장 골격은 조직학적으로 탄력적이며 고유하게 심장 근육에 결합되어 있다. 또한 심장의 골격에는 심실 분리격막, 즉 심실사이의 격막 및 심방실 분리도 포함된다. 콜라겐의 지지로 심방세동은 결코 심실세동까지 악화되지 않는다. 콜라겐은 심장근육 질량에 따라 가변 밀도로 층층이 쌓인다. 콜라겐의 질량, 분포, 나이, 밀도는 모두 혈액을 앞뒤로 움직이는데 필요한 순응에 기여한다. 콜라겐 내의 점진적인 칼슘 축적은 노화의 자연적 함수로 일어난다.
- 성형(cosmetic surgery)
콜라겐은 뼈의 재건을 위한 화상 환자와 다양한 치과, 정형외과, 외과적 목적을 위한 치료 보조제로, 성형수술에 널리 이용되어 왔다. 인간과 소의 콜라겐은 모두 주름 치료와 피부 노화를 위한 피부 필러로 널리 사용된다.
일부 관심 포인트는 다음과 같다.
- 화장품으로 사용할 경우, 알레르기 반응이 장기간의 홍조를 일으킬 가능성이 있지만, 이것은 사용 전에 간단하고 눈에 띄지 않는 패치 테스트를 통해 사실상 제거될 수 있다.
- 대부분의 의료용 콜라겐은 인증된 광우병 없는 동물에서 나온 어린 소(보바인)에서 유래한다. 대부분의 제조업체는 호주, 브라질, 뉴질랜드와 같이 광우병에 걸린 것으로 보고된 적이 없는 국가 또는 "폐쇄된 가축"의 기증 동물을 사용한다.
- 뼈 이식(Bone grafts)
뼈골격은 신체의 구조를 형성하므로, 골절과 부상 후에도 힘을 유지하는 것이 필수적이다. 콜라겐은 3중 나선 구조를 가지고 있어 뼈 이식에 사용되어 매우 강한 분자를 형성한다. 골격의 구조적 무결성을 훼손하지 않기 때문에 뼈에 사용하기에 이상적이다. 콜라겐의 3중 나선 구조는 효소에 의해 분해되는 것을 방지하고, 세포의 접착력을 가능하게 하며 세포외 매트릭스의 적절한 조립에 중요하다.
- 조직 재생(Tissue engineering)
콜라겐 스캐폴드는 스폰지, 얇은 시트, 젤 등의 여러 가지 형태로 조직 재생에 사용된다. 콜라겐은 모공 구조, 투과성, 소수성, 생체내 안정성과 같은 조직 재생에 적합한 성질을 가지고 있다.
콜라겐 스캐폴드는 골아(骨芽)세포(osteoblast), 섬유아세포(fibroblasts) 등 세포의 침전에도 이상적이며, 일단 삽입하면 조직 내에서도 정상적인 성장을 계속할 수 있다.
- 복원수술용(Reconstructive surgical uses)
콜라겐은 심한 화상과 상처의 관리에 사용되는 인공 피부의 대체물을 만드는 데 널리 이용되고 있다. 이러한 콜라겐은 소, 말, 돼지 또는 심지어 인간에서 파생될 수 있으며, 실리콘, 글리코사미노글리칸, 섬유아세포(fibroblasts), 성장 인자 및 기타 물질과 함께 사용되기도 한다.
- 상처치료(Wound care)
콜라겐은 신체의 주요 천연자원 중 하나이며 상처 치유 과정의 모든 단계에 도움을 줄 수 있는 피부조직의 성분이다. 상처부위에 콜라겐을 사용하면 잘 아물게 할 수 있다. 따라서 때로는 절단 수술과 같은 절차에 따라 발생하는 상처가 심해지는 것을 피할 수 있다. 콜라겐은 천연 원료로서 상처 드레싱으로 사용되며 인공 상처 드레싱에는 없는 특성을 가지고 있다. 그것은 상처 드레싱에서 매우 중요한 박테리아에 대해 내성이 있다. 그것은 감염과 싸우는 자연적인 능력 때문에 상처를 소독하는 데 도움이 된다. 콜라겐을 화상 드레싱으로 사용하면 건강한 육아조직(granulation tissue, 肉芽組織)이 화상 위에서 매우 빠르게 형성되어 빠르게 치유되도록 도와준다.
상처치유의 4단계에서 콜라겐은 상처치유에서 다음과 같은 기능을 수행한다.
① 가이드 기능( Guiding function)
- 콜라겐 섬유는 섬유질을 유도하는 역할을 한다.
- 섬유질은 결합조직 매트릭스를 따라 이동한다.
② 화학 특성(Chemotactic properties)
- 콜라겐 섬유에서 이용할 수 있는 넓은 표면적은 치유를 돕는 섬유소 세포를 끌어들일 수 있다.
③ 핵화(Nucleation)
- 콜라겐은, 특정한 중성염분자가 존재하는 경우, 섬유질 구조를 형성하는 핵물질로 작용할 수 있다.
- 콜라겐 상처 드레싱은 새로운 콜라겐 퇴적과 모세혈관 성장을 위한 지침이 될 수 있다.
④ 혈류 특성(Hemostatic properties)
- 혈소판은 콜라겐과 상호 작용하여 지혈 플러그를 만든다.
- 보충제(supplement)
가수분해 되면 콜라겐을 작은 펩타이드로 변하며 관절과 뼈 건강을 돕고 피부 건강을 증진시킬 목적으로 식이 보충제나 기능성 식품과 음료의 형태로 섭취할 수 있다. 가수 분해 콜라겐은 토종 콜라겐이나 젤라틴에 비해 분자량이 훨씬 적다. 가수 분해된 콜라겐은 90% 이상이 소화되어 1시간 이내에 혈류에서 작은 펩타이드로 이용된다고 한다. 혈액에서 펩타이드(hydroxyproline 포함)는 표적 조직(예: 피부, 뼈, 연골)으로 운반된다. 펩타이드가 국소 세포의 구성 요소 역할을 하고 새로운 콜라겐 섬유 생성을 촉진하는 데 도움이 된다고 알려져 있다.
- 기초연구(Basic research)
콜라겐은 실험실에서 세포행동과 세포 외 환경과의 상호작용 연구를 위한 세포 배양에 사용이 된다.
- 수의학적 용도(Veterinary use)
골관절염이 있는 개들에 대한 콜라겐 보충제의 효능을 단독으로 또는 글루코사민이나 콘드로이틴과 같은 약효식품(nutraceuticals)들과 결합하여 보여주었다.
기능
콜라겐은 피부 수분 양에 관여하기 때문에 콜라겐이 풍부한 음식을 섭취하면 피부 노화, 관절 약화, 혈관 손상을 방지할 수 있다고 흔히 알려져 있다. 하지만 실제 섭취 및 경구 투여 시에는 단백질 분해 과정을 통해 글라이신, 프롤린 등의 아미노산들로 분해된 후 흡수되기 때문에, 부족한 콜라겐을 섭취를 통해 보충하려면 콜라겐 합성에 필요한 비타민 A나 비타민 C, 철 등을 추가로 같이 섭취함이 그나마 바람직하다. 또한 피부에 바르는 제품으로 콜라겐 분자나 섬유 자체가 첨가된 제품도 시장에 있으나, 단백질은 고분자이기 때문에 피부를 투과하지 못해 이 역시 큰 효과를 보지 못할 가능성이 높다. 최근에는 점막에 필름 형태로 붙임으로써 이를 극복하는 것을 목표로 연구가 진행되고 있다.
다만, 콜라겐 섬유 대신 콜라겐의 생성 촉진제나 분해 억제제를 첨가한 제품도 있다. 피부에 레티놀과 비타민 C 등을 도포했을 때 피부의 콜라겐 함량이 증가하는 것을 이용하는 화장품에 이 성분들이 들어간다. 최근에는 콜라겐 분해 촉진 효소의 분비를 억제하는 성분을 도입하여 피부의 콜라겐 함량이 유지되도록 하는 쪽으로도 연구가 진행되고 있다.
이외에도 일시적인 피부 주름 개선을 위해 콜라겐을 직접 주입하는 방법도 쓰이고 있으나, 이렇게 주입된 콜라겐은 수개월 후 피부에서 분해되기 때문에 반복적인 시술을 할 수 밖에 없다고 알려져 있다.
요리
콜라겐은 요리에서 중요한 역할을 하는 성분이기도 하다. 콜라겐을 추출하여 만든 젤라틴은 젤리를 만드는 등 응고제로 다양하게 쓰인다. 한국음식 중 족발, 사골 국물, 닭발, 돼지껍데기, 도가니탕 등 뼈, 관절, 피부를 재료로 한 음식에 많이 포함되어 있다. 또한 다양한 형태의 영양제 성분으로 많이 섭취하기도 한다. 피부 뿐만 아니라 관절, 손발톱, 머리카락 등 전신으로 흡수된다. 콜라겐은 무게감과 점성 등 입 안에서 느끼는 질감을 결정하는 데에 중요한 요소이다.
참고자료
- 〈콜라겐〉, 《나무위키》
- 〈아교질〉, 《위키백과》
- 〈콜라겐〉, 《분자·세포생물학백과》
- 〈콜라겐〉, 《화학백과》
- 〈콜라겐〉, 《생화학백과》
- 구름바다, 〈콜라겐이란? 종류, 응용 및 특성〉, 《네이버 블로그》, 2019-08-25
같이 보기

 위키원
위키원