|
|
| (같은 사용자의 중간 판 2개는 보이지 않습니다) |
| 1번째 줄: |
1번째 줄: |
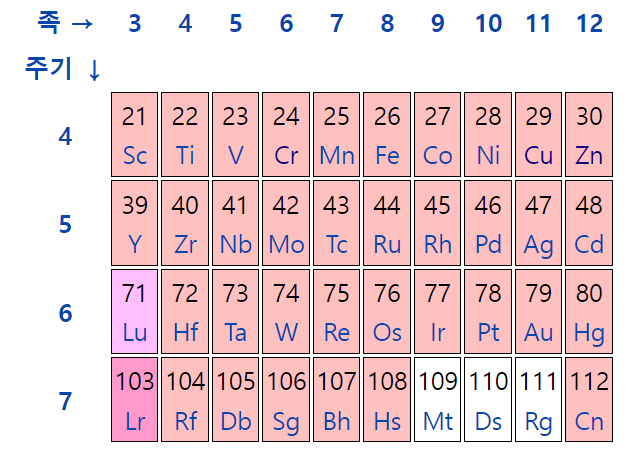
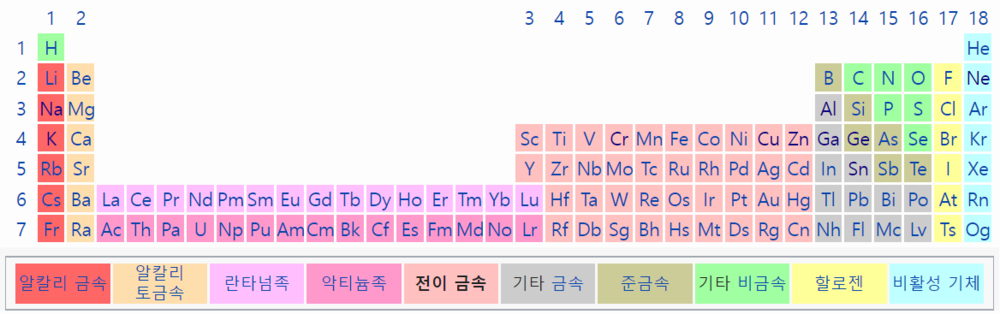
| − | '''전이금속'''(transition metal, 轉移金屬)<!--전이 금속, 전이 원소, 전이원소--> 또는 '''전이원소'''(transition element, 轉移元素)는 [[주기율표]]의 d-구역 [[원소]]를 말한다. 주기율표의 3족에서 12족 원소가 모두 포함된다. 전이금속이라는 이름은 원소들을 분류하던 초기에 원자번호 순으로 원소를 나열하면 이 원소들이 전형 원소로 전이되는 중간단계 역할을 한다 하여 붙여진 이름이다. 전이금속은 착화합물을 만든다. 결정장 이론과 리간드장 이론이 착화합물의 화학을 설명한다. | + | '''전이금속'''(transition metal, 轉移金屬)<!--전이 금속, 전이 원소, 전이원소--> 또는 '''전이원소'''(transition element, 轉移元素)는 [[주기율표]]의 d-구역 [[원소]]를 말한다. 주기율표의 3족에서 12족 원소가 모두 포함된다. 전이금속이라는 이름은 [[원소]]들을 분류하던 초기에 [[원자번호]] 순으로 원소를 나열하면 이 원소들이 전형 원소로 전이되는 중간단계 역할을 한다 하여 붙여진 이름이다. 전이금속은 [[착화합물]]을 만든다. 결정장 이론과 리간드장 이론이 착화합물의 화학을 설명한다. |
| | | | |
| | {{자세히|주기율표}} | | {{자세히|주기율표}} |
| | == 전이금속의 특성 == | | == 전이금속의 특성 == |
| − | 전이금속은 주기율표에서 4~7주기, 3~12족 까지의 원소들을 말한다. 때문에 다른 원소들의 경우 한 주기에서 주족 원소의 화학적 성질이 원자가 전자의 수가 변화함에 따라 크게 변하지만, 전이 금속들은 주어진 족에서 뿐만 아니라 같은 주기에서도 많은 유사성을 보여준다. 그 중에서도 첫 주기 전이 금속인 스칸듐에서 아연까지는 다른 전이 금속 계열을 대표하는 아주 중요한 금속 원소이다. | + | 전이금속은 [[주기율표]]에서 4~7주기, 3~12족 까지의 원소들을 말한다. 때문에 다른 원소들의 경우 한 주기에서 주족 원소의 화학적 성질이 원자가 전자의 수가 변화함에 따라 크게 변하지만, 전이금속들은 주어진 족에서 뿐만 아니라 같은 주기에서도 많은 유사성을 보여준다. 그 중에서도 첫 주기 전이금속인 [[스칸듐]]에서 [[아연]]까지는 다른 전이금속 계열을 대표하는 아주 중요한 [[금속]] 원소이다. |
| | * '''전자 배치''' | | * '''전자 배치''' |
| − | 보통은 4주기 원소들의 전자배치는 4s 오비탈에 먼저 채워지고 그 후에 3d 오비탈이 채워진다. 이 상태에서 다시 전자를 빼내려고 할 때에는 3d오비탈의 전자들에 의한 가리움 효과에 의해 4s의 에너지 준위가 높아져 먼저 빠져나간다. | + | 보통은 4주기 원소들의 전자배치는 4s [[오비탈]]에 먼저 채워지고 그 후에 3d 오비탈이 채워진다. 이 상태에서 다시 전자를 빼내려고 할 때에는 3d오비탈의 전자들에 의한 가리움 효과에 의해 4s의 에너지 준위가 높아져 먼저 빠져나간다. 하지만 예외적으로 [[크로뮴]](Cr)은 [Ar] 4s^1 3d^5이고, [[구리]](Cu)는 [Ar] 4s^1 3d^10이다. 이 예외를 설명하기 위한 방법으로는 먼저 4s와 3d오비탈은 에너지 준위가 비슷하여 훈트의 규칙을 따라 홀전자가 최대가 되게 하는 쪽으로 된다고 해석한다. |
| − | 하지만 예외적으로 크로뮴(Cr)은 [Ar] 4s^1 3d^5이고, 구리(Cu)는 [Ar] 4s^1 3d^10이다. 이 예외를 설명하기 위한 방법으로는 먼저 4s와 3d오비탈은 에너지 준위가 비슷하여 훈트의 규칙을 따라 홀전자가 최대가 되게 하는 쪽으로 된다고 해석한다. | |
| | | | |
| | * '''환원전위''' | | * '''환원전위''' |
| − | 원자번호가 커질수록 대체적으로 환원전위가 증가한다. 대부분의 4주기 전이금속들은 음수의 값을 갖고 있고, 예외적으로 구리(Cu)만 양수 값을 갖고 있다. 따라서 Cu를 제외한 다른 것들은 수소이온과 만나 수소기체를 형성하고 만약 여러 전이금속이 있다면 환원/산화 전위가 클수록 그 반응이 우선적으로 반응한다.
| + | [[원자번호]]가 커질수록 대체적으로 환원전위가 증가한다. 대부분의 4주기 전이금속들은 음수의 값을 갖고 있고, 예외적으로 구리(Cu)만 양수 값을 갖고 있다. 따라서 Cu를 제외한 다른 것들은 수소이온과 만나 수소기체를 형성하고 만약 여러 전이금속이 있다면 환원/산화 전위가 클수록 그 반응이 우선적으로 반응한다. |
| | | | |
| | * '''산화수''' | | * '''산화수''' |
| − | 전이 금속은 1가지 이상의 산화 상태를 갖고 있다. 스칸듐(Sc)부터 망가니즈(Mn)까지는 전자를 4s, 3d에서 모두 빼낼 수 있어 최대 산화수가 각각 3, 4, 5, 6, 7이고, 철부터는 유효핵전하가 증가해 에너지 준위가 상대적으로 높은 4s의 전자들만 빠지고 3d의 전자들은 쉽게 빠져나가지 못한다. 그래서 철부터 아연까지는 주로 2+의 산화수를 갖게 된다.
| + | 전이금속은 1가지 이상의 [[산화]] 상태를 갖고 있다. [[스칸듐]](Sc)부터 [[망가니즈]](Mn)까지는 [[전자]]를 4s, 3d에서 모두 빼낼 수 있어 최대 산화수가 각각 3, 4, 5, 6, 7이고, 철부터는 유효핵전하가 증가해 에너지 준위가 상대적으로 높은 4s의 전자들만 빠지고 3d의 전자들은 쉽게 빠져나가지 못한다. 그래서 철부터 아연까지는 주로 2+의 산화수를 갖게 된다. |
| | | | |
| | * '''란타넘족 수축''' | | * '''란타넘족 수축''' |
| − | 원자의 크기는 내부의 전자에 의한 가리움효과에 의해 바깥 전자들이 중심에서 멀어지고, 원자 사이즈가 커진다. 하지만 5d 이후 4f오비탈의 전자가 5d오비탈 안의 원자와 비슷한 에너지 준위를 갖고 있어, 5d가 큰 가리움 효과를 크게 주지 못하고 원자번호가 증가할수록 유효핵전하가 계속 커져 전체적으로 중심방향으로 수축하게 된다. | + | 원자의 크기는 내부의 전자에 의한 가리움 효과에 의해 바깥 전자들이 중심에서 멀어지고, 원자 사이즈가 커진다. 하지만 5d 이후 4f오비탈의 전자가 5d오비탈 안의 원자와 비슷한 에너지 준위를 갖고 있어, 5d가 큰 가리움 효과를 크게 주지 못하고 원자번호가 증가할수록 유효핵전하가 계속 커져 전체적으로 중심방향으로 수축하게 된다. |
| | | | |
| | == 전이금속의 이온화 == | | == 전이금속의 이온화 == |
| − | 전이 금속은 특이하게도 이온화 되는 과정에서4s 오비탈의 에너지가 3d 오비탈의 에너지보다 상당히 높아진다. 이로 인해 중성원자 상태에서 에너지 준위가 3d 보다 낮았던 4s 오비탈에서 전자가 먼저 나가게 된다.
| + | 전이금속은 특이하게도 [[이온화]]되는 과정에서4s 오비탈의 에너지가 3d 오비탈의 에너지보다 상당히 높아진다. 이로 인해 중성원자 상태에서 에너지 준위가 3d 보다 낮았던 4s 오비탈에서 전자가 먼저 나가게 된다. |
| | | | |
| | === 전이금속의 착이온 === | | === 전이금속의 착이온 === |
| 33번째 줄: |
32번째 줄: |
| | | | |
| | == 같이 보기 == | | == 같이 보기 == |
| | + | * [[전이]] |
| | * [[금속]] | | * [[금속]] |
| | * [[전이후금속]] | | * [[전이후금속]] |
| 38번째 줄: |
38번째 줄: |
| | * [[주기율표]] | | * [[주기율표]] |
| | | | |
| − | {{배터리|검토 필요}} | + | {{원소|검토 필요}} |
| | + | {{화학}} |
전이금속(transition metal, 轉移金屬) 또는 전이원소(transition element, 轉移元素)는 주기율표의 d-구역 원소를 말한다. 주기율표의 3족에서 12족 원소가 모두 포함된다. 전이금속이라는 이름은 원소들을 분류하던 초기에 원자번호 순으로 원소를 나열하면 이 원소들이 전형 원소로 전이되는 중간단계 역할을 한다 하여 붙여진 이름이다. 전이금속은 착화합물을 만든다. 결정장 이론과 리간드장 이론이 착화합물의 화학을 설명한다.
 주기율표에 대해 자세히 보기
주기율표에 대해 자세히 보기
전이금속의 특성[편집]
전이금속은 주기율표에서 4~7주기, 3~12족 까지의 원소들을 말한다. 때문에 다른 원소들의 경우 한 주기에서 주족 원소의 화학적 성질이 원자가 전자의 수가 변화함에 따라 크게 변하지만, 전이금속들은 주어진 족에서 뿐만 아니라 같은 주기에서도 많은 유사성을 보여준다. 그 중에서도 첫 주기 전이금속인 스칸듐에서 아연까지는 다른 전이금속 계열을 대표하는 아주 중요한 금속 원소이다.
보통은 4주기 원소들의 전자배치는 4s 오비탈에 먼저 채워지고 그 후에 3d 오비탈이 채워진다. 이 상태에서 다시 전자를 빼내려고 할 때에는 3d오비탈의 전자들에 의한 가리움 효과에 의해 4s의 에너지 준위가 높아져 먼저 빠져나간다. 하지만 예외적으로 크로뮴(Cr)은 [Ar] 4s^1 3d^5이고, 구리(Cu)는 [Ar] 4s^1 3d^10이다. 이 예외를 설명하기 위한 방법으로는 먼저 4s와 3d오비탈은 에너지 준위가 비슷하여 훈트의 규칙을 따라 홀전자가 최대가 되게 하는 쪽으로 된다고 해석한다.
원자번호가 커질수록 대체적으로 환원전위가 증가한다. 대부분의 4주기 전이금속들은 음수의 값을 갖고 있고, 예외적으로 구리(Cu)만 양수 값을 갖고 있다. 따라서 Cu를 제외한 다른 것들은 수소이온과 만나 수소기체를 형성하고 만약 여러 전이금속이 있다면 환원/산화 전위가 클수록 그 반응이 우선적으로 반응한다.
전이금속은 1가지 이상의 산화 상태를 갖고 있다. 스칸듐(Sc)부터 망가니즈(Mn)까지는 전자를 4s, 3d에서 모두 빼낼 수 있어 최대 산화수가 각각 3, 4, 5, 6, 7이고, 철부터는 유효핵전하가 증가해 에너지 준위가 상대적으로 높은 4s의 전자들만 빠지고 3d의 전자들은 쉽게 빠져나가지 못한다. 그래서 철부터 아연까지는 주로 2+의 산화수를 갖게 된다.
원자의 크기는 내부의 전자에 의한 가리움 효과에 의해 바깥 전자들이 중심에서 멀어지고, 원자 사이즈가 커진다. 하지만 5d 이후 4f오비탈의 전자가 5d오비탈 안의 원자와 비슷한 에너지 준위를 갖고 있어, 5d가 큰 가리움 효과를 크게 주지 못하고 원자번호가 증가할수록 유효핵전하가 계속 커져 전체적으로 중심방향으로 수축하게 된다.
전이금속의 이온화[편집]
전이금속은 특이하게도 이온화되는 과정에서4s 오비탈의 에너지가 3d 오비탈의 에너지보다 상당히 높아진다. 이로 인해 중성원자 상태에서 에너지 준위가 3d 보다 낮았던 4s 오비탈에서 전자가 먼저 나가게 된다.
전이금속의 착이온[편집]
전이금속도 일반금속과 마찬가지로 광택, 전기전도성, 열전도성을 가진다. 그 중에서도 비금속과 함께 이온 결합 화합물을 형성하는데, 이 때 일반금속과는 달리 일정 수의 리간드와 함께 착이온 형태로 존재한다. 때문에 착이온은 전이금속과 리간드간 결합이 이루어져 생성된 이온을 말한다.
전이금속의 오비탈 준위 순서[편집]
전이금속의 오비탈 준위 순서는 일반적으로 알려진 (n-1)p<<ns<(n-1)d,np 와는 달리 d오비탈 붕괴와 스핀오비탈 상호작용 등 몇몇 요인으로 인해 일반적인 전이금속, 즉 (n-1)p⁶이상의 결합한 원자의 원자가 오비탈, p블록과 d블록에서의 올바른 에너지 순서는 (n-1)p<<(n-1)d<ns<np이다.
참고자료[편집]
같이 보기[편집]
|
  이 전이금속 문서는 원소에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요. 이 전이금속 문서는 원소에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요.
|
| 산업 : 산업, 산업혁명, 기술, 제조, 기계, 전자제품, 정보통신, 반도체, 화학, 바이오, 건설, 유통, 서비스, 에너지, 전기, 소재, 원소 □■⊕, 환경, 직업, 화폐, 금융, 금융사, 부동산, 부동산 거래, 부동산 정책, 아파트, 건물, 토지
|
|
|
| 원소
|
갈륨 • 경수소 • 구리 • 규소 • 금 • 금속 • 금속이온 • 나트륨(소듐) • 나트륨이온 • 납 • 네오디뮴 • 네온 • 니켈 • 동소체 • 동위원소 • 라돈 • 라듐 • 란타넘 • 란타넘족 • 루비듐 • 루테늄 • 리튬 • 리튬메탈 • 리튬이온 • 마그네슘 • 망가니즈(망간) • 바나듐 • 바나듐이온 • 방사성 동위원소 • 백금 • 베릴륨 • 붕소 • 브로민 • 비소 • 비철금속 • 사마륨 • 산소 • 삼중수소 • 세슘 • 셀레늄 • 수소 • 수소이온 • 수은 • 스칸듐 • 아르곤 • 아연 • 아연이온 • 아이오딘(요오드) • 악티늄 • 악티늄족 • 안정 동위원소 • 알루미늄 • 염소 • 오가네손 • 우라늄 • 원소 • 원자 • 은 • 인 • 저마늄(게르마늄) • 전이금속 • 전이후금속 • 전형금속 • 제논 • 족 • 주기 • 주기율표 • 주석 • 준금속 • 중금속 • 중수소 • 지르코늄 • 질소 • 철 • 초우라늄 • 카드뮴 • 칼륨(포타슘) • 칼슘 • 코발트 • 코페르니슘 • 크로뮴(크롬) • 크립톤 • 타이타늄(티타늄) • 탄소 • 탄소-14 • 텅스텐 • 토륨 • 팔라듐 • 플루오린 • 플루토늄 • 할로젠(할로겐) • 핵종 • 헬륨 • 헬륨3 • 황
|
|
|
| 화합물
|
LNO • pH • 갈륨비소 • 강 • 강철 • 경수 • 고분자 • 공유결합 • 과산화수소 • 과산화은 • 그래핀 • 금속결합 • 금속산화물 • 뉴세라믹 • 단백질 • 단일결합 • 두랄루민 • 디메틸 카보네이트 • 리간드 • 리튬 니켈 산화물 • 리튬산화물 • 리튬인산철 • 리튬 코발트 산화물 • 리튬 티타늄 산화물 • 메탄올 • 메탈실리콘 • 메테인 • 무기화합물 • 무쇠(주철) • 무수수산화리튬 • 물 • 반응식 • 벤젠 • 분자 • 분자량 • 분자식 • 불소 • 불화리튬(플루오린화 리튬) • 불화수소 • 붕산리튬 • 뷰텐(부틸렌) • 비금속 • 산 • 산성 • 산화물 • 산화은 • 산화제 • 산화철 • 산화칼슘 • 산화코발트 • 삼중결합 • 삼중수 • 상대이온 • 선철 • 설탕 • 세라믹 • 셀룰로이드 • 소금 • 수산화나트륨 • 수산화니켈 • 수산화리튬 • 수산화물 • 수산화아연 • 수산화이온 • 수산화칼륨 • 수산화칼슘 • 수산화코발트 • 수소결합 • 수증기 • 순물질 • 순철 • 실리카(이산화규소) • 실리콘 (규소) • 실험식 • 아미노산 • 아세테이트 • 아세트산 • 아세틸렌 • 아이소프렌(이소프렌) • 아크릴로나이트릴 • 알칼리 • 알칼리성 • 알코올 • 암모니아 • 얼음 • 에탄올 • 에테인 • 에틸렌 • 에틸렌 카보네이트 • 연철 • 염 • 염기 • 염기성 • 염산 • 염화나트륨 • 염화마그네슘 • 염화비닐라이덴 • 염화수소 • 염화칼륨 • 염화칼슘 • 올레핀 • 옹스트롬 • 요소 • 요소수 • 유기화합물 • 유리탄소 (free carbon) • 유리탄소 (glassy carbon) • 이산화망가니즈 • 이산화탄소 • 이산화티타늄 • 이소부틸렌(아이소뷰텐) • 이오노머 • 이온결합 • 이중결합 • 인산 • 인산리튬 • 인산염 • 인산철 • 인조흑연 • 일산화탄소 • 전기화학반응 • 중수 • 증류수 • 질산 • 질산나트륨 • 질산염 • 질산칼륨 • 질화리튬 • 질화물 • 착이온 • 천연흑연 • 청동 • 초분자 • 카르빈 • 카보네이트(탄산염) • 카본블랙 • 킬레이트 • 탄산 • 탄산나트륨 • 탄산리튬 • 탄산에틸렌 • 탄산이온 • 탄산칼륨 • 탄산칼슘 • 탄소강 • 탄소나노튜브 • 탄소화합물 • 탄화규소 • 탄화수소 • 특수강 • 페놀 • 페라이트 • 페로브스카이트 • 폴리부틸렌 • 폴리아미드 • 풀러렌 • 프로포폴 • 프로필렌 • 하이니켈 • 합금 • 홑원소물질 • 화학 • 화학결합 • 화학반응 • 화학반응식 • 화학식 • 화합물 • 환원제 • 황동 • 황산 • 황산니켈 • 황산망간 • 황산코발트 • 황화리튬 • 황화물 • 흑린 • 흑연
|
|
|
| 위키 : 자동차, 교통, 지역, 지도, 산업, 기업, 단체, 업무, 생활, 쇼핑, 블록체인, 암호화폐, 인공지능, 개발, 인물, 행사, 일반
|
|
| 산업 : 산업, 산업혁명, 기술, 제조, 기계, 전자제품, 정보통신, 반도체, 화학 □■⊕, 바이오, 건설, 유통, 서비스, 에너지, 전기, 소재, 원소, 환경, 직업, 화폐, 금융, 금융사, 부동산, 부동산 거래, 부동산 정책, 아파트, 건물, 토지
|
|
|
| 화학
|
생활화학제품 • 화학공업 • 화학교육 • 화학산업 • 화학제품
|
|
|
| 화학 분야
|
계산화학 • 고분자화학 • 고체화학 • 공업화학 • 광화학 • 기초화학 • 녹색화학 • 무기화학 • 물리유기화학 • 물리화학 • 뭉치화학 • 방사화학 • 분광학 • 분석화학 • 생물무기화학 • 생물물리화학 • 생물유기화학 • 생화학 • 석유화학 • 습식화학 • 신경화학 • 약학 • 양자화학 • 열화학 • 우주화학 • 유기금속화학 • 유기화학 • 의약화학 • 이론화학 • 재료과학 • 전기화학 • 정밀화학 • 지구화학 • 초분자화학 • 클릭화학 • 표면과학 • 핵화학 • 화학 • 화학생물학 • 환경화학
|
|
|
| 화학물질
|
결합 • 결합에너지 • 고분자물질 • 공유 • 공유결합 • 광물 • 궤도 • 금속 • 금속결합 • 동위원소 • 리간드 • 무기화합물 • 반응 • 방사선 • 방출 • 배위결합 • 배위화합물 • 분자 • 분자식 • 붕괴 • 산화 • 상대이온 • 수소결합 • 스펙트럼 • 양성자 • 양전하 • 에너지 • 연성 • 원소 • 원자 • 원자궤도 • 원자량 • 원자번호 • 원자핵 • 유기화합물 • 음전하 • 이성질체 • 이온 • 이온결합 • 인공화학물질 • 자유전자 • 전도체 • 전성 • 전이금속 • 전자 • 전하 • 전형금속 • 주기 • 주기율표 • 준금속 • 중성자 • 착이온 • 착화합물 • 천연화학물질 • 초분자 • 초전도체 • 촉매 • 킬레이트 • 탄소 • 탄소고리 • 탄소사슬 • 합성 • 혼합물 • 화학결합 • 화학물질 • 화학반응 • 화합물 • 환원 • 흡수
|
|
|
| 화학 회사
|
SK이노베이션㈜ • 다우케미칼 • 롯데케미칼㈜ • 리옹델바젤 인더스트리 • 린데 • 바스프(BASF) • 사빅 • 엑슨모빌(엑손모빌) • ㈜엘지화학 • 중국석유화공(시노펙) • 페트로차이나 • 포모사플라스틱 • 한화솔루션㈜ • 한화케미칼㈜
|
|
|
| 위키 : 자동차, 교통, 지역, 지도, 산업, 기업, 단체, 업무, 생활, 쇼핑, 블록체인, 암호화폐, 인공지능, 개발, 인물, 행사, 일반
|
|

 위키원
위키원