세포배양

세포배양(細胞培養, Cell culture)은 일반적으로 자연 환경 외부의 통제된 조건에서 세포가 성장하는 과정의 총칭이다. 세포는 살아있는 조직에서 분리된 후에는 신중하게 제어된 조건에서 후속적으로 유지되어야 한다. 이러한 조건은 각 세포 유형에 따라 다르지만 일반적으로 필수 영양소(아미노산, 탄수화물, 비타민, 무기질), 성장인자, 호르몬, 가스(이산화탄소, 산소)를 공급하는 기질 또는 배지가 있는 적합한 용기로 구성된다. 이는 물리화학적 환경(완충 용액, 삼투압, 온도)을 조절할 수 있게 설계되었다. 대부분의 세포는 단층(하나의 단일 세포 두께)으로 부착 배양을 형성하기 위해 표면 또는 인공 기질이 필요한 반면, 어떤 세포는 현탁액 배양으로 배지에 자유롭게 떠서 성장할 수 있다. 대부분의 세포의 수명은 유전적으로 결정되지만 일부 세포 배양 세포는 최적의 조건이 제공되면 무한정 재생되도록 변환되기도 한다.
실제로 세포 배양이라는 용어는 식물 조직 배양, 진균 배양, 미생물 배양의 뜻보다 동물 세포에서 유래된 세포의 배양을 의미한다. 세포 배양의 역사적 발전과 방법은 조직 배양 및 장기 배양 과 밀접한 관련이 있다. 바이러스의 숙주인 세포와 함께 바이러스 배양도 관련이 있다.
개요
세포배양은 생물체로부터 분리한 세포를 분리하여 배양하는 과정. 생체조직을 무균적으로 선발해서 트립신이나 프로나아제 등의 소화효소로 처리하여 단세포로 분리하여 초대배양을 한다. 또 계대중인 세포계나 세포주를 같은 효소처리로 분산시켜 얻어낸 단세포를 증식배지에 이식, 접종하여 다음의 계대배양을 한다. 이와 같이 단백질분해효소 등의 처리로 단세포를 분산해서 배양하는 방법을 세포배양이라 한다.
1900년 초부터 시작한 동물조직의 배양을 조직배양이라고 불러왔다. 이는 생체조직을 무균적으로 선발하여 가위나 면도칼 등으로 가늘게 절단하여 생긴 조직단편들을 배양하거나, 증식한 세포집단을 라버폴리스민 등으로 배양기 벽에서 긁어내어 분상, 계대하였다. 따라서 단세포를 배양하는 것은 아니었다. 1950년대에 들어와서 트립신처리에 의한 세포분산법을 개발하여 소위 세포배양을 시작했다. 세포배양법의 개발은 생체를 구성하고 있던 세포를 단세포생물처럼 취급하는 것이 가능하게 되었다.
이 방법으로 대장균 등에서 얻어낸 지식이나 기술을 기초로 동물세포를 해석하는 흐름을 확립하게 되었다. 이 결과, 세포의 기본적 대사, 증식, 분화, 노화, 발암 바이러스 감염 등을 세포 수준에서 정량적으로 취급할 수 있게 되었다. 세포배양에는 세포가 배양기에 부착하여 증식하는 단층배양과 세포가 부착 · 신전하는 일이 없이 부유 상태로 증식하는 현탁배양이 있다. 또한, 단일의 세포를 배양하여 콜로니를 형성하는 단세포배양이나, 역으로 대량의 세포를 배양하는 대량배양이 있다.
배양된 세포는 상피유사, 섬유아유사, 림프구 상의 형태를 나타낸다. 생체에서 분리, 배양을 시작한 초대배양세포는 정상 2배체 염색체의 염색체구성을 한다. 또한, 초대배양세포는 정상성질을 갖고 있으나 계대함에 따라 증식능, 염색체, 형태 등의 변화(형질변환)를 수반하여 종양성을 갖게 된다. 그 세포의 유래조직에 있던 분화기능은 때로는 소실하기도 한다. 최근에 이 분화기능을 유지한 세포주가 다량으로 수립되고 있다.
역사
19세기 영국의 생리학자 시드니 링거(Sydney Ringer)는 나트륨, 칼륨, 칼슘, 마그네슘의 염화물을 포함한 용액을 개발하여, 몸 밖에서 분리된 동물의 심장이 박동을 유지할 수 있도록 했다. 1885년, 빌헬름 루(Wilhelm Roux)는 배아 닭의 수질판 일부를 제거한 후 따뜻한 식염수에 몇 일 동안 보존하여 조직 배양의 기본 원리를 확립했다. 1907년, 동물학자 로스 그랜빌 해리슨(Ross Granville Harrison)은 림프가 응고된 배지에서 신경 세포로 발전할 개구리 배아 세포의 성장을 증명했다. 1913년, E. 스타인하르트(E. Steinhardt), C. 이스라엘리(C. Israeli), R. A. 램버트(R. A. Lambert)는 기니피그 각막 조직 조각에서 우두 바이러스를 배양했다.[6] 1996년에는 재생 조직을 사용하여 요도의 소구간을 대체하는 데 성공했으며, 이는 체외에서 조직 샘플을 채취해 성장시키고 지지체 없이 재적용하는 기술이 1cm 이하의 짧은 거리에서만 가능하다는 점을 이해하는 데 기여했다. 로스 그랜빌 해리슨은 존스홉킨스 의과대학과 이후 예일대학교에서 1907년부터 1910년까지 자신의 실험 결과를 발표하며 조직 배양 방법론을 확립했다.
고틀리브 하버란트(Gottlieb Haberlandt)는 최초로 분리된 조직, 즉 식물 조직 배양의 가능성을 언급했다. 그는 조직 배양을 통해 개별 세포의 잠재 능력과 조직 간 상호 영향을 밝힐 수 있다고 제안했다. 하버란트의 원론적인 주장 이후 조직 및 세포 배양 방법이 실현되어 생물학과 의학에서 중요한 발견을 이끌어냈다. 그는 1902년 모든 식물 세포가 이론적으로 완전한 식물로 발전할 수 있다는 전능성(totipotentiality)의 원래 아이디어를 제시하며 "이론적으로 모든 식물 세포는 완전한 식물을 생성할 수 있다"고 말했다. '조직 배양'이라는 용어는 미국 병리학자 몬트로즈 토머스 버로우즈(Montrose Thomas Burrows)에 의해 만들어졌다.
세포배양 기술은 1940년대와 1950년대에 바이러스학 연구를 지원하기 위해 크게 발전했다. 세포배양에서 바이러스를 성장시키는 기술은 백신 제조를 위한 정제된 바이러스 준비를 가능하게 했다. 조나스 솔크(Jonas Salk)가 개발한 주사형 소아마비 백신은 세포 배양 기술을 대규모로 사용해 생산된 최초의 제품 중 하나였다. 이 백신은 원숭이 신장 세포 배양에서 바이러스를 배양하는 방법을 발견한 존 프랭클린 엔더스(John Franklin Enders), 토머스 허클 웰러(Thomas Huckle Weller), 프레더릭 채프먼 로빈스(Frederick Chapman Robbins)의 세포 배양 연구에 의해 가능해졌으며, 이들은 이 발견으로 노벨상을 수상했다. 세포 배양은 많은 질병 백신 개발에 기여했다.
현대적 활용
- 배양 배지에서 자라는 배양 세포
현대적으로 "조직 배양"은 일반적으로 다세포 생물의 조직에서 유래한 세포를 *시험관 내(in vitro)*에서 배양하는 것을 의미한다. 이러한 세포는 기증 생물로부터 분리된 세포(일차 세포)일 수도 있고, 불멸화된 세포주일 수도 있다. 이 세포들은 생존에 필수적인 영양소와 에너지원이 포함된 배양 배지에 담가져 있다.[16] 따라서, "조직 배양"은 넓은 의미에서 종종 "세포 배양"과 혼용되어 사용된다. 한편, "조직 배양"이라는 엄밀한 의미는 조직 조각, 즉 *이식편 배양(explant culture)*을 배양하는 것을 지칭한다.
조직 배양은 다세포 생물에서 유래한 세포의 생물학을 연구하는 중요한 도구이다. 이는 잘 정의된 환경에서 조직의 시험관 내 모델을 제공하며, 이를 쉽게 조작하고 분석할 수 있게 한다. 동물 조직 배양에서 세포는 이차원적 단층(전통적 배양)으로 자라거나 섬유성 스캐폴드나 젤 안에서 배양되어 보다 자연스러운 삼차원 조직과 유사한 구조(3D 배양)를 형성할 수 있다.
1988년 미국 NIH SBIR 보조금 보고서는 전기방사(electrospinning)를 사용하여 시험관 내 세포 및 조직 기질로 사용하기 위해 설계된 나노 및 서브미크론 크기의 고분자 섬유성 스캐폴드를 생산할 수 있음을 보여주었다. 전기방사된 섬유격자를 세포 배양 및 조직 공학에 사용한 초기 사례에서는 다양한 세포 유형이 폴리카보네이트 섬유에 부착하고 증식할 수 있음을 확인했다. 특히, 이차원 배양에서 일반적으로 나타나는 평평한 형태와 달리, 전기방사 섬유에서 자란 세포는 생체 내(in vivo) 조직에서 일반적으로 관찰되는 보다 둥근 삼차원 형태를 나타냈다.
- 식물 조직 배양
식물 조직 배양은 특히, 작은 식물 조직 조각을 배양 배지에서 배양하여 전체 식물을 성장시키는 데 중점을 둔다.
포유류 세포 배양의 개념
세포의 분리
세포는 여러 가지 방법으로 생체 외 배양을 위해 조직에서 분리한다. 세포는 현탁액으로 방출하기 위해 조직을 교반하기 전에 콜라겐 분해 효소, 트립신, 프로네이스와 같은 효소를 사용하여 세포 외 기질을 소화함으로써 고체 조직에서 분리한다. 또는 조직 조각을 배지에 넣고 세포를 배양할 수 있다.
피험자로부터 직접 배양 된 세포를 1차 세포라고 한다. 일부 종양에서 유래한 것을 제외하고 대부분의 1차 세포는 수명이 제한되어 있다.
불멸 세포주는 무작위 돌연변이 또는 텔로머레이스 유전자의 인공적인 발현과 같은 의도적인 변형을 통해 무기한 증식하는 능력을 획득하였다. 특정 세포 유형을 대표하는 수 많은 세포주가 존재한다.
배양을 통한 세포 유지
대부분의 분리된 1차 세포는 생물학적 노화 과정을 거치고 일반적인 생존 능력(Hayflick 한계)을 유지하면서 특정 인구 수가 되면 분열을 멈춘다.

온도 및 가스 혼합물을 제외하고 배양 시스템에서 가장 일반적인 변화 요소는 세포 성장 배지이다. 성장 배지의 제조법은 수소 이온 농도 지수, 포도당 농도, 성장 인자 및 기타 영양소의 존재의 여부에 따라 다르다. 배지를 보충하는 데 사용되는 성장 인자는 종종 소태아혈청(FBS), 송아지 혈청, 말혈청, 돼지 혈청과 같은 동물 혈액의 혈청에서 파생된다. 이러한 혈액 유래 성분 성장 인자의 단점은 특히 의료 생명공학기술 응용 분야에서 바이러스 또는 프리온으로 배양물이 오염될 가능성이 있다는 것이다. 현재는 이러한 성분의 사용을 최소화하거나 제거하고 인간 혈소판 용해물(hPL)를 사용함으로 그 단점을 줄일 수 있다. 이것은 FBS를 인간 세포와 함께 사용할 때 종간 오염에 대한 걱정을 없애준다. hPL은 FBS 또는 기타 동물 혈청을 직접 대체하는 안전하고 신뢰할 수 있는 대안으로 부상했다. 또한, 화학 배지를 사용하여 혈청 흔적(인간 또는 동물)을 제거할 수 있지만 이는 다른 세포 유형에서 항상 달성할 수 있는 것은 아니다. 대체 전략에는 미국, 호주 및 뉴질랜드와 같이 BSE/TSE 위험이 최소인 국가에서 동물 혈액을 조달하고 세포 배양을 위해 전 동물 혈청 대신 혈청에서 추출한 정제된 영양 농축액을 사용하는 것이 포함된다.
Plating 밀도(배양 배지 부피 당 세포 수)는 일부 세포 유형에서 중요한 역할을 한다. 예를 들어, Plating 밀도가 낮을수록 과립막 세포는 에스트로겐 생성을 나타내지만 Plating 밀도가 높으면 프로게스테론을 생성하는 테카 루테인 세포로 나타난다.
세포는 현탁액 또는 부착 배양으로 성장할 수 있다. 일부 세포는 혈류에 존재하는 세포와 같이 표면에 부착되지 않고 자연적으로 부유 상태로 존재한다. 부착 조건이 허용하는 것보다 더 높은 밀도로 성장할 수 있도록 현탁액 배양에서 생존할 수 있도록 변형된 세포주도 있다. 부착 세포는 부착 특성을 증가시키고 성장 및 분화에 필요한 기타 신호를 제공하기 위해 세포외 기질(콜라겐 및 라미닌) 성분으로 코팅될 수 있는 조직 배양 플라스틱 또는 미세 담체와 같은 표면이 필요하다. 고형 조직에서 유래한 대부분의 세포는 부착되어 있다. 부착 배양의 또 다른 유형은 2차원 배양 접시와 달리 3차원 환경에서 세포를 성장시키는 것을 포함하는 Organotypic 배양이다. 이 3D 배양 시스템은 생화학적 및 생리학적으로 생체 내 조직과 더 유사하지만 많은 요인(확산 등)으로 인해 유지 관리하기가 기술적으로 어렵다.
세포 배양 기초 배지
생명과학에서 일상적으로 사용되는 세포 배양 배지이다.
- MEM
- DMEM
- RPMI 1640
- Ham's F-12
- IMDM
- Leibovitz L-15
- DMEM/F-12
세포 배양 배지의 구성 요소
| 요소 | 기능 |
|---|---|
| 탄소원(포도당/글루타민) | 에너지원 |
| 아미노산 | 단백질 제공 |
| 비타민 | 세포 생존 및 성장 촉진 |
| 적절한 농도의 염 | 세포 내에서 최적의 삼투압을 유지하고 효소 반응, 세포 부착 등의 보조 인자로 작용하는 필수 금속 이온을 제공하기 위한 이온의 등장성 혼합물 |
| 페놀 레드 염료 | 산·염기 지시약. 페놀 레드의 색상은 pH 7~7.4에서 주황색(혹은 빨간색)에서 산성에서는 노란색으로, 염기성에서는 자주색으로 바뀐다. |
| 중탄산염/HEPES 완충 용액 | 배지에서 균형 잡힌 수소 이온 농도를 유지하는 데 사용된다. |
전형적인 성장 조건
| 조건 | |
|---|---|
| 온도 | 37°C |
| 이산화탄소 | 5% |
| 상대 습도 | 95% |
세포주 교차 오염
세포주 교차 오염은 배양된 세포를 다루는 과학자에게 문제가 될 수 있다. 연구에 따르면 15~20%의 시간에서 실험에 사용된 세포가 잘못 식별되었거나 다른 세포주로 오염된 것으로 나타났다. 세포주 교차 오염 문제는 약물 스크리닝 연구에 일상적으로 사용되는 NCI-60의 세포주에서도 감지되었다. ATCC(American Type Culture Collection), ECACC(European Collection of Cell Cultures), DSMZ(German Collection of Microorganisms and Cell Cultures)를 포함한 주요 세포주 저장소는 연구자로부터 잘못 식별된 세포주 제출을 받았다. 이러한 오염은 세포 배양주를 사용하여 생산된 연구의 품질에 문제를 제기할 수 있다. ATCC는 짧은 탠덤 반복( Short Tandem Repeat, STR), DNA 지문을 사용하여 오염되지 않은 세포주로 인증한다.
세포주 교차 오염 문제를 해결하기 위해 연구자들은 세포주의 정체성을 확립하기 위해 초기 계대에서 세포주를 인증하는 것이 좋다. 세포주를 동결하기 전, 활성 배양 동안 2개월마다, 그리고 세포주를 사용하여 생성된 연구 데이터를 출판하기 전에 인증을 반복해야 한다. 동질효소 분석, 인간 림프구 항원(HLA) 유형, 염색체 분석, 핵형 분석, 형태학 및 STR 분석을 비롯한 많은 방법이 세포주를 식별하는 데 사용된다.
중요한 세포주 교차 오염의 예중 하나는 헬라 세포주이다.
기타 기술적 문제
세포는 일반적으로 배양에서 계속 분열하기 때문에 일반적으로 사용 가능한 영역 또는 부피를 채우기 위해 성장한다. 이로 인해 몇 가지 문제가 발생할 수 있다.
- 성장 배지의 영양 고갈
- 성장 배지의 pH 변화
- 세포 자살/괴사 세포의 축적
- 세포 간 접촉은 세포 주기 정지를 자극하여 세포가 분열을 멈추게 하는 접촉 억제
- 세포 간 접촉에 따른 세포 분화
- 유전적 및 후성적 변화, 변형된 세포의 자연 선택으로 잠재적으로 분화가 감소하고 증식 능력이 증가된 비정상적 배양 적응 세포의 과성장
배지의 선택은 영양 성분과 농도의 차이로 인해 세포 배양 실험 결과의 생리학적 관련성에 영향을 미칠 수 있다. 영양소의 생리학적 수준을 더 잘 나타내는 배지를 사용하면 생체 외 연구의 생리적 관련성을 향상 시킬 수 있으며 최근에는 Plasmax 및 인간 Plasma Like Medium(HPLM)과 같은 배지 유형이 개발되었다.
배양 세포의 조작
배양 세포에서 수행되는 일반적인 조작 중에는 배지 변경, 세포 계대, 세포 형질 주입이 있다. 이들은 일반적으로 무균 기술에 의존하는 조직 배양 방법을 사용하여 수행된다. 무균 기술은 세균, 효모 또는 기타 세포주의 오염을 방지하는 것을 목표로 한다. 조작은 일반적으로 오염 미생물을 배제하기 위해 생물 안전 작업대 또는 층류 작업대에서 수행된다. 항생제(페니실린, 스트렙토마이신) 및 항진균제(암포테리신 B)도 배지에 첨가할 수 있다.
세포가 대사 과정을 거치면서 산이 생성되고 pH가 감소한다. 산·염기 지시약을 배지에 첨가하여 영양소 고갈을 측정한다.
부착 배양의 경우 흡인에 의해 배지를 직접 제거한 다음 교체할 수 있다.
세포의 Passage
계대 배양에는 소수의 세포를 새 용기로 옮기는 작업이 포함된다. 세포를 규칙적으로 분할하면 장기간 높은 세포 밀도와 관련된 노화를 방지하므로 세포를 더 오랜 시간 동안 배양할 수 있다. 현탁 배양은 더 많은 양의 신선한 배지에 희석된 몇 개의 세포를 포함하는 소량의 배양으로 쉽게 계대된다. 부착 배양의 경우 먼저 용기에서 세포를 분리해야 한다. 트립신/EDTA의 혼합물을 이용한다. 그런 다음 소수의 분리된 세포를 사용하여 새로운 용기에 옮겨 담는다. RAW 세포와 같은 일부 세포 배양은 고무 Scraper로 용기 표면에서 물리적으로 긁어낸다.
형질 전환 및 형질 도입
세포를 조작하는 또 다른 일반적인 방법은 형질 주입에 의한 외래 DNA의 도입을 포함한다. 이것은 세포가 관심 유전자를 발현하도록 하기 위해 수행된다. 최근에 RNA 간섭 구조의 형질 주입은 특정 유전자 및 단백질의 발현을 억제하기 위한 편리한 메커니즘으로 실현되었다. 또한 DNA는 형질 도입 또는 형질 전환이라고 하는 방법으로 바이러스를 사용하여 세포에 삽입될 수 있다. 바이러스는 기생체라 정상적인 번식 과정의 일부이기 때문에 DNA를 세포에 도입하는 데 매우 적합하다.
확립된 인간 세포주
인간에게서 유래한 세포주는 생명윤리학에서 논란이 되어 왔다. 이는 원래의 기증자보다 오래 생존할 수 있으며, 이후 수익성 있는 의료 치료법 개발에 사용될 가능성이 있기 때문이다. 이와 관련하여, 미국 캘리포니아주 대법원은 Moore 대 Regents of the University of California 사건에서, 환자가 동의하에 제거된 장기에서 유래된 세포주에 대해 재산권을 가지지 않는다는 판결을 내렸다.
- 혼성종양
정상 세포를 불멸화된 세포주와 융합시키는 것이 가능하다. 이 방법은 단일클론 항체(monoclonal antibody)를 생산하는 데 사용된다. 요약하자면, 면역된 동물의 비장(혹은 혈액)에서 분리된 림프구를 불멸화된 골수종(myeloma) 세포주(B 세포 계열)와 결합시켜 혼성종양(hybridoma)을 생성한다. 이 혼성종양은 1차 림프구의 항체 특이성과 골수종의 불멸성을 동시에 가진다. 선택적 배양 배지(HA 또는 HAT)를 사용하여 융합되지 않은 골수종 세포를 제거하며, 1차 림프구는 배양 중 빠르게 사멸하고, 융합된 세포만 생존한다. 이렇게 생존한 세포는 필요한 항체를 생산하는지 확인되며, 일반적으로 초기에는 집합적으로 선별한 뒤 단일 클로닝 후에도 확인한다.
- 세포 변형 (Cell Strains)
세포 변형은 특정한 성질이나 특성을 가진 세포를 선택하거나 복제(cloning)하여 1차 배양(primary culture)이나 세포주(cell line)로부터 유래된다. 세포 변형은 배양 환경에 적응한 세포이지만, 세포주와 달리 분열 횟수에 한계가 있다. 불멸화되지 않은 세포는 40~60회의 개체 증식(population doublings) 이후 분열을 멈추며, 이 시점 이후에는 증식 능력을 잃는다. 이는 노화(senescence)라고 알려진 유전적으로 결정된 현상이다.
세포배양의 응용
동물 세포주의 대량 배양은 바이러스 백신 및 기타 바이오 기술 제품 제조의 기본이다. 인간 줄기세포 배양은 세포 수를 늘리고 다양한 체세포 유형으로 분화시켜 이식에 사용한다. 또한 줄기세포 배양은 치료 개발 목적으로 줄기세포가 방출하는 분자 및 엑소좀을 수집하는 데도 사용된다.
동물 세포 배양에서 재조합 DNA(rDNA) 기술로 생산되는 생물학적 제품에는 효소, 합성 호르몬, 면역생물학적 제제(단일클론 항체, 인터류킨, 림포카인), 항암제가 포함된다. 단순한 단백질은 세균 배양에서 rDNA로 생산할 수 있지만, 당화(탄수화물이 부착된)된 복잡한 단백질은 현재 동물 세포에서만 제조할 수 있다. 포유류 세포는 발현된 단백질이 올바르게 접히고 인간과 유사한 당화 및 번역 후 변형(post-translational modification)을 갖추도록 보장한다. 이러한 복잡한 단백질의 대표적인 예는 호르몬 에리트로포이에틴(erythropoietin)이다.
포유류 세포 배양의 비용이 높기 때문에, 곤충 세포나 고등 식물에서 이러한 복잡한 단백질을 생산하는 연구가 진행 중이다. 단일 배아 세포와 체세포 배아를 입자 폭격법(particle bombardment)으로 직접 유전자 전달의 원천으로 사용하는 연구, 일시적 유전자 발현(transit gene expression), 공초점 현미경 관찰도 주요 응용 분야에 포함된다. 이는 체세포 배아의 단일 세포 기원 및 첫 번째 세포 분열의 비대칭성을 확인하는 데 유용하며, 이는 발달 과정의 시작을 나타낸다.
세포 배양은 세포 농업에서도 핵심 기술로, 새로운 제품을 개발하거나 기존 농업 제품(우유, 배양육, 향수, 코뿔소 뿔 등)을 세포와 미생물에서 생산하는 새로운 방법을 제공한다. 이는 동물 없는 농업을 실현하는 한 가지 방법으로 간주된다.
또한 세포 배양은 세포 생물학을 가르치는 데 중요한 도구로 활용된다.
2차원 세포 배양
세포 배양, 줄기세포 연구 및 분자 생물학 연구는 주로 평면 플라스틱 배지에서 세포를 배양하는 방식으로 이루어진다. 이러한 기술은 2차원(2D) 세포 배양이라고 하며, 1885년 빌헬름 루(Wilhelm Roux)가 배양 환경을 마련하면서 처음 개발되었다. 그는 배양 접시 역할을 하는 평평한 유리판 위에서 닭 배아의 중추신경판 일부를 따뜻한 생리식염수에 보관하여 며칠간 유지했다. 이후, 폴리머 기술이 발전하면서 오늘날 널리 사용되는 페트리 접시(Petri dish)가 표준 도구로 자리 잡았다. 이는 독일 세균학자인 줄리어스 리처드 페트리(Julius Richard Petri)가 로베르트 코흐(Robert Koch)의 조수로 일하면서 발명한 것으로 알려져 있다.
최근에는 실험실 플라스크, 원추형 배양 병(conical), 일회용 배양백(주로 일회용 바이오리액터에 사용)도 활용된다.
또한, 콜라겐이나 피브린과 같은 생물학적으로 유래된 매트릭스뿐만 아니라,*폴리아크릴아마이드(polyacrylamide)나 PEG(폴리에틸렌 글라이콜)과 같은 합성 하이드로젤에서도 세포를 배양하고 있다. 이러한 방식은 전통적으로 단단한 기질에서 나타나지 않는 표현형을 유도하기 위해 사용된다. 특히 매트릭스의 강성을 조절하는 기술에 대한 관심이 높아지고 있으며, 이를 통해 다음과 같은 분야에서 중요한 발견이 이루어졌다.
- 줄기세포의 자기 재생 능력
- 세포 계통 분화
- 암세포의 표현형
- 섬유화
- 간세포 기능
- 기계적 감지 메커니즘
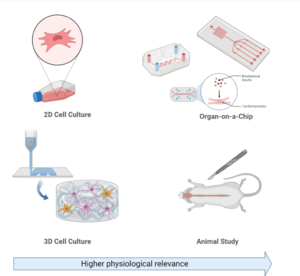
3차원 세포 배양
3D 세포 배양은 "생물학의 새로운 차원"으로 평가받고 있다.[65] 현재까지 세포 배양은 주로 2D 환경에서 단일 또는 다중 세포 구조를 기반으로 이루어졌지만, 최근에는 신약 개발, 암 생물학, 재생 의학, 나노소재 평가, 기초 생명 과학 연구 등 다양한 분야에서 3D 세포 배양의 사용이 증가하고 있다.
3D 세포 배양은 스캐폴드(scaffold) 또는 매트릭스를 사용하는 방식과 스캐폴드 없는 방식으로 나뉜다.
- 스캐폴드 기반 배양: 무세포 3D 매트릭스나 액체 매트릭스를 활용.
- 스캐폴드 없는 배양: 일반적으로 부유배양(suspension)을 통해 생성.
3D 세포 구조 성장을 촉진하기 위해 다양한 플랫폼이 활용되며, 여기에는 하이드로젤 매트릭스, 고체 스캐폴드, 저부착 플레이트, 나노입자 기반 자기부상, 행잉 드롭(hanging drop), 회전식 세포 배양(rotary cell culture) 등이 포함된다.
3D 배양 환경은 유전자 발현 패턴에 광범위한 변화를 일으키며, 생리학적 상태의 조직을 부분적으로 모방한다. 한 연구에서는 3D 세포 배양 모델이 in vivo 상태와 유사한 세포 성장을 나타냈으며, 단층 배양(monolayer culture)보다 뛰어난 지속 가능성을 보였다.
3D 세포 배양은 종양 모델 설계, 악성 변환 및 전이 연구, 세포 신호 전달과 상호작용 분석에 유망한 도구로 자리 잡았다.
스캐폴드를 이용한 3D 세포 배양
에릭 사이먼(Eric Simon)의 1988년 NIH SBIR 연구 보고서는 일렉트로스피닝(electrospinning) 기술을 활용해 폴리스티렌과 폴리카보네이트로 만든 나노 및 서브마이크로 섬유 스캐폴드를 개발했다. 이는 in vitro 세포 기질로 사용하기 위해 고안되었으며, 세포 배양과 조직 공학에 중요한 역할을 했다.
초기의 일렉트로스피닝 섬유망(lattices)은 다음과 같은 다양한 세포 유형이 접착하고 증식하는 것을 입증했다:
- 인간 포피 섬유아세포(HFF)
- 변형된 인간 암세포(HEp-2)
- 밍크 폐 상피세포(MLE)
이 섬유에서 배양된 세포는 일반적인 2D 배양에서 관찰되는 평평한 형태와 달리, in vivo에서 관찰되는 조직형(histotypic)의 둥근 3차원 형태를 나타냈다. 이는 자연 조직에 더 가까운 3D 세포 배양의 가능성을 보여주는 중요한 발견이었다.
하이드로젤을 이용한 3D 세포 배양
자연적인 세포외기질(ECM)은 세포 생존, 증식, 분화, 이동에 중요한 역할을 한다. 이를 모방한 하이드로젤은 in vivo와 유사한 배양 환경을 제공하는 유망한 접근 방식으로 여겨진다.
하이드로젤은 연결된 기공 구조와 높은 수분 보유력을 가지며, 영양분과 기체와 같은 물질의 효율적인 전달을 가능하게 한다. 하이드로젤 배양 매트릭스에는 다음과 같은 다양한 종류가 있다.
- 동물 ECM 추출물 기반 하이드로젤
- 단백질 기반 하이드로젤
- 펩타이드 하이드로젤
- 고분자 하이드로젤
- 나노셀룰로오스 기반 하이드로젤 (나무 유래)
자기부상법에 의한 3D 세포 배양
자기부상법(Magnetic Levitation Method, MLM)을 활용한 3D 세포 배양은 자석 나노입자로 처리된 세포를 공간적으로 가변적인 자기장을 이용해 공기/액체 경계로 부양시키는 방식으로, 세포 간 상호작용을 촉진하여 3D 조직을 성장시키는 기술이다. 이 방법은 네오디뮴 자석 드라이버와 자석 나노입자 어셈블리를 사용한다. 나노입자는 산화철 나노입자, 금 나노입자, 폴리리신(polylysine) 폴리머로 구성된다.
이 기술은 규모 확장이 가능하며, 단일 접시에서 고처리량 저부피 시스템까지, 수백 개에서 수백만 개 세포 배양이 가능하다.
조직 배양 및 조직공학
세포배양은 조직 배양과 조직공학의 핵심 요소로, in vitro 환경에서 세포를 성장시키고 유지하는 기초를 제공한다. 특히 인간 세포 배양은 줄기세포 산업에서 중요한 응용 분야로, 중간엽 줄기세포(mesenchymal stem cells)를 배양하고 냉동 보존하여 미래의 치료에 활용할 수 있다.
조직 공학은 연간 수십만 명의 환자들에게 저비용 의료 서비스를 제공할 수 있는 획기적인 개선 가능성을 제시한다.
백신 생산
백신 제조는 세포 배양 기술에 크게 의존한다.
소아마비, 홍역, 유행성 이하선염, 풍진, 수두 백신은 현재 세포 배양을 통해 생산된다. H5N1 팬데믹 위협으로 인해 미국 정부는 인플루엔자 백신을 위한 세포 배양 연구에 자금을 지원하고 있다.
새로운 접근법으로는 재조합 DNA 기반 백신(예: 사람 아데노바이러스를 벡터로 사용)과 첨단 보조제(adjuvant)가 포함된다.
세포 공동 배양
공동 배양(Co-Culture) 기술은 한 개 이상의 세포 유형을 한 배양 접시 또는 3D 매트릭스에서 배양하여 세포 간 상호작용을 연구하는 데 사용된다. 이 기술은 다양한 줄기세포의 배양, 면역 세포 간 상호작용 연구, 그리고 생체 조직과 유사한 in vitro 모델을 구현하는 데 중요한 역할을 한다.
공동 배양은 직접 상호작용과 간접 상호작용 두 가지 방식으로 구분된다.
- 직접 상호작용: 동일한 배양 매체나 매트릭스에서 세포들이 직접 접촉.
- 간접 상호작용: 서로 다른 환경에서 신호 전달 및 가용성 인자가 참여.
- 공동 배양의 응용
- 조직 모델 내에서 세포 간 상호작용을 통해 세포 분화를 연구.
- 암 종양 모델링 및 약물 치료 효과 평가.
- 3D 모델에서 화학요법 및 내분비 요법 반응 예측.
- 조직 공학에서 다수의 세포가 직접 상호작용하여 조직 형성을 유도.
공동 배양 기술은 생체 조직을 모방하고 세포 간의 복잡한 상호작용을 연구하는 데 중요한 도구로 자리 잡고 있다.
미세유체 소자에서의 세포 배양
마이크로플루이딕(Microfluidics) 기술은 마이크로미터 규모의 유체 흐름에서 공정을 수행할 수 있도록 개발된 시스템이다. 마이크로플루이딕 칩(Microfluidics chip)은 랩온어칩(Lab-on-a-chip)이라고도 불리며, 최소한의 반응물과 공간을 사용해 연속적인 절차 및 반응 단계를 수행할 수 있다.
이러한 시스템은 적절한 생물학적 분석 및 고감도 탐지 기술과 결합하면 개별 세포와 분자의 식별 및 분리를 가능하게 한다.
장기-온-칩(Organ-on-a-Chip)
장기-온-칩(OoC) 시스템은 마이크로플루이딕 기술을 활용해 세포의 미세 환경을 모방하고 제어한다. 이를 통해 미세유체 시스템 내에서 조직을 성장시켜 생물학적 특성을 유지하거나 개선할 수 있다.
OoC는 조직 공학, 바이오소재 제작, 세포 생물학을 결합하여 인간 질병 연구를 위한 생체모방 모델을 실험실에서 구현하는 가능성을 제공한다. 최근 3D 세포 배양 과학의 진전은 OoC 기술 개발을 크게 촉진하였다.
OoC는 다음과 같은 의학 및 제약 연구 분야에서 중요한 사전 단계(preclinical step)로 간주된다:
- 신약 개발
- 질병 모델링
- 약물 전달
- 병리생리학 연구
OoC는 동물 실험과 임상 연구 사이의 간극을 메우는 중요한 기술로 평가받는다. 또한, 현재의 과학적 진보는 동물 실험 대체 및 in vivo 연구 대안으로서의 가능성을 제시하고 있다.
비포유류 세포 배양
비포유류 세포의 배양은 포유류 세포 배양에 비해 다양한 종에서 유래한 세포를 연구할 수 있다는 점에서 독특한 이점을 제공한다. 비불멸화 세포는 Hayflick 한계에 따라 노화가 진행되기 전까지 제한된 기간 동안만 배양될 수 있다. 예를 들어, 물고기 각막세포는 세포 이동 연구에서 주요한 연구 도구로 사용되어 왔다.
- 식물 세포 배양
식물 조직 배양(Plant tissue culture)은 식물 세포를 액체 배지에서 세포 부유 배양으로, 또는 고체 배지에서 캘러스 배양으로 성장시키는 기술이다.
- 캘러스(Callus): 분화되지 않은 식물 세포의 덩어리.
- 적절한 식물 생장 호르몬(옥신과 사이토키닌)**의 균형은 캘러스 배양과 식물 세포의 생장을 위해 필수적이다.
대표적인 예로 담배 BY-2 세포는 고유의 빠른 증식 속도와 균일성 때문에 식물 배양 연구에 널리 사용된다.
- 곤충 세포 배양
곤충에서 유래한 세포 배양은 **초파리(Drosophila melanogaster)**와 같은 모델 생물의 연구에서 널리 활용된다.
- Schneider 2 세포(S2 세포): 초파리 유래 세포로, 생화학 연구나 siRNA 기반 연구에 사용된다.
- Spodoptera frugiperda에서 유래한 Sf9 및 Sf21 세포와 Trichoplusia ni에서 유래한 High Five 세포는 바큘로바이러스 시스템을 이용한 재조합 단백질 발현에 사용된다.
- 박테리아와 효모 배양
박테리아 및 효모 배양은 일반적으로 두 가지 방식으로 이루어진다:
- 고체 배지: 영양소가 포함된 젤(예: 한천(agar)) 위에서 소량의 세포를 배양.
- 액체 배양: 영양분이 포함된 액체 배지에 세포를 부유시켜 대량 배양.
- 바이러스 배양
바이러스 배양은 바이러스의 성장과 복제를 위해 숙주 세포(포유류, 식물, 곰팡이 또는 박테리아 유래)가 필요하다.
- 야생형 바이러스, 재조합 바이러스, 바이러스 산물은 적절한 조건에서 자연 숙주가 아닌 세포에서도 생성될 수 있다.
- 바이러스 감염 및 복제는 숙주 세포의 용해 및 바이러스 플라크(viral plaque) 형성을 초래할 수 있다.
이러한 기술은 바이러스 연구 및 백신 개발의 핵심 도구로 활용된다.
일반적인 세포주
인간 세포주
- H295R (부신피질암)
- DU145 (전립선암)
- HeLa ( 자궁경부암 )
- KBM-7 (만성 골수성 백혈병)
- LNCaP (전립선암)
- MCF-7 (유방암)
- MDA-MB-468 (유방암)
- PC3 (전립선암)
- SaOS-2 (골종양)
- SH-SY5Y (신경모세포종, 다발성 골수종)
- T-47D (유방암)
- THP-1 (급성 골수성 백혈병)
- U87 (교모세포종)
영장류 세포주
쥐 세포주
- MC3T3 (배아 Calvarium)
쥐 종양 세포주
식물 세포주
기타 종 세포주
세포주 목록
| 세포주 | 의미 | 생물체 | 조직 출처 | 형태 | 링크 |
|---|---|---|---|---|---|
| 3T3-L1 | 3-day Transfer, Inoculum 3x105 cells | 쥐 | Embryo | 섬유아세포 | ECACC Cellosaurus |
| 4T1 | 쥐 | Mammary gland | ATCC Cellosaurus | ||
| 1321N1 | 인간 | 뇌 | Astrocytoma | ECACC Cellosaurus | |
| 9L | 쥐 | 뇌 | Glioblastoma | ECACC Cellosaurus | |
| A172 | 인간 | 뇌 | Glioblastoma | ECACC Cellosaurus | |
| A20 | 쥐 | B lymphoma | B lymphocyte | Cellosaurus | |
| A253 | 인간 | Submandibular duct | Head and neck carcinoma | ATCC Cellosaurus | |
| A2780 | 인간 | 난소 | Ovarian carcinoma | ECACC Cellosaurus | |
| A2780ADR | 인간 | 난소 | Adriamycin-resistant derivative of A2780 | ECACC Cellosaurus | |
| A2780cis | 인간 | 난소 | Cisplatin-resistant derivative of A2780 | ECACC Archived 2021년 11월 24일 - 웨이백 머신 Cellosaurus | |
| A431 | 인간 | Skin epithelium | Squamous cell carcinoma | ECACC Cellosaurus | |
| A549 | 인간 | 폐 | Lung carcinoma | ECACC Cellosaurus | |
| AB9 | 제브라피쉬 | Fin | 섬유아세포 | ATCC Cellosaurus | |
| AHL-1 | Armenian Hamster Lung-1 | 햄스터 | 폐 | ECACC Archived 2021년 11월 24일 - 웨이백 머신 Cellosaurus | |
| ALC | 쥐 | 골수 | Stroma | 틀:PMID Cellosaurus | |
| B16 | 쥐 | Melanoma | ECACC Archived 2021년 11월 24일 - 웨이백 머신 Cellosaurus | ||
| B35 | 쥐 | Neuroblastoma | ATCC Cellosaurus | ||
| BCP-1 | 인간 | 말초 혈액 단핵세포(PBMC) | HIV+ primary effusion lymphoma | ATCC Cellosaurus | |
| BEAS-2B | Bronchial epithelium + Adenovirus 12-SV40 virus hybrid (Ad12SV40) | 인간 | 폐 | Epithelial | ECACC Cellosaurus |
| bEnd.3 | Brain Endothelial 3 | 쥐 | 뇌, 대뇌 피질 | Endothelium | Cellosaurus |
| BHK-21 | Baby Hamster Kidney-21 | 햄스터 | 신장 | 섬유아세포 | ECACC Archived 2021년 11월 24일 - 웨이백 머신 Cellosaurus |
| BOSC23 | Packaging cell line derived from HEK 293 | 인간 | Kidney (embryonic) | Epithelium | Cellosaurus |
| BT-20 | Breast Tumor-20 | 인간 | Breast epithelium | Breast carcinoma | ATCC Cellosaurus |
| BxPC-3 | Biopsy xenograft of Pancreatic Carcinoma line 3 | 인간 | Pancreatic adenocarcinoma | Epithelial | ECACC Cellosaurus |
| C2C12 | 쥐 | Myoblast | ECACC Cellosaurus | ||
| C3H-10T1/2 | 쥐 | Embryonic mesenchymal cell line | ECACC Cellosaurus | ||
| C6 | 쥐 | Brain astrocyte | Glioma | ECACC Cellosaurus | |
| C6/36 | 흰줄숲모기 | Larval tissue | ECACC Cellosaurus | ||
| Caco-2 | 인간 | 대장 | Colorectal carcinoma | ECACC Cellosaurus | |
| Cal-27 | 인간 | 혀 | Squamous cell carcinoma | ATCC Cellosaurus | |
| Calu-3 | 인간 | 폐 | Adenocarcinoma | ATCC Cellosaurus | |
| CGR8 | 쥐 | Embryonic stem cells | ECACC Cellosaurus | ||
| CHO | Chinese Hamster Ovary | 햄스터 | 난소 | Epithelium | ECACC Archived 2021년 10월 29일 - 웨이백 머신 Cellosaurus |
| CML T1 | Chronic myeloid leukemia T lymphocyte 1 | 인간 | CML acute phase | T cell leukemia | DSMZ Cellosaurus |
| CMT12 | Canine Mammary Tumor 12 | 개 | Mammary gland | Epithelium | Cellosaurus |
| COR-L23 | 인간 | 폐 | Lung carcinoma | ECACC Cellosaurus | |
| COR-L23/5010 | 인간 | 폐 | Lung carcinoma | ECACC Cellosaurus | |
| COR-L23/CPR | 인간 | 폐 | Lung carcinoma | ECACC Cellosaurus | |
| COR-L23/R23- | 인간 | 폐 | Lung carcinoma | ECACC Cellosaurus | |
| COS-7 | Cercopithecus aethiops, origin-defective SV-40 | Old World monkey - Cercopithecus aethiops (Chlorocebus) | 신장 | 섬유아세포 | ECACC Cellosaurus |
| COV-434 | 인간 | 난소 | Ovarian granulosa cell carcinoma | 틀:PMIDECACC Cellosaurus | |
| CT26 | 쥐 | 대장 | Colorectal carcinoma | Cellosaurus | |
| D17 | 개 | Lung metastasis | Osteosarcoma | ATCC Cellosaurus | |
| DAOY | 인간 | 뇌 | Medulloblastoma | ATCC Cellosaurus | |
| DH82 | 개 | Histiocytosis | Monocyte/macrophage | ECACC Cellosaurus | |
| DU145 | 인간 | Androgen insensitive prostate carcinoma | ATCC Cellosaurus | ||
| DuCaP | Dura mater cancer of the Prostate | 인간 | Metastatic prostate carcinoma | Epithelial | 틀:PMIDCellosaurus |
| E14Tg2a | 쥐 | Embryonic stem cells | ECACC Cellosaurus | ||
| EL4 | 쥐 | T cell leukemia | ECACC Cellosaurus | ||
| EM-2 | 인간 | CML blast crisis | Ph+ CML line | DSMZ Cellosaurus | |
| EM-3 | 인간 | CML blast crisis | Ph+ CML line | DSMZ Cellosaurus | |
| EMT6/AR1 | 쥐 | Mammary gland | Epithelial-like | ECACC Cellosaurus | |
| EMT6/AR10.0 | 쥐 | Mammary gland | Epithelial-like | ECACC Cellosaurus | |
| FM3 | 인간 | Lymph node metastasis | Melanoma | ECACC Cellosaurus | |
| GL261 | Glioma 261 | 쥐 | 뇌 | Glioma | Cellosaurus |
| H1299 | 인간 | 폐 | Lung carcinoma | ATCC Cellosaurus | |
| HaCaT | 인간 | 피부 | Keratinocyte | CLS Archived 2021년 11월 24일 - 웨이백 머신 Cellosaurus | |
| HCA2 | 인간 | Colon | Adenocarcinoma | ECACC Cellosaurus | |
| HEK 293 | Human Embryonic Kidney 293 | 인간 | Kidney (embryonic) | Epithelium | ECACC Cellosaurus |
| HEK 293T | HEK 293 derivative | 인간 | Kidney (embryonic) | Epithelium | ECACC Cellosaurus |
| HeLa | Henrietta Lacks | 인간 | Cervix epithelium | Cervical carcinoma | ECACC Cellosaurus |
| Hepa1c1c7 | Clone 7 of clone 1 hepatoma line 1 | 쥐 | Hepatoma | Epithelial | ECACC Cellosaurus |
| Hep G2 | 인간 | 간 | Hepatoblastoma | ECACC Cellosaurus | |
| High Five | Insect (moth) - Trichoplusia ni | Ovary | Cellosaurus | ||
| HL-60 | Human Leukemia-60 | 인간 | 혈액 | Myeloblast | ECACC Cellosaurus |
| HT-1080 | 인간 | Fibrosarcoma | ECACC Cellosaurus | ||
| HT-29 | 인간 | Colon epithelium | Adenocarcinoma | ECACC Cellosaurus | |
| J558L | 쥐 | Myeloma | B lymphocyte cell | ECACC Cellosaurus | |
| Jurkat | 인간 | White blood cells | T cell leukemia | ECACC Cellosaurus | |
| JY | 인간 | Lymphoblastoid | EBV-transformed B cell | ECACC Cellosaurus | |
| K562 | 인간 | Lymphoblastoid | CML blast crisis | ECACC Cellosaurus | |
| KBM-7 | 인간 | Lymphoblastoid | CML blast crisis | Cellosaurus | |
| KCL-22 | 인간 | Lymphoblastoid | CML | DSMZ Cellosaurus | |
| KG1 | 인간 | Lymphoblastoid | AML | ECACC Cellosaurus | |
| Ku812 | 인간 | Lymphoblastoid | Erythroleukemia | ECACC Cellosaurus | |
| KYO-1 | Kyoto-1 | 인간 | Lymphoblastoid | CML | DSMZ Cellosaurus |
| L1210 | 쥐 | Lymphocytic leukemia | Ascitic fluid | ECACC Cellosaurus | |
| L243 | 쥐 | Hybridoma | Secretes L243 mAb (against HLA-DR) | ATCC Cellosaurus | |
| LNCaP | Lymph Node Cancer of the Prostate | 인간 | Prostatic adenocarcinoma | Epithelial | ECACC Cellosaurus |
| MA-104 | Microbiological Associates-104 | 아프리카 녹색 원숭이 | Kidney | Epithelial | Cellosaurus |
| MA2.1 | 쥐 | Hybridoma | Secretes MA2.1 mAb (against HLA-A2 and HLA-B17) | ATCC Cellosaurus | |
| Ma-Mel 1, 2, 3....48 | 인간 | Skin | A range of melanoma cell lines | ECACC Archived 2021년 11월 24일 - 웨이백 머신 Cellosaurus | |
| MC-38 | Mouse Colon-38 | 쥐 | Colon | Adenocarcinoma | Cellosaurus |
| MCF-7 | Michigan Cancer Foundation-7 | 인간 | Breast | Invasive breast ductal carcinoma ER+, PR+ | ECACC Cellosaurus |
| MCF-10A | Michigan Cancer Foundation-10A | 인간 | Breast epithelium | ATCC Cellosaurus | |
| MDA-MB-157 | M.D. Anderson - Metastatic Breast-157 | 인간 | Pleural effusion metastasis | Breast carcinoma | ECACC Cellosaurus |
| MDA-MB-231 | M.D. Anderson - Metastatic Breast-231 | 인간 | Pleural effusion metastasis | Breast carcinoma | ECACC Cellosaurus |
| MDA-MB-361 | M.D. Anderson - Metastatic Breast-361 | 인간 | Melanoma (contaminated by M14) | ECACC Cellosaurus | |
| MDA-MB-468 | M.D. Anderson - Metastatic Breast-468 | 인간 | Pleural effusion metastasis | Breast carcinoma | ATCC Cellosaurus |
| MDCK II | Madin Darby Canine Kidney II | 개 | Kidney | Epithelium | ECACC Cellosaurus |
| MG63 | 인간 | Bone | Osteosarcoma | ECACC Cellosaurus | |
| MIA PaCa-2 | 인간 | Prostate | Pancreatic Carcinoma | ATCC Cellosaurus | |
| MOR/0.2R | 인간 | Lung | Lung carcinoma | ECACC Cellosaurus | |
| Mono-Mac-6 | 인간 | White blood cells | Myeloid metaplasic AML | DSMZ Cellosaurus | |
| MRC-5 | Medical Research Council cell strain 5 | 인간 | Lung (fetal) | 섬유아세포 | ECACC Archived 2021년 11월 24일 - 웨이백 머신 Cellosaurus |
| MTD-1A | 쥐 | Epithelium | Cellosaurus | ||
| MyEnd | Myocardial Endothelial | 쥐 | Endothelium | Cellosaurus | |
| NCI-H69 | 인간 | Lung | Lung carcinoma | ECACC Cellosaurus | |
| NCI-H69/CPR | 인간 | Lung | Lung carcinoma | ECACC Cellosaurus | |
| NCI-H69/LX10 | 인간 | Lung | Lung carcinoma | ECACC Cellosaurus | |
| NCI-H69/LX20 | 인간 | Lung | Lung carcinoma | ECACC Cellosaurus | |
| NCI-H69/LX4 | 인간 | Lung | Lung carcinoma | ECACC Cellosaurus | |
| Neuro-2a | 쥐 | Nerve/neuroblastoma | Neuronal stem cells | ECACC Cellosaurus | |
| NIH-3T3 | NIH, 3-day transfer, inoculum 3x105 cells | 쥐 | Embryo | 섬유아세포 | ECACC Cellosaurus |
| NALM-1 | 인간 | Peripheral blood | Blast-crisis CML | ATCC Cellosaurus | |
| NK-92 | 인간 | Leukemia/lymphoma | ATCC Cellosaurus | ||
| NTERA-2 | 인간 | Lung metastasis | Embryonal carcinoma | ECACC Cellosaurus | |
| NW-145 | 인간 | Skin | Melanoma | ESTDAB Archived 2011년 11월 16일 - 웨이백 머신 Cellosaurus | |
| OK | Opossum Kidney | Virginia opossum - Didelphis virginiana | Kidney | ECACC Cellosaurus | |
| OPCN / OPCT cell lines | 인간 | Prostate | Range of prostate tumour lines | Cellosaurus | |
| P3X63Ag8 | 쥐 | Myeloma | ECACC Cellosaurus | ||
| PANC-1 | 인간 | Duct | Epithelioid Carcinoma | ATCC Cellosaurus | |
| PC12 | 쥐 | Adrenal medulla | Pheochromocytoma | ECACC Cellosaurus | |
| PC-3 | Prostate Cancer-3 | 인간 | Bone metastasis | Prostate carcinoma | ECACC Cellosaurus |
| Peer | 인간 | T cell leukemia | DSMZ Cellosaurus | ||
| PNT1A | 인간 | Prostate | SV40-transformed tumour line | ECACC Cellosaurus | |
| PNT2 | 인간 | Prostate | SV40-transformed tumour line | ECACC Cellosaurus | |
| Pt K2 | The second cell line derived from Potorous tridactylis | Long-nosed potoroo - Potorous tridactylus | Kidney | Epithelial | ECACC Cellosaurus |
| Raji | 인간 | B lymphoma | Lymphoblast-like | ECACC Cellosaurus | |
| RBL-1 | Rat Basophilic Leukemia-1 | 쥐 | Leukemia | Basophil cell | ECACC Cellosaurus |
| RenCa | Renal Carcinoma | Mouse | Kidney | Renal carcinoma | ATCC Cellosaurus |
| RIN-5F | 쥐 | Pancreas | ECACC Cellosaurus | ||
| RMA-S | 쥐 | T cell tumour | Cellosaurus | ||
| S2 | Schneider 2 | Insect - Drosophila melanogaster | Late stage (20–24 hours old) embryos | ATCC Cellosaurus | |
| SaOS-2 | Sarcoma OSteogenic-2 | 인간 | Bone | Osteosarcoma | ECACC Cellosaurus |
| Sf21 | Spodoptera frugiperda 21 | Insect (moth) - Spodoptera frugiperda | Ovary | ECACC Cellosaurus | |
| Sf9 | Spodoptera frugiperda 9 | Insect (moth) - Spodoptera frugiperda | Ovary | ECACC Cellosaurus | |
| SH-SY5Y | 인간 | Bone marrow metastasis | Neuroblastoma | ECACC Cellosaurus | |
| SiHa | 인간 | Cervix epithelium | Cervical carcinoma | ATCC Cellosaurus | |
| SK-BR-3 | Sloan-Kettering Breast cancer 3 | 인간 | Breast | Breast carcinoma | DSMZ Cellosaurus |
| SK-OV-3 | Sloan-Kettering Ovarian cancer 3 | 인간 | Ovary | Ovarian carcinoma | ECACC Cellosaurus |
| SK-N-SH | 인간 | Brain | Epithelial | ATCC Cellosaurus | |
| T2 | 인간 | T cell leukemia/B cell line hybridoma | ATCC Cellosaurus | ||
| T-47D | 인간 | Breast | Breast ductal carcinoma | ECACC Cellosaurus | |
| T84 | 인간 | Lung metastasis | Colorectal carcinoma | ECACC Cellosaurus | |
| T98G | 인간 | Glioblastoma-astrocytoma | Epithelium | ECACC Cellosaurus | |
| THP-1 | 인간 | Monocyte | Acute monocytic leukemia | ECACC Cellosaurus | |
| U2OS | 인간 | Osteosarcoma | Epithelial | ECACC Cellosaurus | |
| U373 | 인간 | Glioblastoma-astrocytoma | Epithelium | ECACC Archived 2021년 11월 24일 - 웨이백 머신 Cellosaurus | |
| U87 | 인간 | Glioblastoma-astrocytoma | Epithelial-like | ECACC Cellosaurus | |
| U937 | 인간 | Leukemic monocytic lymphoma | ECACC Cellosaurus | ||
| VCaP | Vertebral Cancer of the Prostate | 인간 | Vertebra metastasis | Prostate carcinoma | ECACC Cellosaurus |
| Vero | From Esperanto: verda (green, for green monkey) reno (kidney) | African green monkey - Chlorocebus sabaeus | Kidney epithelium | ECACC Cellosaurus | |
| VG-1 | 인간 | Primary effusion lymphoma | Cellosaurus | ||
| WM39 | 인간 | Skin | Melanoma | ESTDAB Archived 2021년 4월 27일 - 웨이백 머신 Cellosaurus | |
| WT-49 | 인간 | Lymphoblastoid | ECACC Cellosaurus | ||
| YAC-1 | 쥐 | Lymphoma | ECACC Cellosaurus | ||
| YAR | 인간 | Lymphoblastoid | EBV-transformed B cell | 인간 Immunology ECACC Cellosaurus |
참고자료
- 〈세포 배양〉, 《위키백과》
- 〈세포배양〉, 《생명과학대사전》
- "Cell culture", Wikipedia
같이 보기

 위키원
위키원