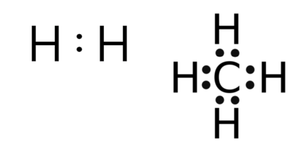공유결합
공유결합(共有結合, covalent bond)은 원자들이 각각 전자를 내놓아 전자쌍을 만들고, 이 전자쌍을 공유함으로써 형성되는 결합이다. 서로의 전자를 쌍으로 공유하기 때문에 공유에 참여하는 전자의 개수는 항상 짝수가 된다.
공유결합에 참여하는 전자쌍을 '공유 전자쌍', 공유 결합에 참여하지 않는 전자쌍을 '비공유 전자쌍'이라고 한다.
두 원자 사이에 공유하는 전자쌍의 수에 따라 단일 결합, 2중 결합, 3중 결합으로 구분한다.
- 공유 결합의 형성의 예
㉠ 비금속의 홑원소 물질 : H₂, O₂, N₂, F₂ 등
㉡ 서로 다른 비금속 원소 사이 : 염화수소(HCl), H₂O 등
㉢ 탄소 화합물 : 메탄(CH₄), 아세칠렌(C₂H₂) 등
개요
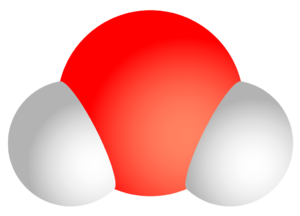
화학 결합은 크게 염화소듐(NaCl)과 같이 양이온과 음이온이 결합하는 이온결합, 자유 전자를 통해 금속 원자들이 결합하는 금속결합, 그리고 공유결합으로 나뉜다. 공유결합은 말 그대로 원자들 사이에 전자쌍을 공유하여, 그 결과 원자 사이의 인력과 반발력이 균형을 이루어 만들어지는 결합이다. 공유결합은 전기음성도(electronegativity) 차이가 크지 않은 비금속 원소들 사이에서 주로 만들어진다. 거의 모든 유기화합물과 일부 무기화합물은 공유결합으로 이루어져 있다. 공유결합으로 만들어진 물질을 분자로 분류하기 때문에 공유결합은 분자에 대한 정의 개념 중 하나이기도 하다. 염화소듐이나 금속을 분자로 분류하지 않는다. 금속 원자 혹은 이온에 전자쌍을 제공하는 리간드와의 결합을 배위결합이라고 부르는데, 배위결합은 공유하는 전자쌍을 리간드에서 일방적으로 제공하는 공유결합의 한 가지이다.
루이스 구조식
원자들이 결합할 때 전자쌍을 공유한다는 개념은 1916년 루이스(Gilbert Lewis, 1875-1946)가, 공유(covalence)라는 단어는 1919년 랭뮤어(Irving Langmuir, 1881-1957)가 처음 도입하였다. 공유결합이라는 단어는 1939년에 만들어진 것으로 알려져 있다.1) 공유 결합에 관한 좀 더 자세한 이론으로는 원자가 결합 이론(valence bond theory)과 분자 오비탈 이론(Molecular orbital theory)이 있는데, 여기서는 이들 이론보다 훨씬 간단한, 루이스가 고안한 구조식을 사용하여 공유 결합을 살펴본다. 루이스 구조식은 결합에 관여하는 원자가 전자(valence electron)를 점으로 표시하여 점 구조식이라고도 한다.
전자를 점으로 표현하는 것은 상당한 근사이며, 커다란 오류를 낳을 수도 있지만 공유 결합을 설명하는 데는 유용하다. 결합 전자쌍, 즉 원자들이 공유한 전자쌍의 수에 따라 단일 결합, 이중 결합, 삼중 결합으로 부르며, 전자쌍을 두 개의 점 대신 하나의 선으로 나타내기도 한다.
수소 분자에서 수소 원자들은 전자 2개를 공유한다. 수소 이외의 원자들은 다른 원자들과 전자를 공유함으로써 최외각 전자껍질에 전자 8개가 배치되는 안정한 전자 배치, 즉 옥텟 구조(octet)를 이룬다. 1주기 원소인 수소 원자는 최외각 전자껍질에 전자 2개가 있으면 안정하다. 메테인의 탄소 원자는 옥텟 규칙을 만족하고 있다. 옥텟 규칙에는 예외들이 있어 어떤 원자들은, 예컨대 붕소(B)와 같은 원자들은 옥텟 규칙을 만족하지 않아도 안정한 결합을 만든다.
공유결합 분자의 구조
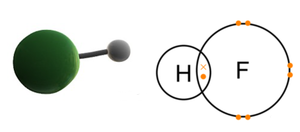
공유결합은 분자 내부의 결합이다. 탄소 원자는 다양한 공유결합을 할 수 있어 탄소로 이루어진 분자의 종류는 엄청나게 많으며, 그 구조도 매우 복잡하다. 가장 간단한 분자인 이원자 분자(diatomic molecule)는 수소, 산소, 질소 분자와 같이 종류의 원자로 이루어진 동핵 이원자 분자(homonuclear diatomic molecule)와 염화 수소, 플루오르화 수소 같이 서로 다른 원자로 이루어진 이핵 이원자 분자(heteronuclear diatomic molecule)로 나뉜다. 서로 다른 원자들, 즉 전기 음성도 차이가 있는 원자들 사이에 공유 결합이 만들어질 때 결합 전자의 쏠림이 일어나므로 이온 결합 성질이 일부 있다고 표현하기도 한다.
동핵 이원자 분자의 경우 구성 원자의 전기음성도 차이가 없으므로 전자는 분자 전체에 균일하게 분포되어 있다. 이런 분자를 외부에서 볼 때 양전하의 중심과 음전하의 중심은 일치하며, 이런 분자는 무극성(non-polar) 분자이다. 이핵 이원자 분자의 경우 구성 원자들의 전기음성도 차이로 인해 전자가 전기음성도가 큰 원자 쪽으로 쏠려 양전하의 중심과 음전하의 중심이 분리되며, 이런 분자는 극성(polar) 분자이다. 분자의 극성 정도를 표시하는 척도는 쌍극자 모멘트(dipole moment)이다.
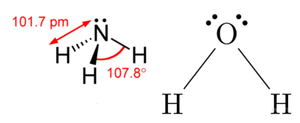
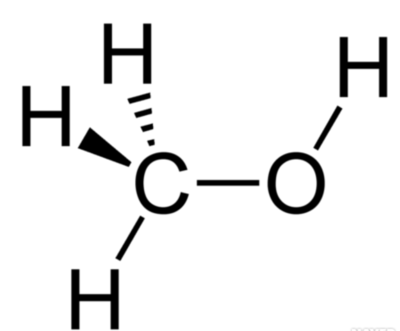
메탄, 암모니아, 물 분자는 모두 단일 결합으로 이루어져 있다. 결합 공유 전자쌍이 물 분자에는 2쌍, 암모니아 분자에는 3쌍, 메탄 분자에는 4쌍 존재하며, 암모니아와 물 분자에는 다른 원자와 공유하고 있지 않은, 비공유 전자쌍이 각각 1쌍, 2쌍 있다. 공유 전자쌍과 비공유 전자쌍의 수로부터 분자의 구조를 어림할 수 있는데, 이와 관련된 이론을 원자가 전자쌍 반발 이론(valence shell electron pair repulsion theory, VSEPR theory)이라고 한다.
결합 차수
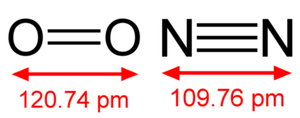
공유결합의 결합 차수(bond order)는 결합 세기의 지표로, 결합하는 원자들이 정해져 있을 때 결합 차수가 높을수록 강한 결합이 되며, 결합 길이는 감소한다. 결합 차수를 정의하는 방법에는 여러 가지가 있지만, 가장 간단한 정의는 공유 전자쌍의 수이다. 즉, 공유 전자쌍이 1쌍이면 결합 차수가 1인 단일 결합, 2쌍이면 이중 결합, 3쌍이면 삼중 결합이다.
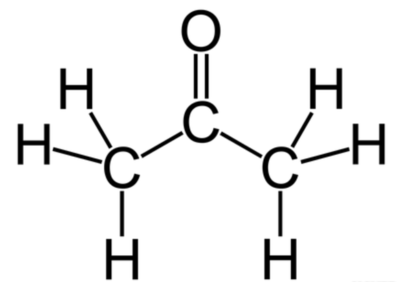
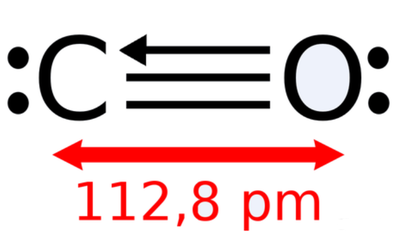
메탄올, 아세톤, 일산화 탄소 분자에서 볼 수 있듯이 탄소-산소 결합은 단일, 이중, 삼중 결합 모두 가능하다. 하지만 탄소-수소 결합은 모두 단일 결합으로, 수소 원자는 다른 원자와 안정한 다중 결합을 만들지 않는다. 일산화 탄소의 산소 원자와 탄소 원자 사이의 화살표는 형식 전하)와 관련된다.
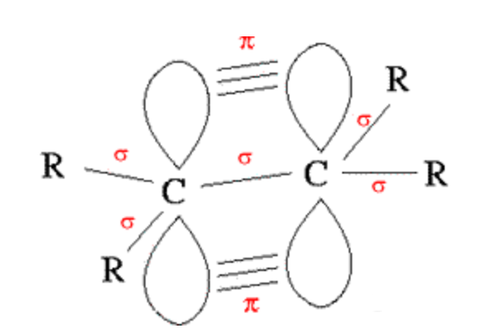
단일 결합은 두 원자핵을 연결하는 분자축에 전자 밀도가 집중되어 있는 시그마 결합(σ)이다. 루이스 구조식에서 전자를 점으로 표현하지만 실제 전자는 구름과 같이 퍼져 있다. 이중 결합과 삼중 결합은 시그마 결합과 파이(π) 결합이 함께 결합되어 있다. 이중 결합에는 파이 결합이 하나, 삼중 결합에는 파이 결합이 두 개 있다. 파이 결합은 오비탈이 연결된 형태로 전자 밀도가 높은 부분이 분자축에서 벗어나 있다.
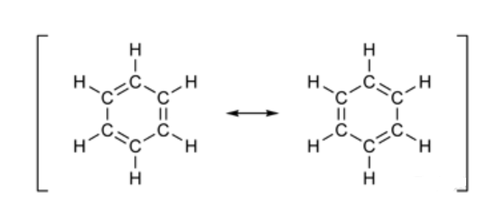
분자에 따라서는 결합 차수를 정하기가 쉽지 않은 경우도 많다. 질소 원자를 포함하는 분자들의 경우, 예컨대, 일산화 질소 같은 분자의 경우 홀수의 전자가 있으므로 쌍을 이루지 못하는 전자가 있을 수밖에 없다. 일산화 질소의 결합 차수는 2.5인데, 이런 경우 루이스 구조식만으로는 결합 차수를 정하기가 어려우며, 분자 오비탈 이론과 같은 좀 더 세련된 결합 이론이 필요하다. 또 다른 잘 알려진 경우는 공명 구조(resonance structure)를 가진 분자들로, 벤젠이 대표적인 예이다. 벤젠의 탄소 원자들 사이의 결합은 단일 결합일 수도 이중 결합일 수도 있는데, 실제 탄소 원자들 사이의 결합은 단일 결합도 이중 결합도 아닌 그 중간 정도이다.
결합 길이와 결합 에너지
공유결합의 결합 길이는 보통 결합하는 두 원자의 공유 결합 반지름의 합으로 표시된다. 공유결합 반지름은 원자 반지름과 비슷한 경향을 보이는데, 많은 자료에 기초한 평균 값이다. 결합 에너지는 결합하고 있는 두 원자를 서로 무한히 멀리 떨어뜨리는 데 필요한 에너지로 정의된다. 아래 그림은 두 개 아르곤 원자 사이의 거리에 따른 퍼텐셜 에너지 변화를 보여준다. 이 퍼텐셜 에너지 곡선은 기본적으로 원자를 구성하는 입자들의 정전기적인 특성에 기초한 것이다. 원자에 전자가 많고, 전자의 분포는 그 원자와 결합된 다른 원자들의 영향을 받으므로 이 곡선은 상황마다 각기 다르며, 이 곡선을 정확하게 수학적으로 표현하기는 불가능하다. 이 그림을 참조로 결합 길이와 결합 에너지를 생각해보자. 물론 아르콘 이합체(Ar₂)는 상온에서 안정한 분자가 아니며, 아르곤 원자 사이의 결합은 공유 결합보다 훨씬 약하다.
퍼텐셜 에너지가 가장 낮은 두 원자 사이의 거리가 결합 길이이다. 보통 두 원자 사이가 무한히 멀어져 있을 때의 에너지를 기준(0)으로 하고, 결합이 만들어질 때 안정화되어 방출되는 에너지를 결합 에너지로 정의한다. 결합이 만들어지는 과정은 멀리 떨어져 있는 두 원자가 가까워지는 과정이다. 즉, 그림의 왼쪽에서 출발하여 퍼텐셜 에너지가 최소가 되는 지점에 다다르는 과정이다. 이 과정에서 퍼텐셜 에너지는 낮아지며, 그 에너지 차이가 결합 에너지이다. 이 그림에서 아르곤 이합체의 결합 에너지가 100 cm⁻¹, 결합 길이가 3.8 A = 380 pm 임을 알 수 있다. 상온의 에너지가 200 cm-1 정도이다. 상온에서 아르곤 이합체의 운동 에너지는 결합 에너지보다 훨씬 커서 이합체는 안정한 결합을 유지할 수 없다. 보통 화학 결합은 수백 kJ mol⁻¹ 정도이다. 100 kJ mol⁻¹ 에너지를 cm⁻¹ 단위로 환산하면 8400 cm⁻¹ 정도이다. 공유 결합의 길이는 수소 분자의 경우 74 pm이며, 유기 화합물에서 관찰되는 탄소-탄소 원자 결합 길이는 결합 차수에 따라 120~150 pm 범위를 보인다.
참고자료
같이 보기
| ||||||||||||||||||||||

 위키원
위키원