백금
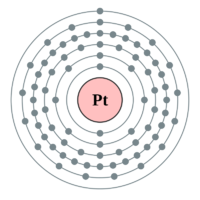
백금(白金, Platinum)은 화학 원소로 기호는 Pt, 원자 번호는 78이다. 플래티나(platina)라고도 한다. 무겁고, 가단성과 연성이 있는 귀금속으로, 전이 금속에 속한다. 니켈 광석이나 구리 광석, 또는 자연 금속 상태로 산출된다. 또한 백금은 훌륭한 촉매이다. 장신구나 실험 장비, 전기 콘센트, 의료 기기, 자동차 배출 가스 제어 장치 등에 사용된다. 백금은 가치가 아주 높은 금속이다. 내부식성, 내마모성이 우수하다. 클라크수 0.0000005(5×10-7)(제74위)이다.
백금은 금(Au)과는 전혀 다르며 금에 합금을 한 화이트골드와는 달리 천연적으로 하얀 색깔을 띤 희귀한 금속이다. 백금의 이름은 '작은 은'을 뜻하는 스페인어 플라티나(platina)에서 유래됐다. 스페인의 군인이자 천문학자인 안토니오 데 울로아가 1748년 그의 저서 '남미의 서해안 탐험기'에서 백금을 '핀토의 작은 은(Platina del Pinto)'이라고 명명했다. 당시 유럽인들은 백금을 녹일 수 없어서 '미지의 금속'이라고 불렀다. 백금은 융점(섭씨 1768도)이 상당히 높아 19세기에 들어서야 비로소 용해시켜 다룰 수 있었다.
백금은 '귀금속의 다이아몬드'라고도 불릴 정도로 고급 보석으로 사용된다. 지구상에서 백금이 발견되는 곳은 아주 적으며 금보다 35배나 더 희귀하기 때문이다. 백금은 이처럼 금과 같은 귀금속으로 분류되지만 대부분 산업용으로 쓰인다. 연간 생산량 중 60%가 산업용으로 쓰이기 때문에 '실물경제의 바로미터'라고 불린다.
백금을 가장 많이 쓰는 곳은 자동차 회사로, 배기가스를 정화하는 촉매제의 원자재로 사용된다. 특히 백금은 물에서 수소를 끌어내는 전기분해 과정과 연료전지에서 모두 중요한 역할을 한다. 연료전지는 수소 등을 투입해 화학반응을 일으켜 전기를 만드는 장치인데 이를 만들려면 백금이 꼭 필요하다. 게다가 수소를 얻기 위해 물을 전기분해하는 과정에서도 백금이 사용된다. 이렇게 주로 백금을 수소 산화 반응용 음극 촉매로 사용하는 기존 수소연료전지는 희소성과 높은 가격 뿐만 아니라 연료전지 내 물 범람, 반응 기체 공급 이상 등이 발생해 촉매의 안정성에 걸림돌로 작용했다. 그리하여 이리듐-루테늄 합금 비율을 최적화하여 수소 산화 반응과 산소 발생 반응에서 모두 우수한 촉매를 개발해 연료전지 음극에서 백금 촉매를 대체하는 연구가 국내에서 이루어졌다.
월스트리트저널(WSJ)에 따르면 2020년 11월 백금 가격은 14%나 올라 트로이온스당(트로이온스는 31g) 964.90달러를 기록했다.[1] [2]
상세[편집]
주기율표 제10족에 속하는 백금족 원소이다. 밀도는 +20℃에서 21.45g/cm3로, 천연 원소 중에서는 오스뮴((Os), (밀도 22.59g/cm3))과 이리듐((Ir), (밀도 22.56g/cm3))다음으로 높다. 결정구조는 면심입방격자구조이고, 자성은 상자성이고, 부피 탄성 계수는 230GPa이고, 전단 탄성 계수는 61GPa이고, 모스 굳기계는 4〜4.5이다.
아름답고 부식이 잘 되지 않는 최고의 귀금속인 백금은, 지각 무게의 약 1ppb (1x10-7%)를 차지하는 희귀 원소로, 존재비는 은(Ag)의 약 1/100, 금의 약 1/4 이지만, 백금족 원소 중에서는 팔라듐 다음으로 많이 존재한다. 가소성이 있으며, 밀도가 높고 은백색을 띤다. 순수 백금은 광택이 나는 은백색을 띠며, 연성과 전성이 있다. 그러나 천연 백금은 불순물이 들어있어 부서지기 쉽다. 녹는점은 1768℃로 금의 1064℃보다 월등히 높고, 철의 녹는점 1538℃와 비교해도 200℃이상 높다.
화학 반응성은 매우 작아, 공기 중에서는 여간한 온도에서도 산화되지 않는다. 염산(HCl), 질산(HNO₃) 등 대부분의 산에 녹지 않으나, 뜨거운 왕수(진한 염산과 질산의 3:1 혼합물)에는 녹으며, 아주 뜨거운 알칼리에도 녹는다. 고온에서 많은 양의 수소 기체를 흡수한다.
순수 백금은 덩어리 상태에서는 광택이 나는 은백색을 띠며, 분말은 검은색이다. 흔히 고운 백금 분말을 백금 블랙(platinum black)이라 부른다. 백금은 전성과 연성이 있으며, 쉽게 가공할 수 있고 100개 원자 두께 이하로 두들겨 펼 수 있다. 모스 경도(Mohs hardness)는 4.3으로 금(모스 경도 2.5)보다 단단하다.
전기 전도도와 열 전도도는 금이나 은의 약 1/4이다. 열 팽창계수는 금의 약 60% 정도이며, 소다 석회 유리(soda-lime glass: 일반 유리)와 거의 같아 유리에 영구적으로 접합시킬 수 있다. 결정은 면심입방(fcc) 구조를 하며, 상자기성이다.
자연에서 원소 상태의 천연 백금이나 다른 백금족 금속들과의 합금 (예로 이리듐과의 합금인 플라티니리듐, Platiniridium) 형태로 존재하기도하나, 금과는 달리 큰 덩어리로는 거의 발견되지 않으며, 대부분의 천연 백금과 합금은 표사광상(Placer Deposit)이나 충적토(Alluvial Deposit)에서 발견된다.
그리고 니켈, 구리, 철의 황화물 광석에 황화물(예로 쿠퍼라이트, Cooperite: PtS), 비소화물(예로 스페릴라이트, Sperrylite: PtAs₂) 등의 형태로 들어있기도 한다. 한편, 백금은 운석이나 달에서 채취한 암석에는 지각에서보다 높은 농도로 들어있으며, 지구상에서 유성이 충돌한 자리에도 경제적으로 채광이 가능할 정도로 높은 농도로 있기도 한다.
역사[편집]
백금으로 제작된 가장 오래된 유물은 고대 이집트의 수도 테베(Thebes, 현재의 룩소)에서 출토된 기원전 7세기의 장식함이다. 이집트 이외에 고대 그리스나 고대 로마, 중국에서는 백금 제품을 사용한 흔적이 발견되지 않았으나, 중남미의 콜롬비아와 에콰도르 부근 원주민들이 약 2000년 전에 백금 제품을 사용한 흔적이 있다. 이후 1500년대에 중남미를 정복한 스페인 정복자들은 처음에는 금에만 관심을 갖고 그곳에서 새롭게 발견된 백금에 대해서는 큰 관심을 기울이지 않았다. 이후 남아메리카에서 유럽으로 전해졌는데, 은과 비슷한 외양 때문에 은을 뜻하는 스페인어인 'plata'로부터 파생되어 작다는 뜻이 더해진 'platino(남성형)/platina(여성형)'라 불린 것이 어원이 되었다. 그리고 스페인 양반들은 이 보물을 바닷속에 처박았다.
백금에 대한 최초의 기록을 남긴 사람은 프랑스에서 활약한 이탈리아 인문학자 스칼리제르 (Julius Caesar Scaliger, 1484~1558)인데, 그는 1557년의 글에서 백금을 "중미 스페인 정복지에서 발견된 '불로도, 어떤 스페인 공예가도 녹일 수 없는' 미지의 귀금속" 이라 적고 있다.
유럽인들이 '은처럼 광택을 낼 수 있으나 은과는 달리 변색되지 않는 기이한 금속'인 백금에 대해 본격적인 관심을 기울이기 시작한 것은, 1700년대에 이르러서였다.
백금에 대한 자세한 기록을 처음으로 남겨 백금의 발견자로 간주되는 사람은 스페인의 장군이자 천문학자인 데울로아(Antonio de Ulloa, 1716~1795)이다. 그는 1735년에 파나마로 파견되어 1746년까지 남미에 근무하게 되었는데, 이때 처음 접한 백금 시료들을 모으고, 채광과 사용에 대한 기록을 하였으며, 이 기록을 정리하여 1748년에 출판하였다.
한편, 영국의 광물학자 우드(Charles Wood, 1702~1774)는 1741년에 자마이카에서 여러 컬럼비아 산 백금 시료들을 발견하고는 이들을 가져와 자신의 친척이자 의사이고 과학자였던 브라운리그(William Brownrigg, 1711~1800)에게 조사해 보도록 하였다.
브라운리그는 우드의 시료가 새로운 금속 원소이고, 녹는점이 아주 높다는 사실을 알아내고는 이 원소가 아주 중요하게 사용될 가능성이 있어 계속 연구가 필요하다는 점을 강조하면서 이 결과를 1750년에 영국왕립학회(Royal Society)에 보고하였다.
이후 유럽의 여러 과학자들이 백금에 대한 연구를 시작하였는데, 1752년에 스웨덴 화학자 세퍼(Hendrik Teofilus Scheffer, 1710~1789)는 이 금속이 비소를 사용하여 용융될 수 있으며 금보다 단단하면서 금과 비슷하게 내부식성이 있다는 연구 결과를 발표하고, 이 금속을 '백색금(White Gold)'이라 지칭하였다.
이후 '플래티넘'인 백금은 영국과 스웨덴에서는 '백색금(White Gold)'으로 알려지게 되었는데, 우리 말 '백금(白金)'도 이에서 나온 듯하다. 현재의 용어로 '백색금(White Gold)'은 금을 은, 니켈, 팔라듐 등과 합금시킨 백색의 금 합금을 일컫는 말인데, 흔히 로듐(Rh)으로 도금되어 있어 백금과 아주 비슷하게 보인다. 지금은 백금과의 혼동을 피하기 위해 '백색금' 을 보통 White Gold라 부른다.
1772년에 지킹겐(Carl von Sickingen, 1737~1791)은 백금과 금의 합금을 만들고, 이 합금을 뜨거운 왕수에 녹인 후 염화암모늄(NH₄Cl)을 가해 얻은 침전을 태워 백금 스폰지를 얻었으며, 이를 뜨거운 상태에서 두들겨 전성이 있는 순수한 백금을 처음으로 얻었다. 1784년에는 처음으로 백금 도가니가 만들어졌다.
그러나 이때까지 얻어진 대부분의 백금은 다른 금속이 불순물로 포함되어 있어 단단하고 쉽게 부서지는 것이었으며, 성질도 얻은 시료마다 크게 달랐는데, 백금을 쉽게 구부릴 수 있고 가는 선으로 뽑을 수 있게 하는 유일한 방법은 금과의 합금을 만드는 것이었다.
프랑스 출신 화학자 샤바뉴(Pierre-Francois Chabaneau, 1754~1842)는 1786년에 백금에 들어있는 불순물들을 제거하여 전성이 있는 순수한 백금을 얻는 방법을 찾는데 성공하였다.
그가 사용한 분말 야금법과 강한 가열 방법은 1912년까지 비밀에 부쳐졌다. 1803년에는 천연 백금에 불순물로 들어있던 로듐, 팔라듐, 오스뮴과 이리듐이 분리·발견되었다.
백금은 1820년까지는 주로 남아메리카에서 산출되었으나, 이후 러시아 우랄 산맥에서 백금 표사광상이 발견되어 러시아가 주된 생산국이 되었다가, 근래에는 남아프리카 공화국에서 전세계 생산량의 약 75%가 생산된다. 실제 사례로 19세기 러시아에서 백금 광산이 발견되자 기존의 부족한 은 대신 백금으로 은화를 찍어내서 쓴 적이 있다. 당시에는 은화랑 백금화가 거의 같은 가격으로 거래되었지만 현재 수집가들의 시세로는 넘사벽의 가치를 지닌다. 만약에 1828년, 1829년, 1830년에 발행된 제정 러시아 3,6,12루블 은화가 있다면 유심히 살펴보기 바란다. 은화가 아니라 백금화일 수도 있다. 심지어 무게도 각각 10.35g, 20.71g, 41.41g으로 상당한 양의 백금이 들어가있다. 발행량도 3루블 백금화가 137만 1,691장, 6루블 백금화가 1만 4,847장, 12루블 백금화가 3,474장으로 상당한 편이다. 그 외에 1820년 영국에서 9펜스 은화를 백금으로 주조하기도 했다.
한편 동아시아에서 백금(白金)이란 명칭 자체는 예전부터 존재하였다. 그러나 이 말은 원래는 은이나 은이 섞인 금광석, 혹은 옥(鋈)[2]을 뜻하는 말이었다. "산해경" 중 남산경에 "유양산에 적금과 백금이 많이 난다"라는 구절이 나오는데 이에 대해 주석에는 곽박은 은, 학의행은 옥(鋈), 이풍무는 은이 섞인 금광이라고 주석을 달았다.(참조:<산해경>, 정재서 역, 민음사) 이외에 조선조 문헌인 <국조인물고>에 유홍 조에 선조가 피난 준비를 하자 유홍이 이를 비판하는 상소를 올렸는데, 여기서 백금이 언급된다.
플래티넘의 의미로 사용한 것은 일본 에도 막부 시대 때 학자가 처음 사용했고, 현대 일본에서 귀금속 거래 시에는 플라티나란 명칭을 주로 쓴다. 이는 백색금과 혼동될 우려가 있기 때문이 아닐까 한다. 게다가 일본어로 백금의 또 다른 독음은 '시로가네'인데, 이것은 순수 일본어로 은을 가리키는 독음이기도 해서, 백금이라는 표기는 독음에 따라 전혀 다른 의미를 갖게 되는 것이다. 한국에선 백금이란 표현이 더 많은 편이라, 상대적으로 가격이 싼 화이트 골드와 혼동하여 구입자가 손해보는 일도 종종 있다.
2011년, 전 세계 신규 생산량은 192톤으로 파악된다. 전세계 매장량은 27,000톤으로 추정되는데, 이의 약 3/4이 남아프리카 공화국의 약 250km에 달하는 화성암 층인 메렌스키 리프 (Merensky Reef)에 매장되어 있다.
화학적 성질[편집]
은백색의 귀금속으로 은보다 단단하고, 전성, 연성이 있다. 냉간가공도 할 수 있으나, 보통은 800∼1,000℃로 가열하여 가공한다. 소량의 이리듐을 가하면 굳기는 뚜렷하게 증가하지만 전성은 떨어진다. 팽창률은 유리와 거의 같아서, 유리기구의 접합에 편리하다. 백금은 여러 가지 색다른 성질 때문에 귀하게 여겨진다. 백금은 금과 은 다음으로 쉽게 모양을 바꿀 수 있다. 즉 늘여서 가는 선으로 뽑을 수도 있고, 망치로 두들겨서 얇은 판을 만들 수도 있다.
공기 중의 산소나 황화합물과 거의 잘 결합하지 않기 때문에, 공기 중에 그냥 두어도 부식하거나 색이 변하지 않는다. 백금은 강한 산에도 녹지 않으며, 왕수라는 질산과 염산의 혼합물에 가장 잘 녹는다. 비소, 인, 규소와 잘 결합하며, 백금의 합금 중에는 이리듐, 니켈, 오스뮴, 팔라듐, 로듐, 루테늄과의 합금이 가장 널리 쓰인다.
염화 수소나 질산 등을 섞으면 H₂PtCl₆가 된다. 분말 또는 백금해면으로서 촉매, 도량형원기, 백금저항온도계, 실험용 도가니, 열전기쌍, 전기접점재료, 발화전, 전극, 화학장치, 다이, 노즐, 치과재료, 장식용 등으로 사용된다. 다음은 백금이 왕수에 녹는 반응이다.
Pt + 8HCl + 2HNO₃ → PtCl₆²⁻ + 2NOCl + 2H⁺ + 4H₂0
동위원소[편집]
백금은 자연에서 6가지의 동위 원소(¹⁹⁰Pt, ¹⁹²Pt, ¹⁹⁴Pt, ¹⁹⁵Pt, ¹⁹⁶Pt, and ¹⁹⁸Pt)가 있다. 이 중 가장 안정적인 동위 원소는 자연에 존재하는 ¹⁹⁵Pt로, 자연에서 33.83%를 차지한다. ¹⁹⁰Pt는 매우 적게 차지하며 그 양은 0.01%에 불과하다. 자연에 존재하는 동위 원소 중 불안정한 것은 ¹⁹⁰Pt이며, 붕괴할 때의 반감기는 650×109 년이다. ¹⁹⁸Pt는 알파 붕괴를 하고 반감기가 가장 길며 약 320×1012 년이다. 많은 양을 차지하고 안정적인 것은 질량수 195짜리이다. 백금의 동위 원소는 일반적으로 31가지로 질량수는 166에서 202까지 다양하다. 여기에 인공적으로 만들어진 동위 원소까지 합하면 37가지가 된다. 핵 이성질체 백금 동위 원소 중 가장 반감기가 짧은 것은 166Pt이며 반감기는 300 µs이다. 핵 이성질체 중 반감기가 가장 긴 것은 ¹⁹³Pt이며 반감기는 50 년이다. 모든 백금의 방사성 동위 원소는 베타 붕괴와 알파 붕괴를 한다. ¹⁸⁸Pt, ¹⁹¹Pt, and ¹⁹³Pt는 내부 전환을 하며. ¹⁹⁰Pt와 ¹⁹⁸Pt는 이중 베타 붕괴를 한다.
화학적 반응성[편집]
공기나 수분 등에는 매우 안정하여 고온으로 가열해도 변하지 않고, 산·알칼리에 강하여 내식성이 크다. 다만 왕수에는 서서히 녹고, 가성알칼리와 함께 고온으로 가열하면 침식된다. 플루오린, 염소, 황, 셀레늄 등과 가열하면 반응한다. 또, 고온에서는 탄소를 흡수하고 냉각하면 이것을 방출하는데, 이때 백금의 표면이 물러지므로, 석탄, 코크스 또는 탄소가 많은 환원불꽃 등으로 가열하는 것은 피하는 것이 좋다.
비소, 안티모니, 비스무트, 주석, 납 등과는 녹는점이 백금보다 훨씬 낮은 합금을 만든다. 미세한 분말로 한 백금은 그 부피의 100배 이상의 수소를 흡수하며, 적열한 백금은 수소를 흡수하여 투과시킨다. 또 산소, 헬륨 등도 흡수하는데, 흡수된 수소나 산소는 활성화되므로 산화환원의 촉매로서 중요하다.
화학적 화합물[편집]
백금의 산화 상태는 보통 +2나 +4이다. 산화 상태 +1, 산화 상태 +3 은 그 비율이 매우 적다. 백금(II)는 정방정계결정 구조를 띠고 있다. 백금은 다른 기체와 함께 산이 되면 육클로로백금산 ("H₂PtCl₆", (H₃O)₂PtCl₆·nH₂O )가 된다.
Pt + 4HNO₃ + 6HCl → H₂PtCl₆ + 4NO₂ + 4H₂O 백금의 화합물은 이 외에도 다양하다. 아연 화합물의 경우, 평평하여 거울처럼 생겼으며, 광택이 난다.
백금은 염화 암모늄과 반응을 하여 육클로로백금산암모늄을 만든다. 백금의 암모늄 화합물은 불용성을 띤다. 이것을 가열하면 수소는 기체가 되어 날아가서 다시 순수한 백금으로 돌아가게 된다. 백금은 몇 번이고 재활용이 가능하다. 헥사클로로백금산칼륨은 역시 불용성이며, 여기서 칼륨은 칼륨 이온으로 양이온화가 된다.
헥시클로로백금산의 경우에는 백금이 염화 백금(IV) 또는 염화 백금(II)의 원소 형태를 띤다. 이 반응은 다음의 식과 같다.
(H₃O)₂PtCl₆ ∙ nH₂O → PtCl₄ + 2HCl + (n+2)H₂O
PtCl₄ → PtCl₂ + Cl₂
PtCl₂ → Pt + Cl₂
백금(II)와 백금(IV), 육플루오린화백금은 산화 상태가 높다.
산화 백금의 화학식은 PtO₂이며, 이 형태의 산화 백금은 다른 산과 결합이 가능하다. 다음은 그 반응이다.
2Pt²⁺ + Pt4⁴⁺ + 4O2 → Pt₃O₄
백금으로는 항암제를 만들기도 하는데 백금으로 만든 항암제에는 두 가지가 있다. 하나는 시스플라틴으로 고환 종양에 효과가 있다. 분자식은 H₆ Cl₂N₂Pt이다. 또 하나는 카보플라틴으로 분자식은 C₆ H₁₄N₂O₄Pt이다. 카보플라틴은 선플라의 유도체이기도 하다.
백금의 산출[편집]
흔히 사력 속에 알갱이 또는 모래 모양으로 산출되므로, 이것을 선광하여 백금광으로 한다. 이것은 왕수에 녹여서 클로로백금산을 만들고, 염화암모늄을 가해서 침전시켜 다른 금속과 분리한다. 이렇게 해서 얻은 클로로백금산암모늄((NH₄)₂PtCl₆)를 700∼800℃로 가열하면 해면 모양으로 된 검은 색의 백금해면을 얻는다.
(NH₄)2₂PtCl₆ → Pt + 2NH₄Cl + 2Cl₂
이 백금해면을 융해 또는 단조하여 백금 덩어리를 얻는데, 보통 석회 도가니 속에서 산수소불꽃 등의 직접 가열에 의해 융해한다. 유리 상태 또는 다른 동족 원소와의 합금으로서 산출되며, 러시아의 우랄지방, 남아프리카, 콜롬비아, 캐나다 등이 주산지이다. 순도는 75∼85%이고, 불순물은 다른 백금족원소이다. 한국에서는 주로 구리를 전기 제련할 때 부산물로서 얻는다.
용도[편집]
백금은 단단하고 아름다우며, 부식이 되지 않으므로 반지, 팔찌, 귀걸이 등의 장신구에 사용된다. 특히 황금보다 단단하고 열팽창률이 작아 보석을 세팅하는데 금보다 선호된다. 그래서 많은 사람들은 백금의 가장 중요한 용도가 장신구라 생각하겠지만, 생산된 백금의 약 30%만 이 용도로 사용되고, 실제 가장 중요한 용도는 화학 촉매를 비롯한 산업적 이용이다. 장신구 및 자산으로써 백금의 가치는 금보다 인정받지 못하기 때문에, 금보다도 더 물량 자체는 훨씬 더 희소함에도 불구하고 가격은 더 낮다. 2020년 4월 17일 기준 금 한돈(3.75g)에 25만원이지만 백금은 한돈에 13만원으로 백금이 금의 반값이다. 온스(28.34g) 단위로 치면 금은 1740.2달러, 백금은 800.6달러이다.
하여간 산업적으로는 수소화, 탈수소화, 이성질체화 반응 등의 촉매로 사용되는데, 이들 반응은 연료, 비료, 플라스틱, 합성섬유, 의약품, 실리콘 수지 등을 생산하는데 이용된다.
백금은 특히 자동차 배기가스를 정화하는 촉매변환기에 널리 사용된다. 또한, 백금과 백금 합금은 단단하고 부식성이 거의 없어, 치과 보철 재료, 전기 접점, 전극, 화학 실험 장치, 인공 심장박동 조절기(Pacemaker) 등에 다양하게 쓰인다. 한편, 몇 가지 백금 화합물들은 항암제로 시판되어 사용되고 있다.
영단어 platinum은 집합 명사로 따로 단복수가 없다. 다음 사전에는 플래티나가 단수형이라고 되어 있는데, 늘 그렇듯이 이런건 공신력 있는 영어 사전을 참조하자. 라틴어에서라면 플라티눔이 단수고 플라티나가 복수다. 미국식 영어로는 플랫(으)넘 식으로 발음되고 영국식 영어론 플라티넘 정도로 발음된다. 명사로서 백금을 의미하고 형용사로는 백금과 비슷한 색이라는 의미가 있다.
만년필 닙의 장식소재로 단골이다. 당연히 주재료로 쓰이진 않고, 14k 이상의 금닙 중 투톤닙의 은색부분이 백금이다.
상품으로는 90% 플라티나와 10% 이리듐의 합금 형태로 제작되는데, 플라티나 비율 99.9%와 0.1%의 합금비율로 제품화하는 기술은 독일과 일본만이 갖고 있다고 한다.
푸른색이 살짝나는 은색으로 은보다는 단단하고 특히 내열성과 내마모성이 강하며 금과 같이 부식에 강하다. 이때문에 킬로그램 원기의 재질로 사용되었다.
금이나 은에 버금갈 정도로 연성과 전성이 좋은 편이긴 하지만, 가공이 매우 어렵고 거래량이 많지 않기 때문에 살 때는 비싸지만, 되팔 때는 대체로 제 값을 받기 어려운 편이다. 다만, 비슷한 색의 은이나 화이트 골드와 달리 부식되지 않는 성질을 지녀 다이아몬드에 가장 잘 어울리는 금속이라는 평을 받는다. 장신구로 쓰이는 금속 중 가장 비싼 금속으로 순금(24k)보다 시세가 높았었으나 2016년 6월 기준으로는 더 싸다. 2017년 5월 현재 18K 화이트 골드와 시세가 거의 동일할 정도로 가격이 내려갔다. 금이 만원일 때 백금은 6천8백원 정도였다.
순도는 1000‰ 대비 Pt999, Pt990, Pt950, Pt900, Pt850, Pt750, Pt700, Pt585, Pt505, Pt500, Pt100 식으로 표기한다. 일반적으로 쉽게 접할수 있는 최고순도는 Pt950 정도다.
희귀원소(지구상에서의 존재량 또는 산출량이 적은 원소)이며 유리 상태 또는 다른 동족 원소와의 합금으로 산출되며 주산지는 러시아의 우랄지방·남아프리카·콜롬비아·캐나다 등이 있다. 매장량은 금보다 훨씬 많은데도 불구하고 양이 적은데다가 부피당 40배의 수소를 잡아둘 수 있어서 수소전지의 촉매로 각광받고 있는 등 여러 특성 때문에 다른데에도 수요가 무진장 높다.
백금으로 이루어져있는 소행성이 지구-달 사이 거리의 6.4배 위치를 지나간 바 있다. 소행성 이름은 2011 UW158이며 지름은 최대 300×600m 이고, 무게는 무려 1억 톤 가량 이라고한다. 소행성의 가치는 미화 5조 4000억 달러, 우리 돈으로 자그마치 6000조가 넘는다고한다. 전세계 연간 백금 생산량이 100톤 내외이므로, 현재 생산량을 기준으로 하면 100만년은 쓸 수 있는 양이다! 물론 이게 인구 밀집 지역에 추락 하면...
한국에서는 주로 구리를 제련할 때 부산물로써 얻는다. 전성(展性)과 연성(延性)이 풍부한 은백색의 금속 원소로 은보다 단단하며 녹슬지 않는다. 산화·환원의 촉매로 쓰거나 장식품, 화학 기계, 도량형기, 전극 따위로 쓴다.
한국에서 백금을 가장 많이 소유한 곳은 코닝정밀소재이다. 2011년 기준 1조 5천억원 가치로 코닝정밀소재 고정자산의 절반인데, 이는 코닝정밀소재의 주요 생산품인 LCD 기판유리의 생산에 백금이 필요하기 때문이다. 이 LCD 기판유리를 생산하기 위해선 1600도의 고열을 내야 하는데 이것을 견딜 용광로 배관 등의 소재로 백금을 쓰는 것이다.
자연백금과 모조백금 두가지로 나뉘는데 자연백금은 천연으로 나는 백금. 등축 정계(等軸晶系)에 속하며, 회색이나 은색을 띠는데, 소량의 금·동·철·니켈 따위를 함유하기도 한다 모조백금은 금에 백금·파라듐·은·니켈·아연 따위를 섞어 만들며, 장식용이나 치과용으로 쓴다. 금에 백금을 섞은 모조 백금이 바로 화이트 골드이다.
백금 원자를 이용한 항암제 군도 따로 존재하며 백금착체 라고 부른다. platin 계열의 항암제가 여기에 포함된다. 참고로 국내 최초로 개발된 신약이자 항암제인 선플라주도 3세대 백금착체이다.
각주[편집]
- ↑ 이장훈 국제문제 애널리스트, 〈백금과 구리 전성시대 도래〉, 《매거진한경》, 2020-12-23
- ↑ 김지완 기자, 〈수소차 배터리 성능 향상시키는 합금촉매 개발〉, 《뉴스핌》, 2020-07-22
참고자료[편집]
- 〈백금〉, 《위키백과》
- 〈백금〉, 《나무위키》
- 〈백금〉, 《네이버 지식백과》
- 이장훈 국제문제 애널리스트, 〈백금과 구리 전성시대 도래〉, 《매거진한경》, 2020-12-23
- 김지완 기자, 〈수소차 배터리 성능 향상시키는 합금촉매 개발〉, 《뉴스핌》, 2020-07-22
같이 보기[편집]
| ||||||||||||||||||||||

 위키원
위키원