"산화물"의 두 판 사이의 차이
잔글 (→같이 보기) |
잔글 (→같이 보기) |
||
| 95번째 줄: | 95번째 줄: | ||
{{화합물|검토 필요}} | {{화합물|검토 필요}} | ||
| + | {{배터리 기술}} | ||
2023년 5월 20일 (토) 08:44 기준 최신판
산화물(酸化物, Oxide)은 산소와 다른 원소의 화합물을 말한다. 지구의 지각은 대부분 산화물로 이루어져 있다. 화학 원소가 대기 중의 산소와 결합하면 산화물을 만든다. 탄화수소가 연소하면서 탄소의 산화물인 일산화 탄소와 이산화 탄소를 배출한다. 불순물이 섞이지 않은 순수한 원소라 하더라도 대개 표면은 산화물로 덮인 경우가 많다. 예를 들어 알루미늄 포일은 얇은 산화 알루미늄(Al₂O₃)의 막으로 덮여 더 이상의 부식을 막아준다.
대부분의 원소는 대기 중의 산소와 결합하여 산화물을 만든다. 일부 원소(리튬, 나트륨, 칼륨, 루비듐, 세슘, 스트론튬, 바륨 등)의 경우는 물이나 산소와 만나면 빠르게, 경우에 따라서는 위험할 정도로 빠르게 반응하여 수산화물이 된다. 이런 이유로 알칼리 금속과 알칼리 토금속은 지구 상에 순수한 금속 형태로는 존재하지 않는다. 세슘의 이런 반응성 때문에 진공관에서 잔류 기체를 없애는 게터로 사용되며, 칼륨과 나트륨의 액체 합금인 나크 합금(NaK)은 유기 용매에서 산소와 수소를 제거하는데 쓰인다. 공기와 접하는 대부분의 금속은 표면이 산화물이나 수산화물로 덮여 있다. 알루미늄 포일은 잘 알려진 예이다. 알루미늄 포일 표면의 얇은 산화막은 더 이상의 부식을 막아준다. 고체 마그네슘이나 알루미늄은 표준 온도 압력 하에서는 다른 금속처럼 산소와 천천히 반응하지만, 고압 환경에서는 발화한다. 또한, 대부분의 미세한 금속 분말은 공기 중에서 폭발을 일으킬 위험성이 높다.
건조한 산소와 만나면 철은 산화철(II)를 만들지만, 산소와 물이 함께 작용하여 녹이라 불리는 수화물 형태인 Fe₂O₃₋₂ₓ(OH)ₓ를 만든다. 35억 년 전, 광합성을 하는 세균이 나타나면서 만들어진 자유 산소로 인해, 철 광석을 함유한 지층인 호상철광층을 만들기도 했다.
전기 음성도로 인해 산소는 거의 대부분의 원소와 화학 결합을 해서 산화물을 만든다. 금이나 백금과 같은 귀금속은 산소와 직접 결합하지는 않지만, 간접적인 방법으로 산화 금(III)과 같은 산화물을 만들 수 있다.
목차
개요[편집]
산화물이란 -2 또는 O²⁻와 같은 산화 상태의 산소 이온과 결합한 물질을 의미한다. 또한 음이온으로서 O²⁻를 함유하는 임의의 화합물도 산화물의 범주에 포함된다. 조금 더 넓은 의미로는 산소가 음이온으로 작용하는 모든 화합물을 의미하기도 한다.
산소는 다른 원소와 친화력이 강하여 비활성 기체를 제외한 거의 모든 원소와 화합물을 만드는데, 일반적으로 원소 간의 직접 반응 또는 산화제와의 작용에 의해서 생성된다. 예를 들면, 탄소와 황 또는 금속 마그네슘을 산소 속에서 연소시키면 각각 이산화탄소 CO₂, 아황산가스 SO₂, 산화마그네슘 MgO 등의 산화물을 얻는다.
산화물 중에서 전형적인 비금속 원소의 산화물은 대부분 공유결합성 분자로 이루어지며, 일반적으로 물에 녹아 산을 생성하므로 산성 산화물이라고 한다. 이것들은 비금속 원소의 전기 음성도가 약해지면 산으로서의 성질이 약해져서 거대분자를 생성하여 물에 난용성이 되는 경향이 있다. 또 전형적인 금속원소의 산화물은 대부분 O²⁻을 함유하는 이온 결정이며, 물에 녹아 알칼리성을 보이므로 염기성 산화물이라 한다. 또한 산성 산화물과 염기성 산화물을 생성하는 중간 원소의 산화물은 산에 대해서는 염기, 염기에 대해서는 산으로 작용하므로 양쪽성 산화물이라 한다.
한 금속 원소가 몇 개의 산화수를 보이는 것에서는 산화수가 높은 산화물은 산성 산화물, 산화수가 낮은 산화물은 염기성 산화물, 중간의 것은 양쪽성 산화물을 생성하는 일이 많다.
산화물의 형성[편집]
전기음성도가 가장 큰 플루오린에 이어 두 번째로 전기음성도가 큰 산소는 거의 모든 원소와 안정한 화학 결합을 이루어 산화물을 형성한다. 하지만 금이나 백금 같은 귀금속은 산소와 직접 반응하지 않으며 산화 금(III)과 같은 귀금속의 산화물은 간접적인 방법으로만 만들어진다.
원소의 부식에는 두 가지 독립적인 방법이 있는데, 가수분해와 산소에 의한 산화가 그것이다. 산소가 풍부한 조건에서 모든 원소는 연소하며, 물과 산소가 동시에 있으면 부식이 더 잘 일어난다. 공기, 물과 산소가 존재하는 조건에서 소듐을 포함한 몇몇 원소는 빠르게 반응하여 수산화물을 형성하기에, 알칼리 금속과 알칼리 토금속은 자연에서 순수한 금속 상태로 존재하지 않는다. 이러한 성질을 이용하여 산소와 매우 잘 반응하는 세슘은 진공관에서 게터(getter, 진공관에서 잔류 가스를 흡수하는 물질)로 쓰이며, 포타슘과 소듐의 고용체 소듐화 포타슘(NaK)은 몇몇 유기용매를 탈 산화 및 탈수하는 데 사용한다.
공기 중에서 대부분의 금속 표면은 산화물과 수산화물로 되는 데, 흔히 사용하는 알루미늄 포일도 표면에 알루미늄 산화물의 얇은 막이 형성되어 내부의 부식을 막을 수 있다. 고체 마그네슘과 알루미늄은 표준 온도와 압력(STP) 조건에서 산소와 천천히 반응하는 편이지만, 대부분의 다른 금속들이 그렇듯 공기 중에서 연소하면서 열을 많이 낸다. 미세하게 분쇄된 가루 형의 금속들은 대부분 공기 중에서 폭발성을 가져 위험하기에 이들은 종종 고체-연료 로켓에 사용되기도 한다.
산화 철(III)이나 녹과 같은 산화물은 수화된 산화 철(III)(Fe₂O₃·nH₂O)과 산화-수산화 철(III)(FeO(OH), Fe(OH)₃)로 구성되어 있다. 건조한 산소 하에서는 철이 산화 철(II)를 형성하나 산소와 수분이 있는 곳에서는 녹의 주성분인 수화된 산화 철(III)(Fe₂O₃−ₓ(OH)₂ₓ)로 변한다.
35억년 전에 광합성 박테리아에 의한 산소 생성은 바다 속 용액으로부터 철이 산화 철로 침전되는 것을 이끌었고, 이는 경제적으로 유용한 적철석(hematite)을 형성하였다.
산화물의 구조[편집]
산화물은 개별 분자부터 고분자성 격자나 결정성 구조까지 광범위한 구조를 가질 수 있으며, 표준 조건에서 산화물은 고체부터 기체까지 다양한 형태로 존재한다.
금속 산화물[편집]
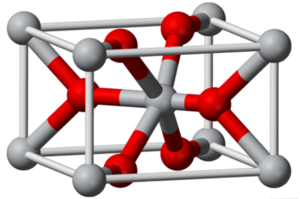
대부분의 금속 산화물은 고분자성 격자 구조를 갖는다. 일반적으로 산소 이온이 세 개의 금속 이온을 연결하거나 (루타일(rutile) 구조), 여섯 개의 금속 이온을 연결한다 (카보랜덤(carborundum) 또는 암염(rock salt) 구조).
M-O 결합은 대부분 강하므로 이들 화합물은 상호결합한(cross-linked) 격자이며, 이들 고체 중에는 용매에 녹지 않는 것이 많고, 산과 염기의 공격을 받기도 한다. 화학식 자체는 단순하지만, 대부분이 비화학량론적(nonstoichiometric) 화합물이다.
분자성 산화물 - 몇 가지 중요한 기체상 산화물[편집]
이산화 탄소는 화석 연료가 연소할 때 발생하는 주요 생성물이다. 한편, 일산화 탄소는 탄소-기반 연료가 불완전 연소했을 때의 생성물인데, 여러 화합물의 유용한 전구체로 쓰인다.
이산화 질소(NO₂)는 내연 기관 엔진으로부터 나오는 유독성 오염원이고, 아산화 질소(N₂O)는 일명 웃음 기체라고도 하는데 토양 속 박테리아에서 생성되는 유력한 온실 가스이다. 오산화 인은 명칭에서 다소 혼란이 오지만 실제 구조는 [P₄O₁₀]이다.
한편, 황의 주요 산화물인 이산화 황은 화산에서 방출된다. 고분자 상태의 셀레늄과 황 산화물은 고온에서 탈고분자화하여 이산화 셀레늄과 삼산화 황을 형성하기도 한다. 금속 산화물 중에서는 분자성 산화물로 사산화 루테늄과 사산화 오스뮴이 존재하며, 불활성 기체 산화물인 삼산화 제논 등도 있다.
산화물의 성질[편집]
- 산성 산화물 vs. 염기성 산화물
산소 이온은 수산화 이온의 짝염기이고 산화 칼슘과 같은 이온성 고체에 존재한다. 수용액에서 그 이온은 양성자 이온에 대한 친화도가 매우 커서(pKb ~ -38), 다음 반응에서 보는 것처럼 안정하지 않다.
O₂⁻(aq) + H₂O(l) → 2 OH⁻(aq)
위 반응의 평형 상수는 Keq ~ 1022 로 매우 크다.
18세기에 산화물은 칼크스(calxes, calces)라고 불렀는데 이는 소성(calcination) 과정을 통해서 산화물을 만들었기 때문이며, 칼크스는 훗날 옥사이드(oxyd)로 대체되기도 했다.
한편, 산화물은 산이나 염기와 반응하기 쉽다. 즉 전기음성도가 작은 금속은 염기성 산화물을 그리고 전기음성도가 큰 비금속은 산성 산화물을 각각 형성하는 경향이 있고, 금속과 비금속 경계에 있는 준금속은 양쪽성 산화물을 형성한다. 이러한 반응성은 습식 제련(hydrometallurgy) 공정과 같이 원광석으로부터 금속을 추출하는 등의 실질적인 공정에 기본이 된다.
예컨대, 알칼리 금속, 알칼리 토금속 등의 산화물은 수분과 접촉하면 수산화물로 변한다.
예:
Na₂O(s) + H₂O(l) → 2NaOH(aq)
CaO(s) + H₂O(l) → Ca(OH)₂(aq)
따라서 이들 금속의 산화물을 염기성 산화물이라고 부르는데, 이들은 산과 중화 반응을 한다.
반면에, 몇몇 비금속 산화물은 물에 녹아 산성을 띠기에 산성 산화물이라고 하며, 이들은 염기와 반응하여 H⁺를 낼 수 있다.
예:
CO₂(g) + H₂O(l) → H₂CO₃(aq)
SO₃(g) + H₂O(l) → H₂SO₄(aq)
양쪽성 산화물로는 대표적으로 산화 알루미늄(Al₂O₃)이나 산화 주석(SnO) 등이 있는데, 이들은 산 및 염기와 모두 반응하는 경향을 갖는다.
산화물 명명법과 화학식[편집]
금속 산화물에서 금속-산소 비율에 따라 이름을 붙인다. 예컨대, 일산화 나이오븀(niobium monoxide, NbO)이나 이산화 타이타늄(titanium dioxide, TiO₂)과 같은 경우에서 보듯이 이름에 산소 개수를 나타낸다. 한편, 관용명을 쓰는 경우도 있는데, 알루미나(alumina, Al₂O3), 마그네시아(magnesia, MgO), 크로미아(chromia, Cr₂O3) 등이 그것이다.
특별한 형태의 산화물로 과산화물 또는 초과산화물이 있는데, 이때의 음이온은 각각 과산화 이온(O₂²⁻) 혹은 초과산화 이온(O²⁻)이며, 일반적인 산소 이온보다 산화수가 크다. 산소의 산화수가 양수인 이플루오린화 산소(OF₂)의 경우에는 플루오린의 산화물이라기보다는 산소의 플루오린화물이라고 하는 것이 맞다.
참고자료[편집]
같이 보기[편집]
| ||||||||||||||||||

 위키원
위키원