이산화탄소
이산화 탄소(二酸化炭素, carbon dioxide)는 탄소 원자 하나에 산소 원자 둘이 결합한 화합물이다. 화학식은 CO₂이며, 고체 상태일 때는 해빙 시에 바로 기체로 승화하므로 드라이아이스(dry ice)라고 부른다. 기체 상태일 때는 무색, 무취, 무미로 지구의 대기에도 존재하며, 화산 가스에도 포함되어 있다. 유기물의 연소, 생물의 호흡, 미생물의 발효 등으로 만들어진다. 생물의 광합성 과정에서 주로 이산화탄소를 이용하여 탄수화물이 합성된다.
이산화탄소는 가장 강력한 대뇌 혈관 확장제 중 하나이다. 고농도의 이산화탄소를 흡입했을 때 순환계에 이상을 일으켜 혼수상태 또는 사망에 이르게 할 수 있다. 다량의 이산화탄소에 노출되었을 경우 질식이 일어날 수 있다. 낮은 농도의 이산화탄소는 호흡의 증가와 두통을 일으킬 수 있다. 산소 부족으로 인한 숨 가쁨, 정신적 경계심의 감소, 근육 조정의 손상, 판단력 상실, 감각의 무뎌짐, 정신적 불안정, 피로를 일으킬 수 있다. 질식의 과정으로 구역질, 구토, 피로, 의식 상실 등이 일어날 수 있으며 심할 경우 발작, 혼수상태, 사망에 까지 이를 수 있다. 임산부에게서의 산소 부족은 태아 발육에 지장을 줄 수 있다.
목차
개요
이산화탄소는 밀도가 높은 무색 기체로, 보통 냄새가 없지만, 고농도에서는 산성의 톡 쏘는 냄새가 난다. 지구 대기에 미량으로 존재하는데, 현재 농도는 0.04 %(400 ppm(부피)) 정도이며, 이는 산업 혁명 이전보다 280 ppm 높아진 수치이다. 이산화탄소는 화산 폭발이나 온천 등에서 자연적으로 생성되지만, 호기성 유기체가 에너지를 얻기 위한 탄수화물 및 지방 대사의 호흡 과정, 유기물이 분해되거나 당이 발효되는 과정, 또는 화석 연료가 연소하는 과정에서도 발생한다. 한편, 아크릴산의 생산과 같은 대량의 산화 공정에서 원치 않는 부산물로 얻어지기도 한다. 비활성 기체로써 음식 첨가제, 팽창제 등으로 사용되며 소화기 원료로 불을 끄는 데 쓰인다.
이산화탄소는 주로 호흡 등의 연소작용으로 나타난다. 산소로 호흡하는 동물 대부분이 노폐물로 만드는 물질이다. 이렇게 나온 이산화탄소는 다시 식물이 광합성해 산소와 탄소화합물로 돌아간다. 지구에서 일어나는 '탄소의 순환' 과정 중 일부이다. 식물도 호흡은 하지만 낮에는 광합성이, 밤에는 호흡이 더 많다. 그러므로 숲에서 산림욕을 하려면 해가 있는 낮에 들어가자. 전 지구적으로 북반구의 육지 면적이 더 넓으니, 북반구가 여름일 때는 이산화 탄소량이 줄고 겨울일 때는 이산화탄소량이 느는 경향이 있다.
이산화탄소는 실온에서 기체로 존재하며 생물에게 있어 무독성이다. 그러나 일산화탄소만큼은 아니지만 높은 농도의 이산화탄소는 산소의 비중을 낮추게 되어 중독증상(호흡곤란, 어지럼증, 피로 등)을 일으키며 사람을 죽일 수도 있다. 실제로 2014년 3월 27일 삼성전자 수원사업장에서 이산화탄소 누출로 1명이 죽는 인명피해가 나왔다. 생물이 이산화탄소를 흡입하면 호흡 속도가 빠르게 촉진된다. 이때 이산화탄소가 너무 많으면 혈액이 산성화되니 위험하다. 하지만 체내 이산화탄소의 양이 부족해도 위험할 수 있다.
이산화탄소가 물과 반응하면 H₂CO₃가 만들어지는데, 다시 H+를 내어놓고 HCO₃-(탄산수소이온)이나 CO₃²⁻ (탄산이온)으로 바뀌니 산으로 작용한다. 그래서 탄산이라고도 부르며, 술(맥주, 샴페인 등)이나 탄산음료(사이다, 콜라 등)에 들어있다(콜라 같은 탄산음료의 경우에는 이산화 탄소의 무게탓에 다 마시면 병 속이 이산화 탄소로 차있어서 그대로 쭉 들이키면 속이 불편할 수 있다). 유럽 등에서 죽어라 파는 탄산수는 석회 성분의 축적을 막기 위해서다.
역사
이산화탄소는 독립된 물질로 인정된 첫 번째 기체이다. 1640년경 북벨기에의 반 헬몬트(J. B. van Helmont)는 닫힌 계에서 숯을 태웠을 때 얻어지는 재의 질량이 원래 숯보다 상당히 감소한다는 것을 발견하고, 이 줄어든 숯은 보이지 않는 물질인 '기체(gas)' 또는 '거친 영혼(wild spirit)'으로 변한 것이라고 해석하였다.
1750년 스코틀랜드의 블랙(J. Black)은 이 물질의 성질을 더 연구하여 석회암(탄산 칼슘)을 가열하거나 산으로 처리하여 얻은 기체를 '고정 공기(fixed air)'라 명명하고 공기보다 밀도가 크고 불꽃이나 동물 생명과 관련이 없음을 밝혀내었다. 그는 석회수(수산화 칼슘의 포화 수용액)에 고정 공기를 불어 넣으면 탄산 칼슘이 침전된다는 것도 알아내었고, 이 현상을 이용하여 동물 호흡이나 미생물의 발효 시 이 기체가 생성된다는 것을 설명하였다.
1772년 영국의 프리스틀리(J. Priestley)는 '고정 공기를 물에 주입하기(Impregnating Water with Fixed Air)'라는 제목의 논문에서 분필에 황산(그 당시는 'oil of vitriol'로 알려졌음)을 떨어뜨려 발생하는 기체를 수조에 불어넣고 포집하였다.
1823년 데이비(H. Davy)와 패러데이(M. Faraday)가 처음으로 고압에서 이산화탄소를 액화시킬 수 있었다. 한편, 고체 이산화 탄소는 틸로리에(A.-J.-P. Thilorier)에 의해 발견되었는데, 그는 1835년 액체 이산화 탄소가 담긴 가압 용기를 열었을 때, 이 액체의 빠른 증발에 기인한 냉각으로 고체 이산화탄소를 얻었다.
성질
구조와 결합
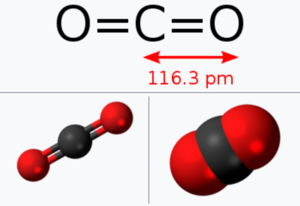
이산화탄소는 선형의 대칭 분자로 쌍극자 모멘트가 없고 적외선 분광 스펙트럼에서 비대칭(anti-symmetric) 방식에 의한 2349 cm⁻¹과 굽힘(bending) 방식에 의한 667 cm⁻¹의 두 진동 밴드(vibration band)가 관측되며, 라만 스펙트럼에서는 1388 cm⁻¹에서 대칭 신축(symmetric stretching) 방식의 밴드가 나타난다. 탄소와 산소 사이의 결합 길이는 116.3 pm로 비교적 짧은 편이다.
물리적 특성
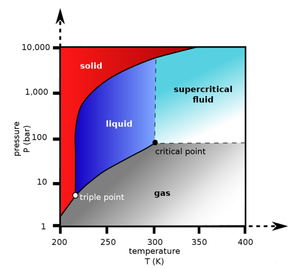
무색의 이산화 탄소는 낮은 농도에서는 냄새가 없으나 높은 농도에서 톡 쏘는 산성 냄새가 난다. 표준 온도와 압력 조건에서 공기보다 1.67배 무겁다. 1 기압과 -78.5 °C 이하에서 고체 상태로 존재하며, 이를 드라이아이스(dry ice)라고 한다. -78.5 °C 이상에서 직접 승화하므로 상압과 상온에서 액체 상태를 볼 수 없으며, 5.1 기압 이상에서만 이 상태로 존재할 수 있다. 아래의 상평형 그림에서 보듯이 삼중점은 약 5.1 bar와 217 K 그리고 임계점은 72.8 bar와 304 K이다. 임계점 이상의 온도와 압력에서 이산화 탄소는 초임계 유체(super-critical fluid)처럼 거동한다.
분압이 1atm일 때, 1부피의 물에 녹는 이산화 탄소의 상대적인 부피는 다음과 같다.
온도 0 °C 10 °C 20 °C 50 °C 부피 1.713 1.194 0.878 0.43
에탄올에는 물에 비해서 약 2배정도로 녹고, 카복실산 또는 그 무수물에는 물의 약 20배 정도 녹을 수 있다. 에테르, 벤젠 과는 잘 섞이지만 그 외의 많은 유기 화합물과는 잘 섞이지 않는다.
분자의 형태는 직선형이며, 탄소 원자와 산소 원자간의 결합 길이는 1.62Å이다. 고체는 분자성 결정의 형태로 존재한다.
화학적 특성
이산화 탄소는 화학적으로 활성이 낮은 기체이다. 이산화 탄소가 관여하는 대표적인 반응은 다음과 같다.
- 물에 녹아 약한 산성을 띠는 탄산을 생성한다. 1atm의 이산화 탄소에 수용액이 접해있을 경우의 pH는 3.7이다.
- 고압의 조건에서 포화 수용액을 냉각하면 수화물 CO₂·8 H₂O가 생성된다.
- 고온에서는 가역적으로 일산화 탄소와 산소로 분리된다.
- 수소와 가역적으로 반응하여 일산화 탄소와 물을 생성한다. 적당한 조건과 촉매를 갖추고 있을 경우 메테인, 폼산, 메탄올을 생성하는 경우도 있다.
- 알칼리 금속이나 알칼리 토금속과 반응하면 환원되어 탄소와 포름산염을 생성할 수 있다. 아연, 철과 같은 다른 금속과도 반응하여 일산화 탄소를 생성하는 경우가 많다.
- 황화 수소와 함께 가열된 금속관을 통과하면 일산화 탄소와 황을 생성한다. 사염화 탄소와 통과할 경우 포스젠을 생성한다.
- 많은 금속 산화물이나 수산화물과 반응하여 탄산염을 생성한다. 특히 수산화 칼슘과 반응하면 다음과 같은 반응이 진행된다.
- Ca(OH)₂ + CO₂ → CaCO₃ + H₂O
- CaCO₃ + H₂O + CO₂ ⇄ Ca(HCO₃)₂
탄산 칼슘은 물에 잘 녹지 않지만, 탄산 수소 칼슘은 물에 녹는다. 따라서 이산화 탄소의 분압이 높아지면 위의 두 반응 중 두 번째 반응의 평형이 생성물 쪽으로 이동한다. 그 결과 탄산 칼슘이 반응을 일으켜 탄산 수소 칼슘이 되어 물에 녹게 된다. 반대로 이산화 탄소의 분압이 낮아지면 평형은 반응물 쪽으로 이동하고 다시 탄산 칼슘이 석출된다. 이 반응은 석회동굴의 생성과 관련되어 있다. 이산화 탄소는 무극성 분자이다.
생물학적 역할
이산화탄소는 유기체가 에너지를 얻기 위해 대사 과정에서 탄수화물, 지방, 단백질 등을 산소로 분해할 때 세포 호흡의 최종 생성물이다. 하지만 식물은 호흡으로 내놓은 것보다 광합성을 통하여 더 많은 양의 이산화탄소를 흡수한다. 탄소 고정은 식물이 대기 중 이산화탄소를 받아들여 광합성으로 에너지를 낼 수 있는 포도당을 만드는 생화학적 과정이다. 이산화탄소와 물이 광합성으로 포도당을 생산하고 이로부터 여러 다른 유기 화합물이 만들어질 수 있으며 산소도 생성된다.
오랜 세월 동안 대기 중에서 이산화탄소는 자연적인 온실 가스로 작용하여 적외선을 흡수하고 방출하므로 지구 표면의 아랫부분은 따뜻하고 윗부분은 차갑다. 그런데 산업 혁명 이후 대기 중 이산화탄소의 농도가 높아지고 이와 함께 메테인, 아산화 질소, 오존 등의 온실 가스로 인한 지구 온난화가 진행되어, 20세기 중반 이후 기후 변화가 과도하게 발생하여 심각한 문제를 일으키고 있다.
제법
실험적으로 이산화 탄소는 석회암에 염산을 반응시켜 얻을 수 있다.
CaCO₃+2HCl → CaCl₂+H₂O+CO₂
공업적으로 이산화 탄소는 주로 다음과 같이 얻을 수 있다.
- 탄소를 포함하는 화합물을 연소시킬 때 얻을 수 있다.
- 대기 중에 존재하는 분량을 채취하여 얻을 수 있다.
- 알코올 발효 등 각종 발효 과정에서 발생하는 분량을 채취하여 얻을 수 있다.
- 석회암을 가열하여 생석회로 만드는 과정에서 부산물로 얻을 수 있다.
정제법
공업적으로 이산화탄소를 정제하는 데에는 주로 다음과 같은 반응을 이용한다.
Na₂CO₃ + H2O + CO₂ ⇄ 2 NaHCO₃
K₂CO₃ + H₂O + CO₂ ⇄ 2 KHCO₃
2HOC₂H₄NH₂ + H₂O + CO₂ ⇄ (HOC₂H₄NH₃)₂CO₃
위 반응들은 공통적으로 저온에서는 평형이 왼쪽으로 이동하고, 고온에서는 평형이 오른쪽으로 이동한다. 따라서 위 반응의 반응물이 포함된 수용액과 이산화탄소를 반응시켜 이산화탄소를 흡수한 후 이를 가열하면 다시 이산화탄소가 발생한다. 이 성질을 이용하여 이산화탄소를 정제할 수 있다.
리튬 이산화탄소 전지
리튬 이산화탄소 전지는 리튬(Li)을 음극재로, 이산화탄소(CO₂)를 양극재로 쓴다. 리튬 이온이 전해질을 통해 음극재와 양극재 사이를 오가면서 전지의 충전과 방전이 일어난다. 특히 전지에 전류가 흐르면서 전기를 사용하는 방전 때, 이산화탄소를 사용하는 반응이 일어나기 때문에 공기 중에 있는 이산화탄소를 포집할 수 있다. 전해질로는 용융염(molten salt)을 쓰고, 추가로 루테늄(Ru) 촉매를 도입해 공장 굴뚝과 같이 뜨겁고 이산화탄소 농도가 높은 환경에서 효과적으로 작동한다.[1]
멤브레인 프리 수계 금속-이산화탄소 배터리
멤브레인 프리 수계 금속-이산화탄소 배터리(Membrane-free Mg-CO2Battery)는 분리막을 없애고 음극(마그네슘 금속), 수계전해질, 양극(촉매)만을 필요로 한다. 수소발생 효율이 92%로 높을 뿐만 아니라 충전 반응에서 생성되는 산소와 염소도 유용하게 쓸 수 있다. 이 기술은 이산화탄소를 제거하는 동시에 유용한 자원을 생산하는 이산화탄소 활용 및 저장기술(CCUS)로 주목받고 있다. 멤프레인 프리 수계 금속-이산화탄소 배터리는 연료전지와 달리 촉매가 물속(수계 전해질)에 잠긴 상태로 음극과 도선으로 연결돼 있다.물에 이산화탄소를 불어넣으면 전체 반응이 시작돼 이산화탄소는 사라지고 전기와 수소가 만들어진다.[2]
각주
- ↑ 최준호 기자, 〈이산화탄소로 전기 생산···친환경 배터리 만든 한국 연구진들〉, 《중앙일보》, 2020-01-20
- ↑ 성재경 기자, 〈물에 녹인 이산화탄소로 그린수소·전기 생산〉, 《월간수소경제》, 2021-01-20
참고자료
- 〈이산화 탄소〉, 《위키백과》
- 〈이산화탄소〉, 《화학백과》
- 최준호 기자, 〈이산화탄소로 전기 생산···친환경 배터리 만든 한국 연구진들〉, 《중앙일보》, 2020-01-20
- 성재경 기자, 〈물에 녹인 이산화탄소로 그린수소·전기 생산〉, 《월간수소경제》, 2021-01-20
같이 보기
| ||||||||||||||||||

 위키원
위키원