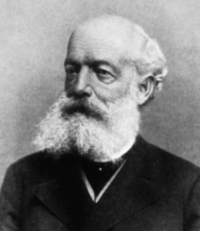"화학"의 두 판 사이의 차이
잔글 (→같이 보기) |
잔글 (→같이 보기) |
||
| (같은 사용자의 중간 판 하나는 보이지 않습니다) | |||
| 122번째 줄: | 122번째 줄: | ||
* [[물리학]] | * [[물리학]] | ||
* [[화학반응]] | * [[화학반응]] | ||
| + | * [[화학결합]] | ||
| + | * [[원소]] | ||
| + | * [[화합물]] | ||
| − | {{ | + | {{화학|검토 필요}} |
| − | {{ | + | {{화합물}} |
| + | {{에너지}} | ||
2024년 10월 28일 (월) 01:48 기준 최신판
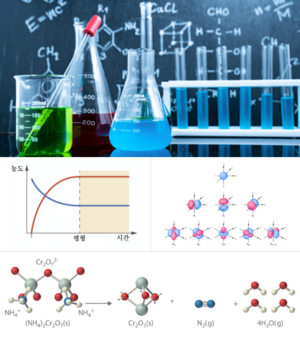
화학(化學, chemistry)은 물질의 성질, 조성, 구조, 변화 및 그에 수반하는 에너지의 변화를 연구하는 자연과학의 한 분야이다. 물리학도 역시 물질을 다루는 학문이지만, 물리학이 원소와 화합물을 모두 포함한 물체의 운동과 에너지, 열적·전기적·광학적·기계적 속성을 다루고 이러한 현상으로부터 통일된 이론을 구축하려는 것과는 달리 화학에서는 물질 자체를 연구 대상으로 한다. 화학은 이미 존재하는 물질을 이용하여 특정한 목적에 맞는 새로운 물질을 합성하는 길을 제공하며, 이는 농작물의 증산, 질병의 치료 및 예방, 에너지 효율 증대, 환경오염 감소 등 여러 가지 이점을 제공한다.
목차
개요[편집]
화학은 물질의 조성과 성질을 연구하는 과학(科學, science)이라고 정의할 수 있다. 오래전부터 우리가 접하고 있는 다양한 물질의 성질을 이해하고 이를 이용하기 위해서 화학자들은 많은 실험과 이론을 제시하였다. 그들은 물질의 특성을 나타내는 가장 작은 단위인 원자와 전자 수준에서 어떤 상호작용이 일어나고 결합되며 어떤 특정한 형태와 성질을 나타내는지 그 원리와 실체를 알아내기 위해서 다양한 실험 장치와 분석 장비를 동원하여 실험을 수행하였다. 19세기 초 원자와 분자 구조에서부터 다양한 화합물들의 결합 특성에 대한 많은 연구 결과물들이 나오면서 화학과 관련된 학문 분야가 급속도로 발전하게 되었다.
지난 2세기 동안 화학은 많은 발전을 하였으며 의약 및 여러 산업 분야에서 매우 중요한 역할을 하고 있다. 화학자들은 비료와 살충제를 만들어 냄으로써 농업생산량을 증가시켰고 신약을 개발하여 인간 수명을 연장시켰다. 인간생활에 편리함을 많이 가져다 준 제품들은 원유와 천연가스로부터 유도된 석유화학물질을 원료로 하여 만들어지는 것들로, 플라스틱·페인트·고무·합성 섬유 등이 있고 그 외에도 다양한 화학물질들을 이용하여 생활에 필요한 염료·세제·화장품 등 많은 종류의 공산품으로 생산되고 있다.
화학에서 다루는 부분은 주로 화학양론적인 개념과 반응 과정, 열역학(熱力學, thermodynamics), 핵화학(核化學, nuclear chemistry), 전기화학(電氣化學, electrochemistry), 반응 속도론(反應速度論, chemical kinetics) 등의 물리화학(物理化學, physical chemistry)의 이론을 기반으로 물질의 가장 작은 단위인 원자와 전자에 대한 이해에서부터 서로 다른 물질과 어떻게 상호작용하며 이러한 특성이 어떻게 나타나고 변하는지를 과학적으로 밝혀내는 학문이다.
어원[편집]
영어에서 화학을 뜻하는 'chemistry'는 연금술을 뜻하는 'alchemy'에서 유래된 것으로 알려져 있다. 'alchemy'는 이집트어로 이집트를 뜻하던 'Chemi' 또는 'Kemi'에서 유래된 것으로 보인다. '함께 주조하다'(cast together)를 뜻하던 아랍어 al-kīmīā 에서 유래된 것이라는 주장도 있다. 흔히 납과 같은 평범한 금속을 금과 같은 귀금속으로 변환시키려 했다고 알려진 서양의 연금술은 불로장생의 약품을 만들려던 동양의 연단술과 마찬가지로 현대의 화학뿐만 아니라 고대의 야금술, 철학, 점성술, 천문학, 의술, 신비술 등을 모두 포함했던 것으로 보인다.
19세기 일본의 대표적인 난학자(蘭學者)였던 우다가와 요안(宇田川榕菴, 1798~1846)이 처음으로 네덜란드어 'Chemie'(헤이미)의 발음을 따라 화학을 '세이미'(舎密; せいみ)라고 부르기 시작하고, 1840년에 서양 화학을 집중적으로 소개한 내편 18권과 외편 3권으로 구성된 《세이미 가이소》(舎密開宗)를 발간했다. 우다가와는 '산소'(酸素), '수소'(水素), '질소'(窒素), '탄소'(炭素), '백금'(白金), '산화'(酸化), '환원'(還元), '포화'(飽和), '용해'(溶解). '분석'(分析), '원소'(元素) 등의 화학 용어도 만들었다.
'화학'(化學)이라는 용어는 1856년 영국 선교사 A. 윌리암슨(A. Williamson, 1829-1890)가 《격물탐원》(格物探源)이라는 책에서 처음 사용했다. 1857년 상하이의 묵해서관(墨海書館)에서 발간했던 중국어 신문 《육합총담》(六合叢談)에서 영국 선교사 알렉산더 와일리(Alexander Wiley)가 소개한 중국인 번역가 왕도(王韜)의 일기에도 '화학'이라는 용어가 등장한다. 1871년에는 청(清)의 화학자 서수(徐寿)가 《Well‘s Principles of Chemistry》를 번역한 《화학감원》(化学鑑原)도 있다. 영국의 '화학'은 일본으로 전해져서 '세이미'를 대체하여 오늘날까지 사용되고 있다. 에도의 난학자 가와모토 고민(川本幸民)이 1861년 《화학신서》(化學新書)를 발간했다.
역사[편집]
B.C. 600년대 그리스 사람들은 우주가 하나의 원소로 구성되어 있다고 생각하였다. B.C. 350년 경 아리스토텔레스(Aristotle, B.C. 384~322)는 우주를 구성하는 네 가지 기본 요소를 공기·흙·불·물이라고 하였다. 그의 영향력이 매우 커서 다른 의견들을 제압하고 거의 2000년 동안 이 이론이 유지되어 왔다. A.D. 8세기에 아랍인들은 납을 금으로 만드는 연금술(alchemy)이라는 유사과학(pseudo science)을 창안하여 연금술사들이 간단한 실험을 하기 시작하였으나 실패하였다. 그러나 그 실행 방식은 계획적이고 체계적인 과학적 실험으로 연결되어 현대 화학의 초석이 되었다.
1661년 영국의 화학자 로버트 보일(Robert Boyle, 1627~1691)은 『회의적 화학자(The Sceptical Chemist)』라는 책을 출판하였고, 여기에서 그는 실험적 증거의 뒷받침이 없는 과학적 고찰은 가치가 없다고 언급하였다. 이 원칙은 화학적 연구의 전환점이 되어 과학적 방법의 발전과 현대 과학의 출발점이 되었다.
1803년 존 돌턴(John Dolton, 1766~1844)은 모든 물질은 원자라고 부르는 매우 작고 더 이상 나눌 수 없는 입자들로 구성되었다고 제안하였지만 그것이 원자론이 되기까지 추가적 증거들을 수집하는데 거의 100년이라는 기간이 걸렸다.
18세기 후반에 프랑스 화학자 앙투안 로우렌 라부아지에(Antonie Laurent Lavoisier, 1743~1794)는 화학을 조직화하고 연구소를 설립하여 많은 실험과 연구결과를 발표하고 연구성과 집필을 통하여 현대 화학의 창시자로서 많은 공헌을 하였다.
라부아지에가 프랑스 혁명 당시 단두대의 이슬로 사라진 이후 원소에 대한 그의 개념은 19세기 초에 등장하는 화학원자론의 기반이 되었다. 화학원자론은 1807년 토마스 톰슨(Thomas Thomson, 1773~1852)의 『화학의 체계(System of Chemistry)』 제3판에 최초로 등장하였다. 1813년에 옌스 야코프 베르셀리우스(Jöns Jacob Berzelius, 1770~1848)는 오늘날 사용되고 있는 표기법의 기본이 되는 화학기호의 체계를 제안하였다.
전지가 발견된 이래로 19세기 전반 동안 전기화학적 이중설과 화학원자설 모두에 커다란 영향을 준 것은 유기화학(有機化學, organic chemistry)에서의 발견들이었다. 유기화합물의 수가 크게 증가함에 따라 새로운 화합물의 조성을 알아내기 위해 사용되는 원소의 정량분석기술도 발달하게 되었다. 탄소와 수소를 분석하는 방법은 이미 라부아지에에 의해서 개발되었는데 이후 많은 화학자들에 의해 개선된 유기화합물의 화학식이 발표되었다.
1844년 이후 알려진 원소의 수는 58가지 정도였는데 그때까지 알려지지 않은 것들은 그 양이 너무 작아서 당시의 분석기술로는 밝힐 수 없는 광물들 안에 들어있었다. 1860년에 로베르트 빌헤름 에버하드 분젠(Robert Wilhelm Eberhard Bunsen, 1811~1899)과 구스타프 로베르트 키르히호프(Gustav Robert Kirchoff, 1824~1887)가 분광법을 도입하여 더 많은 원소들의 검출이 가능해졌다. 원소들 사이의 주기율에 대한 법칙을 최초로 제안한 사람은 드미트리 이바노비치 멘델레예프(Dmitri Ivanovich Mendeleev, 1834~1907)이다. 그의 저서인 『화학의 원리』에서 원소들의 성질을 체계화하려는 시도에서 원소의 화학적 성질이 어떤 식으로 원자량에 따라 변화하는지를 조사하였다.
1913년 헨리 모즐리(Henry Gwyn Jeffreys Moseley, 1887~1915)는 원자의 주기적 성질을 분류하기 위해 고에너지 복사선으로 원자핵들에 충격을 주었고 이때 방출된 X-선의 연구결과로부터 원소를 원자 번호 순서로 배열하였고 이 주기율표는 오늘날까지 사용되고 있다.
유기화학의 지식이 증가함에 따라 화학자들은 분자의 성질이 분자가 포함하고 있는 원자들과 그것들이 배열된 방법에서 유도된다는 것을 알게 되었다. 1858년 아키발드 스콧 쿠퍼(Archibald Scott Couper, 1831~1892)와 프리드리히 아우구스 케쿨레(Friedrich August Kekulé, 1829~1869)는 4가 탄소 원자 이론과 탄소원자들이 스스로 결합하여 사슬을 만들 수 있다는 생각을 내놓았다. 케쿨레는 불포화 지방족 탄화수소들의 구조와 결합에 대해서 고민하던 중에 벤젠의 고리 구조 개념에 대한 첫 논문을 1865년에 발표하게 되었다. 1866년 그는 단일결합과 이중결합이 교대로 나타난 육각형 모양의 고리 구조를 가지는 모형 그림을 발표하였다.
19세기 말, 원자 속에 전자라고 부르는 입자를 포함하고 있다는 것을 발견하였다. 1897년 요셉 존 톰슨(Joseph John Thomson, 1856~1940)은 이러한 입자설을 실험으로 증명하였다. 그는 일정한 전기장에 의해서 음극선이 휘어지는 정도를 측정하고 그것과 동량으로 휘어지게 하는데 필요한 자기장의 세기를 찾아냈다. 톰슨이 계산한 질량대 전하비(m/e)는 수소이온에 대한 값의 약 1/1000이었다.
1898년 마리 큐리(Marie Curie, 1867~1934)는 우라늄 및 토륨 등에서 이온화 복사선을 방출한다는 것을 발견하였고 우라늄 광석으로부터 방사능을 방출하는 원소들을 발견하였는데 그녀의 조국 이름을 따서 폴로늄이라고 하였다. 이후 1톤의 우라늄을 추출하고 남은 찌꺼기로부터 4년 간의 힘든 연구 끝에 0.1g의 순수한 염화라듐을 분리하는데 성공하였다. 그녀는 1903년 노벨물리학상을 받았지만 장기간 방사선을 쬔 결과로 백혈병을 얻어 숨을 거두었다. 그녀의 이러한 연구결과들로 원자력 시대가 열리게 되었다.
1924년에 루이스 드 브로이(Louis De Broglie, 1892~1987)는 전자기 복사선을 설명하기 위해 파동이론과 입자이론을 결합한 이중성을 제안하였다. 드브로이의 이론이 등장한 이후 양자역학(量子力學, quantum chemistry)이라고 부르는 새로운 수학적 계산방법을 이용하여 원자에서 전자의 행동을 나타낼 수 있게 되었다. 아이린 슈뢰딩거 (Erwin Schrödinger, 1887~1961)는 파동역학(波動力學, wave mechanics)을 이용하여 원자내의 특정 위치에서 전자밀도로 나타내었고 워너 하이젠베르크(Werner Heisenberg, 1901~1976)는 행렬역학(行列力學, matrix mechanics)이라는 새로운 접근 방식으로 전자의 위치와 속도를 동시에 정확하게 결정하는 것은 불가능하다는 불확정성 원리(uncertainty principle)를 발표하였다.
전자를 이용하여 화학결합을 설명하는데 있어서 가장 유명한 인물은 원자가 결합 이론을 개발하고 응용한 라이너스 폴링(Linus Pauling, 1901~1994)이다. 그는 1930년대 초반 양자역학으로부터 원자궤도함수의 혼성화 개념을 도입하였고 케쿨레가 제안하였던 벤젠 분자를 공명현상으로 설명하였다.
20세기 후반에 화학은 인류에 편리함을 주었지만 화학제품의 생산과정에서 생기는 환경오염물질들과 폭발사고로 수많은 직·간접적인 인명피해가 속출하였으며 세대를 넘어서 그 여파가 이어져 오고 있다. 이에 미래의 재앙을 최소화하는데 필요한 대안을 마련하는 것 또한 화학 분야의 발전방향이며 다른 과학 및 기술 분야와도 공유해야 할 문제이다.
주요 개념[편집]
원자와 원소[편집]
과거 화학에서 더 이상 나뉘지 않는 기초적인 요소가 존재한다고 했는데, 이 기초적인 요소를 원자(atom)라 한다. 원자란 물질을 구성하는 기본적인 입자로 고대 그리스의 데모크리토스에서부터 그 존재가 주장되었는데, 1803년 존 돌턴에 의해서 원자론으로 정리되었다. 20세기 초, 화학자들은 원자를 구성하는 더 작은 입자들, 즉 전자, 양성자, 중성자가 존재한다는 사실을 발견하였다. 전자는 음전하를 띠고 있고, 양성자는 양전하를 띠고 있으며, 중성자는 전하를 띠지 않고 있다. 원자는 양성자와 중성자로 구성되어 있는 원자핵을 가지고 있으며 전자는 이 주변에 오비탈을 이루며 분포되어 있다.
원소(element)는 일반적인 화학적, 물리학적 방법으로는 분해되지 않는 물질을 의미한다. 원소는 원자핵에 존재하는 양성자 수로 정의되는 원자 번호로 구별된다. 산소, 황, 주석, 철 등은 원소이다. 19세기 중엽까지 약 80가지의 원소가 발견되었는데, 이들은 주기율에 따라 배열될 수 있다.
동위원소[편집]
동위원소는 아이소토프 또는 동위체라고도 한다. 서로 화학적으로는 거의 구별하지 못하지만 그것을 구성하고 있는 원자의 질량이 서로 다른 원소를 동위원소라고 한다. 영어의 isotope는 그리스어인 isos(같은)와 topos(장소)의 합성어인데, 질량은 서로 달라도 원소의 주기율표에서 같은 장소에 배열되는 데서 1901년 영국의 화학자 F. 소디가 isotope라는 명칭을 붙였다. 대부분의 원소는 동위원소를 가진다. 동위원소는 원자 번호는 같으나, 중성자수가 다른 원소를 뜻한다. 동위원소는 화학적인 성질은 동일하나, 원자량의 차이를 이용하여 분리할 수 있다. 자연에서도 발견되는 92개의 원소 중 88개는 동위원소가 지표면 상에 존재한다. 자연에서 발견되지 않더라도 동위원소는 핵반응을 이용하여 만들어낼 수 있다. 어떤 동위원소는 방사능을 가지기도 하는데, 이 경우 동위원소의 원자핵은 불안정하고 방사선을 방출하며 자연적으로 붕괴된다.
동중원소[편집]
동중 원소(isobar)는 원자 질량은 같으나, 양성자수가 다른 원소를 뜻한다. 동중 원소는 화학적, 물리적 성질이 다르며 ⁴⁰S, ⁴⁰Cl, ⁴⁰Ar, ⁴⁰K, ⁴⁰Ca등이 있다.
분자와 화학반응[편집]
분자란 원자의 결합체 중 독립 입자로서 작용하는 단위체이다. 일정한 개수의 원자가 특정하게 정렬되어 서로 결합해 분자가 형성된다. 원자가 원소의 최소 단위이듯, 분자는 화합물의 최소 단위가 된다. 원자가 결합될 때 전자의 재배치가 일어나는데, 이는 화학에서의 중요한 관심사중 하나이다.
화학반응은 원자 혹은 분자가 화학적인 변화를 겪는 일을 말한다. 화학반응은 원자간의 결합이 끊어지는 일과 다시 이어지는 일을 포함한다. 결합이 끊어질 때는 에너지가 흡수되고, 결합이 이어질 때는 에너지가 방출된다. 화학반응의 간단한 예로는 수소와 산소가 반응하여 물이 되는 것을 들 수 있다. 반응식은 다음과 같다.
2 H₂ + 2 O → 2 H₂O
ΔH = - 572kJ
반응식에서 알 수 있듯이, 화학 반응에서는 원자가 새로 생성되거나 나타나는 일이 일어나지 않는다. ΔH는 에너지 또는 엔탈피 변화를 뜻한다. 반응은 발열반응일 수도 있고, 흡열반응일 수도 있다. 발열반응은 주위로 열을 방출하는 반응으로 엔탈피 변화가 음수로 나타난다. 반면에 흡열반응은 주위 열을 흡수하는 반응으로 엔탈피 변화가 양수로 나타난다. 위 반응의 경우는 발열반응인데, 이는 계로부터 주위로 열이 이동하였다는 의미이다.
화학결합[편집]
화학결합을 주된 세 가지 부류로 나누어보면 이온 결합, 공유 결합 그리고 금속결합으로 나눌 수 있다. 이온이란 전하를 띤 원자 또는 분자를 뜻한다. 이온 결합은 양전하와 음전하의 전기적인 인력에 의해서 생성되는 화학 결합이다. 예를 들면 염화 나트륨은 양전하를 띤 나트륨 이온(Na⁺)과 음전하를 띤 염화 이온(Cl⁻) 사이의 전기적인 결합으로 이루어진 이온 화합물이다. 이러한 물질을 물에 녹이면 이온은 물 분자에 의해 수화되고 이렇게 해서 만들어진 수용액은 전기전도도를 가진다.
공유 결합은 [[|원자 궤도|오비탈]]이 겹쳐진 결과 두 원자가 전자쌍을 공유하게 되어 생성되는 결합을 의미한다. 공유 결합이 형성되는 결합은 발열반응인데, 이때 방출되는 에너지의 양이 그 결합의 결합 에너지이다. 결합 에너지만큼의 에너지를 그 결합에 가해주면 결합은 끊어질 수 있다.
금속 결합은 금속 원자에서 전자들이 떨어져 나와 자유전자를 생성하게 되어 생성되는 결합을 의미한다. 금속의 특성인 연성과 전성이 생성되는 이유이기도 하다.
화합물[편집]
화합물은 구성하고 있는 원자의 종류, 수, 배치에 의해서 그 특성이 결정된다. 자연에서 찾을 수 있거나 인공적으로 합성할 수 있는 화합물의 수는 엄청나고, 이들 중 대부분은 유기 화합물이다. 유기 화합물을 이루는 주된 화학 원소인 탄소는 다른 화학 원소와는 다르게 매우 긴 사슬 형태로 정렬될 수 있으며, 같은 수많은 이성질체를 형성할 수 있다. 예를 들어, 분자식 C₈H₁₆O는 약 천 개의 서로 다른 화합물을 뜻할 수 있다.
질량보존 법칙[편집]
화학 반응의 과정에서 반응물질은 모두 생성물질로 변화되고, 물질이 사라지거나 생겨나지 않는다는 법칙으로 1774년 프랑스의 화학자 앙투안 라부아지에(1743-1794)가 제시했다. 핵분열이나 핵융합 반응이 일어나는 경우에는 성립하지 않는다.
일정 성분비 법칙[편집]
한 화합물을 구성하는 성분 원소들의 질량비는 항상 일정하다는 법칙으로 1799년 프랑스의 화학자 요세프 프루스트(1754-1826)가 제시했다.
배수 비례 법칙[편집]
2종류의 원소 A와 B가 2종류 이상의 화합물을 만들 때 일정량의 A와 결합하는 B의 질량 사이에는 간단한 정수비가 성립한다는 법칙으로 1803년 영국의 화학자 존 돌턴(1766-1844)이 처음 제시했다.
세부 분야[편집]
화학은 취급 대상 및 대상의 취급 방법에 따라서 몇 가지 분과로 구분될 수 있다. 물질을 분석하는 분석화학은 크게 물질의 존재를 취급하는 정성 분석과 물질의 양을 결정하는 정량 분석으로 나눌 수 있다. 탄소를 포함한 유기 화합물을 다루는 유기화학과 유기 화합물을 제외한 무기 화합물을 다루는 무기화학도 있다. 물리학과 화학의 경계에는 물리화학이 있고 생물학과의 경계에는 생화학이 있다. 물리화학에서 특히 분자의 구조와 성질과의 관계를 다루는 부분을 구조화학이라고 부르기도 한다. 제2차 세계 대전 이후에는 방사성 물질을 다루는 방사화학이 발전하였고 화학 공업을 다루는 공업화학도 있다. 이 외에도 화학의 분과는 매우 다양하다.
화학의 분과는 전통적으로 다음과 같은 5가지로 나눌 수 있으며, 각각의 분과는 더욱 세분화될 수 있다.
- 물리 화학: 물리화학은 화학적 현상에 대한 해석과 이를 설명하기 위한 물리적 원리들에 대해 다루는 분과이다. 화학반응에 관련된 열역학적 원리와 물질의 물리학적 성질에 대한 설명은 물리화학이 다루는 고전적인 주제이다. 물리화학은 양자화학의 발전에도 큰 기여를 하였다. 분광계나 자기 공명, 회절 기기 등 물리화학에서 사용하는 실험 장비나 실험 방법들은 다른 화학의 분과에서도 매우 많이 사용된다. 물리화학이 다루는 대상은 유기 화합물, 무기 화합물, 혼합물을 모두 포함한다.
- 유기 화학: 유기화학은 탄소로 이루어진 화합물을 연구하는 분과이다. 원래 유기 화합물은 식물이나 동물로부터 추출해낸 화합물을 뜻하였으나 지금은 유기 화합물의 범위가 크게 넓어져 탄소 사슬 또는 탄소 고리를 가진 모든 화합물을 뜻한다. 유기화학의 오랜 관심사는 유기 화합물의 합성 메커니즘이다. 현대에 들어서 핵자기 공명법과 X선 결정학 등이 개발되어 유기 화합물 분석에 있어서 매우 중요한 방법으로 자리잡았다. 플라스틱, 합성섬유등의 고분자물질 등도 유기화학에서 다루어진다.
- 무기 화학: 무기화학은 유기화학에서 다루지 않는 물질을 다루며 주로 금속이나 준금속이 포함된 물질에 대해서 연구한다. 따라서 무기화학에서는 매우 넓은 범위의 화합물을 다루게 된다. 초기에는 광물의 구성이나 새 원소의 발견이 주요 관심사였고 여기서부터 지구화학이 분기되었다. 주로 전이 금속 등을 이용한 촉매나 생물에서 산소 수송, 광합성, 질소 고정 등의 과정에서 중요한 역할을 하는 금속 원자들에 대해 연구하며 이 외에도 세라믹, 복합재료, 초전도체등에 대한 연구를 한다.
- 분석 화학: 분석화학은 물질의 조성이나 혼합물의 구성요소 등을 결정하는 방법에 대해서 연구하는 화학의 분과이다. 혼합물을 이루고 있는 성분의 탐색, 분리, 정량과 분자를 이루고 있는 원자의 비율을 측정하여 분자식을 결정하는 일 등이 분석화학에서 행해진다. 1950년대의 분석화학의 발전은 많은 질량 분석계를 포함한 분석 기구의 등장을 불러일으켰다. 이 외에도 고해상도 크로마토그래피, 전기화학에서의 많은 실험방법 등은 분석화학에 있어서 중요한 분석법이다. 분석화학에 있어서 최종 목표는 더 정확한 측정법이나 측정기기 등을 개발하는 것이다. 분석화학의 발전으로 인해 환경오염 물질 등을 피코그램의 수준에서도 감지하는 것이 가능해졌다.
- 고분자 화학: 분자량이 큰 천연 또는 합성 고분자를 합성하는 방법과 고분자의 물리적, 화학적 특성을 연구한다.
- 생화학: 생화학은 생물을 화학의 관점에서 다루는 학문이다. 식물이나 동물의 세포에서 발견되는 물질이나 일어나는 화학 반응들이 주 관심사이다. 생명체에서 발견되는 탄수화물, 지방, 단백질, 핵산, 호르몬 등은 유기 화합물이라서 유기화학에서도 다루어지기도 하나, 이들 화합물에 관련된 물질대사 과정이나 조절 과정에 대한 연구는 생화학의 고유 분야이다. 효소와 조효소, 그리고 이들의 작용 과정에 대해서도 연구하며, 세포막을 통과하는 이온과 분자, 신경전달물질과 다른 조절 물질들의 작용에 대해서도 연구한다. 생화학은 내분비학, 유전학, 면역학, 바이러스학의 발전에 큰 영향을 끼쳤다.
이밖에도 나노 화학, 고체 화학, 표면 화학, 광화학, 의약 화학, 물리유기 화학, 방사 화학, 재료 화학, 농화학, 대기 화학, 천체 화학, 환경 화학, 지질 화학, 해양 화학, 석유 화학 등의 다양한 세부 분야가 있다.
참고자료[편집]
같이 보기[편집]
| ||||||||||||||
| ||||||||||||||||||

 위키원
위키원