"배터리"의 두 판 사이의 차이
| (사용자 9명의 중간 판 64개는 보이지 않습니다) | |||
| 1번째 줄: | 1번째 줄: | ||
| − | [[파일:배터리. | + | [[파일:배터리 (건전지).png|썸네일|300픽셀|<center>'''[[배터리]]'''(battery)</center>]] |
| − | '''배터리'''( | + | '''배터리'''(battery)는 전기를 담아두는 부품을 말한다. 배터리는 넓은 범위에서는 '''[[전지]]''', 좁은 범위에서는 [[2차전지]]인 '''축전지'''를 뜻하는 말이다. 휴대용 전자기기의 발달로 인해 배터리는 일상에 밀접한 용어가 되었다. [[스마트폰]]에 이어, [[전기자동차]], [[드론]] 등의 확산에 따라 배터리 산업이 폭발적으로 성장하고 있다. [[사물인터넷]](IoT)에 빗대어 [[사물배터리]](BoT)라는 용어도 생겨났다. 전 세계 배터리 제조의 대부분은 한국, 중국, 일본의 3개국이 장악하고 있으며, 2020년 초 기준으로 한·중·일 3개국의 시장점유율 합계는 93.8%로 압도적이다. 국가별로는 1위 한국 34.5%, 2위 중국 32.9%, 3위 일본 26.4%이다.<ref>안소영 기자, 〈[https://biz.chosun.com/site/data/html_dir/2020/08/17/2020081701426.html 韓 배터리, 中·日 꺾고 글로벌 '1위' 차지…"향후 2년이 고비"]〉, 《조선비즈》, 2020-08-17</ref> 세계 1위의 전기자동차용 배터리 생산 업체는 2019년 중국 [[CATL]]이었으나, 2020년 한국 [[엘지화학]]이 1위로 올라섰다. |
| + | {{:자동차 배너|배터리}} | ||
| − | == 개요 == | + | ==개요== |
| − | + | 배터리는 전기 장치에 전원을 공급하기 위해 물리적 또는 화학적 작용을 통해 전기 에너지를 발생, 공급시키는 장치이다. 가장 흔하게 볼 수 있는 [[화학전지]]는 두 가지 금속의 이온화도 차이에서 오는 전위차를 이용한다. 이온의 양이 많을수록 흘려보낼 수 있는 [[전하]]의 양도 많기 때문에 같은 종류인 전지의 [[용량]]은 크기에 거의 비례한다. 배터리는 [[충전]] 가능 여부에 따라 충전이 불가능한 [[1차전지]]와 충전이 가능한 [[2차전지]]로 나뉜다. 1차전지는 전지 내의 전기화학 반응이 비가역적이기 때문에 한 번 쓰고 버려야 하는 일회용 전지를 말한다. 1차전지는 전지 내에 [[전류]]를 흘려줌으로써 [[방전]] 시에 일어난 화학 반응을 역으로 되돌리는 것이 불가능하다. 화학반응자들(리튬 전지에서의 [[리튬]]과 같은 원소들)은 전지에 역방향의 전류를 걸어 준다고 해서 본래의 위치로 되돌아가지 않으며, 따라서 전지의 용량이 회복되지도 않는다. 1차전지는 [[양극]]과 [[음극]] 중 어느 한쪽, 또는 양쪽 모두를 소진함으로써 수명을 다한다. | |
| − | + | [[2차전지]](축전지)는 외부의 전기 에너지를 화학 에너지의 형태로 바꾸어 저장해 두었다가 필요할 때에 전기를 만들어내고 재사용할 수 있는 장치를 말한다. 주로 쓰이는 2차전지는 납 축전지, 니켈-카드뮴(NiCd), 리튬 이온 전지(Li-ion), 리튬 이온 폴리머 전지(Li-ion polymer) 등이 있다. 2차전지는 1차전지가 있어야 충전이 가능하기 때문에 2차라는 이름이 붙었다. 2차전지는 1차전지에 비해 가격이 비싸지만 한 번 쓰고 버리는 1차전지에 비해 2차는 재사용할 수 있어 경제적이고 환경친화적이다. 1차전지는 장기간 에너지를 보존해야 하는 경우에 적합하다. 2차전지를 사용하면 자연 방전에 의한 손실이 장치 자체를 유지하는데 필요한 손실보다 커짐에 따라 비경제적이고 수일에서 수주 내에 교환해야 한다. [[비축전지]]는 전지를 구성하는 [[양극]], [[음극]], [[전해질]]과 같은 구성 원소들을 분리해서 보관하고 있다가 전지를 써야 할 때 즉시 결합하여 사용하는 방식으로, 수십 년 이상의 긴 시간 동안 에너지를 보존하기 위해 제작된다. 이러한 전지는 비싸지만, 군수품 등에 이용될 수 있는데, 군수품은 장시간 보관하다가 급히 사용하는 경우가 많기 때문이다.<ref name="전지 나무위키">〈[https://namu.wiki/w/%EC%A0%84%EC%A7%80(%EC%9E%A5%EC%B9%98) 전지]〉, 《나무위키》</ref><ref name="일차 전지 위키백과">〈[https://ko.wikipedia.org/wiki/%EC%9D%BC%EC%B0%A8_%EC%A0%84%EC%A7%80 일차 전지]〉, 《위키백과》</ref><ref name="이차 전지 위키백과">〈[https://ko.wikipedia.org/wiki/%EC%9D%B4%EC%B0%A8_%EC%A0%84%EC%A7%80 이차 전지]〉, 《위키백과》</ref> | |
| − | == | + | == 어원 == |
| − | + | 과거에는 일본식 표현인 밧데리(バッテリー)라고 불렸다. 로케트 밧데리라는 회사의 영향으로 밧데리라는 말이 널리 쓰이다가 [[워크맨]] 시절에 [[건전지]], 충전지, 껌전지 등으로 순화되어 불리더니, 리튬 이온 배터리팩이 널리 쓰이면서 '배터리'란 용어로 바뀌어 쓰이게 되었다. 하지만 여전히 밧데리라는 표현도 종종 쓰인다. 배터리의 어원은 사실 '포병부대'에서 비롯되었다. 프랑스어가 어원이며 '때리다'는 뜻의 'battre'에서 포병부대라는 뜻의 'batterie'가 나왔다. battle(배틀)과 같은 어원을 가진다. 벤자민 플랭클린이 정전기를 담는 라이덴 병(Leyden jar)의 성능 향상을 위해 4개를 한 부대로 지정하며 배터리라 불렀는데. '같은 기능을 하는 조직의 모음'이란 뜻으로 썼으나 사람들은 전기공급장치라 읽게 된 것이 오늘날까지 이어지게 된 것이다.<ref name="배터리 나무위키">〈[https://namu.wiki/w/%EB%B0%B0%ED%84%B0%EB%A6%AC 배터리]〉, 《나무위키》</ref><ref name="전지 위키백과">〈[https://ko.wikipedia.org/wiki/%EC%A0%84%EC%A7%80 전지]〉, 《위키백과》</ref> | |
| − | |||
| − | == | + | == 등장배경 == |
| − | + | 1780년경 이탈리아 볼로냐 대학교의 생물학 교수였던 [[루이지 갈바니]](Luigi Aloisio Galvani, 1737~1798)는 개구리를 해부하다가 개구리의 뒷다리에 황동 철사를 대었더니 꿈틀거리는 것을 목격했다. 개구리 다리가 어떤 자극을 받으면 전기가 흘러 근육이 움직인다며, 그 에너지를 동물전기라고 이름 짓고 1791년 발표하였다. 갈바니가 주장한 동물전기를 본 이탈리아의 [[알레산드로 볼타]](Alessandro Volta)가 동물전기에 의문을 품고 있다가 1800년 실험을 통해 동물전기의 오류를 증명하였다. 이 과정에서 [[전기]]가 생기는 원리를 발견하고 1800년 [[구리]]와 [[아연]]을 이용해 세계 최초의 전기 저장 장치인 [[볼타전지]]가 탄생하게 되었다. | |
| − | === | + | 한편 1932년 독일의 케네디(Kennedy)가 이라크 바그다드 지역에 있는 후유트라브 유적에서 기원전 3세기(약 2000년 전)부터 사용된 것으로 보이는 [[바그다드 전지]]를 발굴했다. 바그다드 전지는 중앙부에 쇠막대를 박아놓은 구리 통을 도자기로 된 항아리가 감싸는 구조를 하고 있다. 구리 통에 쇠막대가 충분히 잠기게끔 전해질을 넣고 둘을 전선으로 연결하면 전기가 흐르게 할 수 있었다. 전해질로는 술이나 식초 등을 넣은 것으로 추정된다. 볼타전지와 같은 원리로 작동하는 바그다드 전지는 금이나 은을 도금하는 용도로 사용되었을 것으로 추정하고 있다.<ref name="삼성SDI">삼성SDI, 〈[http://blog.naver.com/PostView.nhn?blogId=sdibattery&logNo=220919777665&parentCategoryNo=&categoryNo=&viewDate=&isShowPopularPosts=false&from=postView (배터리 여행) 배터리의 역사: 동물전기와 볼타전지]〉, 《네이버 블로그》, 2017-01-25</ref><ref name="몽당버터"> 몽당버터, 〈[https://blog.naver.com/canjelluv1117/221498116728 기원전 3세기부터 있었다는 '바그다드 전지'에 대한 잡썰]〉, 《네이버 블로그》, 2019-03-26</ref> |
| − | 투수와 포수를 묶어서 말할 때 쓰이는 단어이다. | + | |
| + | ==원리== | ||
| + | [[파일:배터리의 구조와 작동원리.png|썸네일|500픽셀|<center>'''배터리의 구조와 작동원리'''</center>]] | ||
| + | 2차 전지를 설명하기 전 기본적으로 1차 전지의 원리를 이해하는 것이 좋다. 최초의 1차 전지인 [[볼타 전지]](voltaic cell)를 통하여 알아보자면 볼타 전지는 두 서로 다른 금속인 [[아연]](Zn)과 [[구리]](Cu)을 사용하게 되는데 묽은 황산에 아연판과 구리판을 넣어두고 아연판의 경우 이원화가 잘 이루어져 [[묽은 황산]](H2SO4)과 같은 전해액에 아연판을 두게 되면 아연은 황산에 녹아 [[양이온]]이 되고, 아연판에 [[전자]]만 남게 된다. 이 같은 현상을 산화라고 하며 아연판에 남게 된 전자는 전선을 타고 넘어가 [[음전하]]를 띄게 된다. 이때 전자가 이동함에 따라 전기가 발생되는 것이다. 구리판으로 넘어가는 전자들은 황산 용액에 남아 있는 [[수소이온]](H+)과 반응하여 수소 기체(H2)가 만들어지면서 아연에서 온 전자는 모든 반응을 마치게 된다.<ref> 한화토탈, 〈[https://www.chemi-in.com/540 전자기기 시대를 연 배터리의 조상, 볼타전지]〉, 《티스토리》, 2021-04-06</ref> 본래 이론적으로는 한쪽 판이 다 녹는다면 화학반응이 일어나지 않아 전기를 생성하지 못하는데, 볼타전지는 분극현상 때문에 아연이 다 녹지 않아도 전기를 생성하지 못하는 경우가 있다. | ||
| + | |||
| + | 2차 전지는 [[충전]]과 [[방전]]으로 나뉜다. 방전원리는 1차 전지와 유사한 방법으로 화학반응을 통해 전기 에너지를 얻는다. 2차 전지 중 가장 많이 쓰이는 [[리튬이온배터리]]로 원리를 설명하면 음극에는 [[이온화]]가 쉬운 [[리튬]](Li)이 있는데 마찬가지로 전해액에 녹아서 리튬금속이 이온화가 되어 리튬이온(Li+)과 전자(e-)로 분리된다. 리튬이온은 전해질을 타고 분리막을 지나 양극으로 이동하고 전자는 전선을 타고 양극으로 이동한다. 전자와 리튬이온이 양극에 있는 [[산화코발트]](CoO2)와 만나게 되면 화학결합을 일으켜 리튬코발트산화물(LiCoO2)이 만들어진다. 그렇게 음극의 리튬이 모두 양극으로 넘어와 리튬코발트 산화물이 되면 [[완전방전]] 상태에 이른다. 완전방전 상태에서 충전기라는 외부 에너지를 배터리에 주입하게 되면 양극재에서 화학반응을 일으켜 리튬코발트산화물은 다시 리튬이온, 전자, 산화코발트로 분리된다. 이후 다시 왔던 방식과 동일하게 리튬이온은 양극에서 음극으로 전해액을 통해 분리막을 지나 이동하고, 전자는 다시 전선을 따라 양극에서 음극으로 이동한다. 이때는 전자가 이동하여도 전류는 발생하지 않는데 방전 때와 같이 자발적인 움직임이 아닌 [[충전기]]가 외부 에너지를 통하여 억지로 음극으로 밀어주는 상황이기 때문이다.<ref> 꿈꾸자 인생, 〈[https://i-love-mystory.tistory.com/111 이차전지의 충전과 방전 원리. 이것으로 끝. (리튬이온이차전지 배터리 원리!)]〉, 《티스토리》, 2020-09-25</ref> 그렇게 리튬이온과 전자는 다시 음극에 저장됨으로써 리튬코발트산화물이 모두 분해되어 전자와 리튬 이온이 음극 도착하면 [[완충]] 상태라고 볼 수 있다. | ||
| + | |||
| + | ==구성요소== | ||
| + | ===음극재=== | ||
| + | [[음극재]]는 배터리 충전 속도와 수명을 결정하는 요소이기도 하는데 전자를 전지 충전 시 저장하였다가 방전 시 내어주는 역할을 한다. 음극재는 안정적인 구조와 저렴한 가격이 장점인 [[흑연]]을 주로 사용한다. 흑연은 층상구조로 충전 시 리튬이온이 이 층상구조 사이에 안정적인 구조로 쌓이면서 약간의 부피팽창이 이뤄진다. 리튬이온이 흑연층을 반복하여 지나다니면 음극의 부피가 계속해서 변하고 흑연 구조에 미세한 변화를 발생시키면서 수명이 감소하는데, 흑연은 비교적 체적 팽창이 작아서 사이클 수명이 길다. 이러한 흑연에도 천연흑연과 인조흑연이 나누어지는 데 천연흑연의 경우 용량이 350~360 mAh/g로 높은 편이지만 수명이 짧고, 인조흑연은 수명이 길지만 320~340 mAh/g로 용량이 작은 편이다. 그리하여 천연흑연은 저렴한 가격의 기기에서 주로 사용되고, 인조흑연은 오래 쓰이는 전기자동차나 스마트폰에 쓰이고 있다. 아무래도 배터리는 대용량이 목적이 됨에 따라서 흑연을 대체할 소재가 개발이 되고 있는데 그중 [[실리콘]](Si)이 주목을 받고 있다. 실리콘은 흑연보다 10배 이상의 에너지 용량을 가지고 있고 충방전 속도가 빠르다고는 하지만 흑연보다 체적팽창이 매우 높아서 수명이 짧고, 비용이 비싸서 상용화 단계까지는 일러 연구가 진행되고 있다.<ref> 럭킴, 〈[https://greatluckim.tistory.com/15 리튬이온 배터리 기초 3.음극재란?]〉, 《티스토리》, 2020-05-25</ref> | ||
| + | |||
| + | ===양극재=== | ||
| + | [[양극재]]는 2차 전지를 구성하는 가장 중요한 요소로 배터리에서 양극재가 차지하는 비용만 40%가 된다. 양극재는 배터리의 용량과 평균 전압을 결정하는 요소로 에너지 밀도를 끌어올리기 위해서는 양극재를 이루는 [[양극활물질]]이 중요하다. 통상적으로 양극활 물질에는 [[니켈]](Ni), [[코발트]](Co), [[알루미늄]](Al), [[망간]](Mn) 4개의 물질을 조합하여 [[NCA]], [[NCM]], [[LMO]], [[LCO]], [[LFP]]와 같은 배터리를 만들어 낸다.<ref> JMmm, 〈[https://m.blog.naver.com/whdals2636/222072683144 '양극재 종류 정리(NCM, NCA, LFP, LCO)']〉, 《네이버 블로그》, 2020-08-27</ref> LCO(리튬코발트산화물)의 경우 리튬배터리의 원조격으로 많이 사용되고 있는 양극재이다. 리튬, 코발트, 옥사인으로 구성되어 있는데 그중 코발트가 핵심원료로 니켈, 구리 광산 등에서 부산물로 얻을 수 있어서 세계적으로 채굴량이 적고, 전 세계 코발트 60% 이상이 아프리카 콩고 민주 공화국에서 생성되는데, 내전 등 정세 불안으로 코발트 공급이 불안해지면서 그 가격 또한 치솟고 있다. 코발트의 사용이 한정적으로 사용할 수밖에 없게 되자 양극재에 사용하는 코발트를 줄이는 쪽으로 개발이 진행되고 있다. 예를 들어 NCM(니켈코발트망간) 같은 경우에는 원래 비중이 1:1:1이었으나 니켈의 함량을 극대화하고 비싼 코발트 원료를 줄여 니켈의 비율이 60% 이상으로 구연된 하이니켈(high-nickel)이 개발되고 있고, 이를 통해서 니켈이 60%, 코발트와 망간이 각각 20%인 NCM622로부터 시작하여 NCM712, NCM811, NCM9½½가 있다. 코발트가 들어가 들어가지 않은 것도 있다 LFP는 LCO에 코발트 대신 [[인산철]]이 들어간 LFPO 구성으로 FPO로 불리는 양극재이다.<ref> 박민규 기자, 〈[http://www.econovill.com/news/articleView.html?idxno=413890 (ER궁금증) 이차 전지의 핵심, 양극재는 무엇?]〉, 《이코노믹리뷰》, 2020-10-03</ref> 중국에서 주력으로 개발하고 있으며 코발트와 니켈 등 고가 금속이 들어 있지 않아서 가격이 저렴하지만 부피가 커서 사용하기가 까다로운 편이다. | ||
| + | |||
| + | ===전해액=== | ||
| + | [[전해액]]은 리튬이온이 이동할 수 있는 통로의 역할로 [[염]](Salt), [[용매]](Solvent), [[첨가제]](Additive) 3가지의 핵심 구성요소로 이루어져 있다. 염의 경우 전해액이 통로 역할을 할 수 있는 이유이기도 한데, 용매에 쉽게 [[용해]]되거나 [[해리]]가 잘 돼야하며 해리가 된 이온들이 잘 이동이 될 수 있어야 한다. 보편적으로는 이온이동과 용해도 화학적 안전성이 다른 염에 비해 우수한 [[인산]], [[불소]]로 구성된 LiPF6이 대표적인 염이다. 용매는 염을 잘 용해시켜 리튬이 원활하게 이동할 수 있도록 도와주는 역할로 용해도가 높아야 되는 특성상 이온 화합물을 분리시키는 [[유전상수]]가 높아야 한다.<ref> 김동규 기자, 〈[http://www.econovill.com/news/articleView.html?idxno=359331 (ER 궁금증) 리튬이온 배터리의 ‘혈액’ 전해액]〉, 《이코노믹리뷰》, 2019-03-24</ref> 하지만 리튬의 원활한 이동을 위해서는 낮은 점도를 가지고 있어야 하는데 유전상수가 높을 수록 점도가 높아져서 이온이 원활하게 이동하지 못할 수도 있다. 때문에 용해도와 점도을 균형 있게 조합해야 최고의 이온전도도가 확보가 가능하다. 또한, 만일 전해액이 물로 이루어져 있고, 수분과 만나면 반응하는 리튬이 양극이나 음극에 존재할 경우 안전상 문제가 발생할 수 있기 때문에 화학적 반응이 적은 용매를 사용해야 한다. [[첨가제]]는 양극이나 음극의 표면에 보호막을 형성하는 역할로 소량으로 첨가되는 물질이다. 때문에 첨가제는 양극용과 음극용으로 나누어져 각각의 역할을 수행한다. 양극 보호 첨가제는 양극의 구조를 안정화시키거나 표면을 보호하여 열화를 억제하고 발열을 개선하거나 [[과충전]]을 방지하고, 음극용 첨가제는 용매보다 먼저 분해되어 음극에 튼튼한 막을 형성하고 발열을 줄이거나 배터리 용량을 유지하는 역할을 한다.<ref> 〈[https://www.samsungsdi.co.kr/column/technology/detail/56541.html?listType=gallery 리튬이온을 위한 베스트 드라이버 ‘전해액’]〉, 《삼성SDI》, 2020-11-04</ref> | ||
| + | |||
| + | ===분리막=== | ||
| + | [[분리막]]은 [[양극]]과 [[음극]]을 물리적으로 분리하는 요소로 [[폴리올레핀]](PO)계열의 [[폴리에틸렌]](PE), [[폴리프로필렌]](PP)과 같은 [[절연]]소재의 얇은 막으로 이루어져 있다. 양극과 음극은 셀안에서 직접 접촉을 하게 되면 도선을 통하여 전류가 흐르지 않거나 리튬 이온의 움직임이 증가하여 불이 날 수도 있기 때문에 분리막이 필요하다. 실제로 2016년 갤럭시 노트 7의 전지 폭발과 2020년 현대차 [[코나 EV]] 화재사고의 원인을 분리막 품질 문제라고 추정하고 있는 것을 보아 분리막은 화재와 폭발과 연관이 있음을 확인할 수 있다. 그렇다고 해서 분리막이 완벽히 음극과 양극을 나누고 있는 것이 아니다. 분리막 표면에 미세한 기공이 존재한다. 전지는 이온이 음극과 양극을 자유롭게 이동해야 하는데 분리막으로 인해 완전히 막히게 된다면 화학적 반응이 일어날 수가 없다. 때문에 이온이 이동할 통로를 제공하는 선에서 미세한 기공을 확보하는 것이다. 이 미세한 구멍은 건식과 습식 두 방식으로 나뉘어 만들어진다. [[건식분리막]]은 기계적인 힘으로 필름을 당겨서 기공을 만드는 방식이고, 습식은 기본 필름에 첨가제를 추가하여 화학적으로 기공을 만드는 방식이다. 각 방식은 장단점을 가지고 있는데 건식은 물리적으로 분리막을 늘려서 기공을 확보하는 것이기 때문에 기공의 사이즈의 균일성은 떨어지고 강도가 약하지만 간단한 방식이기 때문에 저렴한 비용으로 제조가 가능하다. [[습식분리막]]은 기공 사이즈가 일정하고 강도가 강해서 고용량, 고출력 등 고사양을 요구하는 셀에서 많이 사용된다.<ref> 김동규 기자, 〈[http://www.econovill.com/news/articleView.html?idxno=359875 (ER 궁금증) "너네 둘 못만난다"...배터리 분리막의 ‘숭고한 임무’]〉, 《이코노믹리뷰》, 2019-03-31</ref> 이렇게 만들어진 기공은 열에 의해서 변형이 일어나기도 하여 문제가 발생하는데, 고분자 분리막의 열악한 열적 특성을 개선하기 위해 코팅을 하여 다층구조를 이루는 형태를 하고 있다. 이로 인해 고온 안전성이 뛰어나긴 하지만 다층구조로 인하여 두께가 증가하고 에너지 밀도가 감소한다는 단점이 있어 이를 극복하고자 다양한 시도를 하고 있다. | ||
| + | |||
| + | ===케이스=== | ||
| + | 배터리 모양에도 원통, 직사각형의 얇고 넓은 형태, 두껍고 각진 형태로 여러 형태가 있다. 그 모양은 [[배터리 케이스]]에 따라서 결정이 되는데 단순 모양만 바뀌는 것이 아닌 모양에 따라 특성도 달라지게 된다. 원통형 케이스는 흔히 볼 수 있는 AA 건전지와 같은 형태로 오랜 역사를 지니고 있고 그에 따른 관련 기술이 다량 축적되어 안정성이 높은 편이다. 또한 고용량, 고에너지를 갖추고 있어서 주로 전력이 많이 필요한 제품에 탑재가 된다. 대신 원통형 배터리 같은 경우에는 여러 개를 사용할 경우에 빈 공간이 생겨 공간의 효율성이 떨어진다는 단점을 가지고 있다. 각형 케이스는 과거에 탈착식 스마트폰에서 많이 보던 배터리를 생각하면 되는 데 원통형에 비하여 한정적인 공간에서 더 많은 배터리를 사용할 수 있다는 점이 장점이다. 마찬가지로 단점이 있는데 파우치 형과 비교하면 에너지 밀도가 낮다. 제조 방식에서 양극재와 음극재, 분리막 등을 돌돌 말아서 제조하고 있기 때문에 각진 케이스에 그렇게 말아놓은 [[젤리롤]]을 넣게 되면 모서리에 빈틈이 생겨 내부공간을 완벽하게 채울 수 없기 때문이다. 이를 개선하기 위해 층층이 쌓는 방식인 스테킹 방식을 도입하고 있다.<ref> 럭킴, 〈[https://greatluckim.tistory.com/25 배터리 제조 프로세스 1. 배터리 타입(타우치형, 각형, 원통형)]〉, 《티스토리》, 2020-06-25</ref> 마지막으로 파우치 형은 앞서 말한 스테킹 방식과 같이 층층이 쌓는 방식으로 제조되어 배터리의 빈 곳이 거의 생기지 않는다. 때문에 다양한 크기와 형태로 배터리를 만들 수 있어서 업체의 다양한 요구사항에 대응이 가능하다. 단, 생산단가가 높고 다른 배터리에 비하여 내구성이 떨어진다. | ||
| + | |||
| + | == 종류 == | ||
| + | === 납축전지 === | ||
| + | [[납축전지]]는 [[납]]과 [[황산]]을 전극과 전해질로 사용하는 전지로서, 충전 방전을 통해 반복해 사용할 수 있는 [[2차전지]]이다. 납축전지는 1859년 프랑스의 플랑테(Planté)가 개발한 가장 오래된 형태의 2차전지로 현재 자동차에 널리 활용되고 있다. 이산화납 전극과 납 전극이 황산 전해질에 담겨 있는 구조를 하고 있다. 하나의 단위 전지에서 2V의 [[전압]]이 생성되는데, 일반적으로 6개의 단위 전지를 직렬로 연결해 전체 납축전지를 구성하므로 전체적으로 12V의 [[출력]] 전압을 얻을 수 있다. 구형 납축전지는 밀폐 상태가 완벽하지 않아 사용 시간이 지남에 따라 황산을 보충해 주어야 했지만, 현재 시판되는 납축전지는 내부가 완전히 밀폐되어 황산 보충의 필요성이 없고 누출의 위험도 거의 없다. 충전 과정에서는 방전 반응의 역반응이 각각의 전극에서 일어난다. 방전 반응의 전체 반응은 아래와 같고, 황산납 전극이 이산화납 및 납 전극으로 전환된다. 납축전지는 다른 2차전지에 비교해 경제적이지만 전지의 용량에 비교해 무거운 것이 단점이다. 납을 사용하기 때문에 환경 오염의 문제가 있다는 단점도 있다. 황산의 누출 위험성만 없다면 다른 2차전지들보다 안정적이다. 황산은 수십 년 동안 전 세계적으로 산업적으로 생산되고 사용되는 화학 물질 중 생산량 1위를 차지하고 있는데 축전지에 사용되는 양도 상당할 것이다. 납축전지는 자동차의 시동 및 조명 등 전자기기의 전원으로 널리 사용되고 있다. 골프용 카트, 지게차 등 전지의 무게가 중요하지 않은 용도로도 활용되고 있다. 산업용으로는 전력저장시스템(ESS), 전자기기 및 통신설비의 예비 전원 등으로 활용되고 있다. 전지의 무게가 문제 되는 용도에서는 최근 [[리튬이온전지]]로 대체되는 추세에 있다.<ref name="납축전지 네이버 지식백과"> 〈[https://terms.naver.com/entry.nhn?docId=5663051&cid=62802&categoryId=62802 납축전지]〉, 《네이버 지식백과》</ref> | ||
| + | |||
| + | === 니켈 수소 배터리 === | ||
| + | [[니켈 수소 배터리]]는 니켈 카드뮴 배터리를 개선한 배터리이다. 음극에 니켈, 양극에 수소 흡장 합금을 사용하고 전해질로는 80바 이상의 압력으로 압축된 수소를 사용하는데 단위 부피당 에너지 밀도가 [[니켈 카드뮴 배터리]]의 두 배에 가까워 고용량으로 만들 수 있다. 지나치게 방전되거나 충전돼도 성능이 크게 떨어지지 않고 자연적으로 충전 용량이 줄어드는 [[기억효과]](memory effect)도 적어 휴대전화나 노트북, 핸디캠 등에 널리 사용됐다. 단위 부피당 용량이 커서 초창기 [[전기자동차]]나 [[하이브리드 자동차]]에도 두루 쓰였다. 1990년대 중반까지 니켈 카드뮴과 니켈 수소 배터리 시장을 주도한 건 일본이었다. 당시 일본의 시장 점유율은 70%를 넘었다. 세계 최초의 혼합형 자동차 토요타 프리우스가 니켈 수소 배터리를 사용했다. 니켈 수소 배터리에도 단점이 있다. [[기억효과]]가 니켈 카드뮴 배터리보다 적긴 하지만 전혀 없진 않아서 완전히 방전하고 충전하지 않으면 용량이 줄어든다. 오래 사용하지 않으면 자연적으로 방전되기도 한다. 주행거리가 무엇보다 중요한 전기차에 이건 치명적인 단점이다. 배터리 용량이 자연적으로 줄어든다는 건 그만큼 주행거리가 줄어든다는 것을 의미하기 때문이다. 그래서 이를 개선한 리튬 이온 배터리가 등장했다. | ||
| + | |||
| + | === 니켈 카드뮴 배터리 === | ||
| + | [[니켈 카드뮴 배터리]]에 있는 활성 물질은 충전된 양극판, 양극에 수산화니켈 그리고 충전된 음극판, 음극에 스펀지 카드뮴이다. [[전해액]]은 증류수에 순수한 수산화칼륨을 중량으로 20%~34%의 농도에 수산화칼륨 용액이다. 소결된 니켈 카드뮴 배터리는 비교적 판격자 구조물을 형성하는 얇은 소결된 니켈 모체를 갖고 있다. 격자 구조물은 고도로 다공성의 것이며 활성 양성물질과 활성음성 물질로 주입한다. 그때 판은 고운 망사 그물망에 니켈분말을 소결시킴으로써 형성된다. 소결된 모체에 활성 물질을 처리 중에 다른 변이는 화학적으로, 또는 열로 활성 상태로 전환하고 그 다음에 형성된다. | ||
| + | |||
| + | 전반적으로, 주입과 형성의 이들의 순환에서 수많은 단계가 있다. 얇은 소결된 강판 셀은 매우 고율 충전 서비스와 방전 서비스에 이상적으로 적합하게 된다. 포켓 판 니켈 카드뮴 배터리는 도금한 강판을 구멍이 난 니켈의 포켓 안으로 또는 관 안으로 내리누른 양성 활성 물질 또는 음성 활성 물질이 있다. 활성 물질은 활성 물질 발산이 충분히 배제되도록 금속집전장치에 접촉으로 안전하게 갇힌다. 판은 순환 서비스 필요조건에 따르는 두께로서 아주 다양하게 설계한다. 니켈 카드뮴 배터리의 전형적인 개로 셀 전압은 약 1.25[V]이다. 충전전류가 니켈 카드뮴 배터리에 가해질 때, 음극판은 산소를 빼앗기고 금속성 카드뮴을 형성하기 시작한다. 양극판의 활성 물질, 즉 수산화니켈은 더 고도로 산화시키게 된다. 이 과정은 충전전류가 가해지는 동안 또는 모든 산소가 음극판에서 제거되고 오직 카드뮴만이 남아 있을 때까지 지속한다. 충전순환의 끝단으로 향하여, 셀은 가스를 방출한다. 이것은 또한 만약 셀이 과충전되었다면 일어날 것이다. 이 가스는 음극판에서 수소 그리고 양극판에서 산소로 전해액에 있는 물의 분해작용으로 발생한다. 온도뿐만 아니라 충전하는 동안에 사용된 전압은 언제 가스 발생이 일어날 것인지를 결정한다. 니켈 카드뮴 배터리를 완전히 충전하기 위해, 약간의, 그러나 근소한, 가스 발생은 일어나야 한다. 따라서 약간의 물이 사용될 것이다. 화학반응은 방전하는 동안에 반대로 된다. 양극판은 천천히 음극판에서 되찾은 산소를 포기한다. 이 과정은 화학에너지에서 전기에너지의 전환으로 귀착한다. 방전하는 동안에, 판은 전해액의 다수를 흡수한다. 재충전에서, 전해액의 높이는 올라가고, 완전충전에서, 전해액은 그것의 가장 높은 높이에 있게 될 것이다. 그런 까닭에, 물은 오직 배터리가 완전히 충전되었을 때에만 추가시켜야 한다. 니켈 카드뮴 배터리는 보통 황산납 배터리와 교체할 수 있는 것이다. 니켈 카드뮴 배터리로 황산납 배터리를 교체할 때, 배터리 실은 깨끗하게 하고, 건조하고, 그리고 이전의 배터리로부터 산의 모든 흔적에서 제거한다. 배터리 실은 씻어내어야 하고 암모니아 용액 또는 붕산 용액으로 중화시켜야 하고, 완전히 건조되도록 하고, 그 다음에 내알칼리성 바니시로 도장한다. 배터리 배수조직에 있는 대는 배터리 통기장치를 연결하기 전에 중량으로 3% 붕산과 물의 용액으로 흠뻑 적셔야 한다.<ref name="니켈 배터리 모터트렌드">서인수, 〈[https://www.motortrendkorea.com/sub/view.html?no=3950&cate1Name=ISSUE 배터리가 뭐에요?]〉, 《모터트렌드》, 2019-06-19</ref><ref name="GT허리케인">GT허리케인, 〈[http://www.ace.or.kr/bbs/board.php?bo_table=sub8_6&wr_id=34&sca=%ED%95%AD%EA%B3%B5%EA%B8%B0+%EC%A0%84%EC%9E%90%EC%A0%84%EA%B8%B0%EA%B3%84%EA%B8%B0 1.32 니켈카드뮴베터리(Nickel-Cadmium Batteries)]〉, 《항공직업전문학교》, 2018-05-17</ref> | ||
| + | |||
| + | === 리튬 이온 배터리 === | ||
| + | [[리튬 이온 배터리]]는 방전 과정에서 [[리튬 이온]]이 음극에서 양극으로 이동하는 배터리이다. 충전 시에는 리튬 이온이 양극에서 음극으로 다시 이동하여 제자리를 찾게 된다. 리튬 이온 배터리는 충전 및 재사용이 불가능한 1차전지인 리튬 배터리와는 다르며, 전해질로서 고체 폴리머를 이용하는 리튬 이온 폴리머 배터리와도 다르다. 리튬 이온 배터리는 에너지 밀도가 높고 [[메모리 효과]]가 없으며, 사용하지 않을 때도 자가방전이 일어나는 정도가 작기 때문에 시중의 휴대용 전자 기기들에 많이 사용되고 있다. 이 외에도 에너지 밀도가 높은 특성을 이용하여 방산업이나 자동화 시스템, 그리고 항공산업 분야에서도 점점 그 사용 빈도가 증가하는 추세이다. 그러나 일반적인 리튬 이온 배터리는 잘못 사용하게 되면 폭발할 염려가 있으므로 주의해야 한다. | ||
| + | |||
| + | 리튬 이온 배터리는 크게 양극, 음극, 전해질의 세 부분으로 나눌 수 있는데, 다양한 종류의 물질들이 이용될 수 있다. 상업적으로 가장 많이 이용되는 음극 재질은 [[흑연]]이다. 양극에는 층상의 리튬 코발트 산화물과 같은 산화물, 인산철 리튬과 같은 폴리 음이온, 리튬 망간 산화물, 스피넬 등이 쓰이며, 초기에는 이황화 티타늄도 쓰였다. 음극, 양극과 전해질로 어떤 물질을 사용하느냐에 따라 전지의 전압과 수명, 용량, 안정성 등이 크게 바뀔 수 있다. 최근에는 나노기술을 응용한 제작으로 전지의 성능을 높이고 있다. 전지의 용량은 mAh 또는 Ah로 표시하는데, 휴대전화에 사용하는 전지는 3,000~4,000mAh가 가장 많이 쓰이며, 스마트폰에는 1,500~5,000mAh도 사용된다. 노트북에 사용되는 전지는 2,400~5,500mAh가 가장 많이 사용된다.<ref name="리튬 이온 전지"> 〈[https://ko.wikipedia.org/wiki/%EB%A6%AC%ED%8A%AC_%EC%9D%B4%EC%98%A8_%EC%A0%84%EC%A7%80 리튬 이온 전지]〉, 《위키백과》</ref> | ||
| + | |||
| + | === 리튬 폴리머 배터리 === | ||
| + | [[리튬 폴리머 배터리]]는 리튬 이온 배터리의 뛰어난 성능은 그대로 유지하면서 폭발 위험성이 있는 액체 전해질 대신 화학적으로 가장 안정적인 [[폴리머]] 상태의 전해질을 사용하는 배터리다. 폴리머 전해질을 사용하고 있어 누액과 폭발의 위험성이 없을 뿐만 아니라, 3mm 정도의 얇은 두께와 소형으로 제작하는 것이 가능해 디자인 특성도 뛰어나다. 최근 모바일 기기의 디자인이 중시되면서 MP3, 핸드폰, 스마트폰, 태블릿PC 등 대부분의 모바일 기기에 채택되고 있으며 빠르게 그 활용 분야를 넓혀가고 있다. 장점으로는 높은 에너지 저장 밀도를 가지고 있어 같은 크기에 더 많은 용량이 들어간다. 환경을 오염시키는 중금속을 사용하지 않아 환경 친화적이다. 폴리머 상태의 전해질 사용으로 높은 안정성을 가지고 있다. 다양한 형상의 설계가 가능하다. 단점으로는 제조공정이 복잡하여 가격이 비싸다. 폴리머 전해질로 액체 전해질보다 이온의 전도율이 떨어진다. 저온에서의 사용특성이 떨어진다.<ref name="오로라 모바일">오로라 모바일, 〈[https://blog.naver.com/behappydw/114551121 리튬 이온 배터리 VS 리튬 폴리머 배터리]〉, 《네이버 블로그》, 2010-10-08</ref> | ||
| + | |||
| + | === 금속 공기 배터리 === | ||
| + | [[금속 공기 배터리]]는 1868년에 [[1차전지]]로 개발되었으며 에너지 밀도가 매우 높아 보청기나 미군의 군용 배터리로 쓰인다. 금속의 산화 반응을 통해 전기 에너지를 얻는 원리이며 아연 공기 배터리가 제일 많이 쓰인다. 원리가 단순하고 높은 에너지 밀도를 가지기 때문에 [[2차전지]]로서의 활용성이 활발히 연구되고 있다. 리튬 이온 배터리를 대체할 차세대 배터리로 주목받고 있으며 관련 특허도 상당하다. 한국에서는 [[삼성SDI]], [[현대자동차]], [[LG화학]] 순으로 관련 특허를 많이 가지고 있다. 리튬이 산화할 때 발생하는 에너지는 휘발유의 에너지 밀도와 비슷한 수준이다. 하지만 휘발유는 쓸수록 줄어들어 가벼워지는 반면에 금속 공기 배터리는 오히려 산소를 흡수하여 점점 무거워지므로 배터리로서의 에너지 밀도는 많이 떨어진다. 무게 증가 및 전기에너지 변환 효율을 고려한 리튬 공기 배터리의 최대 에너지 밀도는 3.5kWh/kg 수준으로, 리튬 이온 배터리의 약 10배이다. 다만 내연기관의 낮은 효율을 생각하면 실상 리튬 공기 배터리의 무게당 가용 에너지는 휘발유와 비슷하다고 볼 수 있다. 물론 이는 기술개발이 완료되어 이론상 완벽히 구현되었을 때의 이야기이다. 아직은 산화-환원 과정을 거치면서 금속의 변형이 발생하기 때문에 수명이 짧고, 효율, 방전율도 낮아서 반응성 높은 촉매의 개발 등 풀어야 할 과제가 많다.<ref name="이차 전지 나무위키">〈[https://namu.wiki/w/%EC%9D%B4%EC%B0%A8%20%EC%A0%84%EC%A7%80#s-2.4 이차 전지]〉, 《나무위키》</ref> | ||
| + | |||
| + | === 마그네슘 배터리 === | ||
| + | [[마그네슘 배터리]]는 인화성이나 폭발 위험이 있는 전통적인 리튬 이온 배터리와 달리 현대 생활에 안전하게 공급할 수 있는 가능성을 제공하고 있다. 그러나 에너지 저장 능력은 제한적이다. 연구팀은 최근 네이처 커뮤니케이션스지에 배터리 음극의 새로운 설계 발견과 저장 용량의 대폭적인 증가, 그리고 마그네슘 염화물 결합이 마그네슘을 호스트 안으로 삽입하기 전에 깨져야 한다는 기존의 결과를 뒤집는다고 보고했다. 마그네슘 이온은 호스트에 삽입하기가 어렵다고 알려져 있다. 우선, 염화 마그네슘 결합을 끊는 것은 매우 어렵다. 또한 생산된 마그네슘 이온은 호스트에서 매우 천천히 움직이며, 이로 인해 배터리의 효율이 저하된다. 새로운 배터리는 마그네슘 모노 클로라이드를 티타늄 다이설파이드와 같은 호스트에 삽입하여 에너지를 저장한다. 염화 마그네슘 결합을 유지함으로써 음극이 전통적인 마그네슘 배터리보다 훨씬 빠른 확산을 나타냈다. 연구팀은 기존 마그네슘 배터리의 경우 100mAh/g이었던 것에 비해 새로운 배터리는 400mAh/g의 저장 용량을 가지고 있다고 보고했다. 상업용 리튬 이온 배터리는 음극 용량이 약 200mAh/g이다. 리튬 배터리의 경우 3~4 볼트와 비교하여 새 배터리의 전압은 약 1V로 낮다. 높은 에너지 밀도와 결합한 고전압은 리튬 이온 배터리를 표준으로 만들었다. 그러나 리튬은 값이 비싸고 [[덴드라이트]](dendrite) 성장으로 알려진 상태인 내부 구조의 파괴를 일으킬 수 있다. 이는 배터리 발화의 원인이 된다. 지구에 풍부한 자원인 [[마그네슘]]은 저렴하고 덴드라이트를 형성하지 않는다. 그러나 지금까지는 더 나은 음극과 더 효율적인 전해질의 필요성으로 인해 문제가 발생하고 있다. 이를 해결하기 위해 마그네슘 염화물 결합을 끊고 마그네슘만을 삽입하는 대신 티타늄 다이설파이드를 팽창시켜 마그네슘 클로라이드가 삽입되도록 하였다. 염화 마그네슘 결합을 유지하면 음극이 저장할 수 있는 전하가 두 배가 되었다. 마그네슘 모노 클로라이드 분자는 너무 커서 종래의 방법을 사용하여 티타늄 다이설파이드에 삽입할 수 없다. 연구진은 초기 연구를 바탕으로 이산화타이타타늄의 틈을 유기 기둥을 사용하여 300%까지 확장하여 개방형 나노 구조를 만들었다. 개구부는 여전히 작았고 0.57 나노 미터에서 1.8 나노 미터로 증가했지만 염화마그네슘이 삽입될 수 있다. 결합한 이론 모델링, 분광 분석 및 전기 화학 연구 마그네슘 염화물 결합의 절단 없이 마그네슘 모노 클로라이드 양이온의 빠른 확산 동력을 밝혔다. 대용량은 실온에서도 탁월한 속도와 사이클링 성능을 수반하며 다원자가 이온 배터리를 위한 다양한 효과적인 인터칼 레이션 호스트의 가능성을 열어준다. 연구팀은 더 높은 전압의 호스트에 다양한 다원자 이온을 삽입하여 결국 전기자동차를 위해 저렴한 가격으로 고에너지 배터리를 만들 수 있을 것으로 기대하고 있다.<ref name="마그네슘 전지">Yan Yao, 〈[http://www.ndsl.kr/ndsl/search/detail/trend/trendSearchResultDetail.do?cn=GTB2017002960 마그네슘 전지의 획기적인 발전]〉, 《국가과학기술정보센터》, 2017-08-25</ref> | ||
| + | |||
| + | === 용융염 배터리 === | ||
| + | [[용융염 배터리]]는 용융염 즉, 액체 염화나트륨(소금)을 전해질로 사용하는 배터리이다. '열 배터리'나 '액체 금속 배터리'라고도 부른다. 2차 세계대전 중 독일 과학자 [[게오르크 오토 에르프]]에 의해 발명되었는데, 당시에는 재충전이 불가능한 열 배터리로, 배터리에 500도 이상의 열을 가하여 전해질 역할을 하는 소금과 애노드 역할을 하는 금속, 캐소드 역할을 하는 금속이 액화되면서 에너지를 방출하는 방식이었다. 이런 방식의 열 배터리는 주로 알루미늄 제련 공장에서 사용되는데, 이는 열 배터리가 막대한 에너지 밀도를 지닌데다 고압의 전력을 출력해낼 수 있어, 알루미늄 전기분해 제련법에 사용되기에 적합하였기 때문이다. 이외에 유도미사일 탑재용 배터리로 사용되기도 한다. 재충전이 가능한 용융염 배터리는 1960년대부터 연구되고 있었다. 배터리용 소금의 용융점은 98도로 사실 그리 높은 온도가 아니기에, 애노드와 캐소드 역할을 하는 금속만 잘 찾는다면 상대적으로 낮은 온도에서도 작동이 가능한 배터리를 개발할 수 있다. 즉 충전 및 방전 과정에서 발생하는 열만으로도 소금의 액체 상태를 유지할 수 있게 하면 되는 것이다. 특히 태양광 발전의 대중화로 고용량의 전력을 저장할 수 있는 배터리 기술의 필요성이 대두되는 상황에서 용융염 배터리는 이에 대한 해법이 될 수 있다. 실제로 미국 [[MIT]]에서 상용화가 가능한 용융염 배터리의 개발에 성공하였다. 현재 기술로 컨테이너 크기만한 공간에 2MWh의 전력을 저장할 수 있다. 용융염 배터리는 휴대성이 아닌 경제성과 에너지 밀도에 초점을 맞춘 배터리이다.<ref name="이차 전지 나무위키"></ref> | ||
| + | |||
| + | ==활용== | ||
| + | ===4차 산업혁명=== | ||
| + | [[산업혁명]]의 변천을 보면 그 단계에 따라 에너지의 변화가 있다. 인류는 새로운 에너지원을 사용하는 방향으로 발전해왔다. 인간과 자연의 노동력에서 석탄 에너지, 전기 에너지로 에너지가 변해왔으며 또 에너지의 공급과 소비 형태 측면에서도 전력망이 보급되면서 먼 거리까지 에너지를 보낼 수 있게 되어 많은 사람들이 더욱 편리하게 에너지를 사용하게 되었다. [[4차 산업혁명]]의 '모든 것이 서로 연결된 상태'가 가능하려면 필요한 것이 바로 배터리이다. 에너지를 지속적으로 공급받아야 하거나 소진 시 바로 보충해야 하는 시공간적 제약을 극복해주는 것이 배터리이기 때문이다. 예를 들어 [[인공지능 로봇]]의 경우 플러그가 꽂혀 있지 않은 상태에서 고작 10분 정도만 움직일 수 있다면 그것은 무용지물일 것이다. 인공지능 로봇이 [[빅데이터]]를 통한 자가 학습을 하려면 24시간 로봇이 켜져 있어야 한다. [[웨어러블 디바이스]], [[로봇]], [[드론]] 등이 인간의 삶에 도움이 될 만큼 충분히 움직일 수 있으려면 플러그 없이 오랜 시간 에너지를 공급받아야 한다. 결국 저장장치인 배터리가 그 해결책이 된다. 시공간의 제약을 극복한 초연결 사회의 현실화는 고용량, 고효율 배터리 기술이 좌우하게 될 것이다. 스마트폰, 자동차, 집, 학교, 공장 등 세상의 모든 것이 연결되는 초연결, 초지능의 4차 산업혁명 시대에는 초연결의 핵심 기술인 배터리에 주목해야 할 것이다.<ref>〈[https://www.samsungsdi.co.kr/column/technology/detail/55161.html?listType=gallery 4차 산업혁명과 배터리]〉, 《삼성SDI㈜ 공식 홈페이지》</ref> | ||
| + | |||
| + | ===전기자동차=== | ||
| + | [[전기자동차]]는 전기모터를 핵심동력으로 사용하는 자동차이다. 전기차의 종류로는 전기모터만으로 구동되는 '배터리만 이용하는 전기차'(BEV, Battery EV)와 전기플러그가 있어 전기를 외부에서 충전하는 '플러그인 하이브리드 전기차'(PHEV, Plug-In Hybrid EV)가 있다. 전기차는 전기모터를 동력으로 자동차가 곧바로 움직이므로 내연기관 자동차와 달리 엔진, 변속기와 같은 복잡한 동력전달계통이 필요 없다. 엔진에서 발생된 동력을 자동차휠에 전달해 주는 주요 동력전달 장치로는 내연기관의 경우 [[변속기]]와 [[클러치]]가 사용되고 있으나, 전기차는 변속기를 사용하지 않고 모터에서 생산된 동력을 일정 속도로 감속해 주는 [[감속기]]만이 이용된다. 전기차 시스템에는 재충전이 가능한 2차전지가 이용되며 전기차의 성능 가격에 배터리는 가장 큰 영향을 미친다. 전기모터 또한 배터리를 통해 구동력을 발전시키고, 배터리 관리시스템(BMS)으로 배터리의 충전 방전 조절, 전압 전류 온도 감시, 냉각 제어 등을 수행한다. 실제로 [[볼보자동차]]는 2019년부터 순수 전기차와 플러그인 하이브리드, 소형 가솔린 엔진과 대형 전기 배터리를 결합한 이른바 '마일드 하이브리드'만을 출시할 것으로 발표했다. | ||
| + | |||
| + | ====배터리팩==== | ||
| + | 전기차 산업이 발달되면서 전기차에 들어가는 배터리의 양이 적게는 수 십 개에서 많게는 수 천 개까지 들어가는데 수많은 배터리를 셀(Cell) 단위를 모듈(Module) 단위로 모으고 모듈들을 팩(Pack) 형태로 만들게 된다. 그리하여 전기차는 최종적으로 배터리가 하나의 팩 형태로 들어간다. 보통의 배터리팩은 [[모듈]]과 [[냉각시스템]], [[BMS]]로 구성되어 높은 용량과 배터리의 신뢰성 안전성을 지닌다. 모듈의 경우에는 여러 개의 셀이 열과 진동 등 외부 충격으로부터 보호될 수 있도록 하나의 프레임안에 셀을 여러 개로 묶어서 보관하게 된다.<ref> 〈[http://biz.heraldcorp.com/view.php?ud=20190607000514 셀, 모듈, 팩…전기차 배터리 그 속이 궁금하다]〉, 《해럴드경제》, 2019-06-08</ref> 이렇게 하여 충격에 보호는 되겠지만 모듈의 사용은 그만큼 공간을 더욱 사용하게 되어 에너지의 밀도가 낮아지는 문제점을 가져온다. 그리하여 중국은 [[셀투팩]](CTP, Cell To Pack)이라는 기술을 개발하여 모듈 없이 셀에서 바로 팩으로 넘어가게끔 하였다. 그리하여 부품 수도 줄어 비용 절감의 효과도 생기고, 공간 활용률이 적어도 20%가 높아져서 [[테슬라 모델3]], [[폭스바겐 아이디]] 등의 모델에 납품하고 있다.<ref> 류정 기자, 〈[https://www.chosun.com/economy/auto/2021/02/22/MLSFF7BXS5AWBA5ZUMOOKBBO4I/ 현대차 물량 휩쓴 中 배터리업체, 머스크도 놀란 기술 갖고 있었다]〉, 《조선일보》, 2021-02-22</ref> 냉각시스템은 배터리가 과열되는 것을 방지하는 시스템으로 공기를 이용한 [[공랭식]], 물을 이용한 [[수랭식]], 기름을 이용한 [[유랭식]]으로 각각 특징이 존재한다. 공랭식은 가장 간단한 방식이지만 그많큼 효율이 적고, 수랭식은 효율은 좋지만 물을 사용하기 때문에 물이 얼어버린다든지 물에 의한 부식이 생겨 문제를 발생시킨다. 때문에 기름을 사용하는 방식인 유랭식을 사용하여 이러한 문제를 해결하는 방식도 있다. 배터리팩을 구성하는 요소 중에 가장 중요한 것은 BMS이다. BMS의 핵심 역할은 에너지 효율을 높여 배터리의 수명을 연장시키는 것에 있다. 여러 셀을 사용하는 배터리팩은 셀 간 밸런싱이 맞지 않는 경우가 생길 수 있다. 그리하여 배터리 시스템이 충방전 때 최대 에너지를 채워놓고, 사용할 수 없게 할 수도 있으며 셀 밸런싱을 통하여 최대 에너지를 최적화하여 사용하게끔 관리한다.<ref> ECO 전도사, 〈[https://m.blog.naver.com/PostView.naver?isHttpsRedirect=true&blogId=dsjang650628&logNo=221686313770 배터리 관리 시스템 (Battery Management System, BMS) 이란?]〉, 《네이버 블로그》, 2019-10-23</ref> 뿐만 아니라 온도관리, 배터리 수명과 잔존 용량을 확인하여 탑승자에게 직접 수치화하여 보여주어 사고를 미연에 방지할 수도 있고, 직접 고장을 찾아내기도 하여 그 상태가 심하면 직접 off 하여 제어하기도 한다.<ref> 슈어소프트테크, 〈[https://m.blog.naver.com/suresofttech/221876357090 BMS(Battery Managment System)제어기란?]〉, 《네이버 블로그》, 2020-03-27</ref> | ||
| + | ====ESS==== | ||
| + | 전 세계적으로 각종 환경 문제와 더불어서 지구온난화가 지속되고, 그 원인인 석탄과 석유등 화석 에너지의 사용을 줄이기 위해 [[신재생에너지]]의 기술 개발이 전 세계적으로 이루어지고 있는데 전력사업에서는 신재생에너지로 [[ESS]]의 전망을 기대하고 있다.<ref> 최원창, 〈[http://www.energycenter.co.kr/news/articleView.html?idxno=185]〉, 《에너지설비관리》, 2017-03-30</ref> ESS란 에너지 저장 장치로 전력을 충전했다가 필요할 때 방전 에너지를 출력하는 장치로 쉽게 말해서 배터리라고 볼 수 있다. ESS를 만드는 방식은 전기자동차의 폐배터리를 이용해서 친환경적이라고 할 수 있다. 전기자동차는 5~10년, 주행거리 15~20km를 사용하게 되면 배터리 성능이 초기 대비 70~80% 수준으로 용량이 떨어지면서 교체를 하거나 폐기를 하게 된다. 이때 나온 폐배터리는 리튬과 코발트 니켈로 이루어져 환경적으로 문제가 되고, 화재의 문제가 될 수 있기 때문에 앞으로 많아질 전기차에 대응하여 배터리의 폐기를 고려해야 했다. 그리하여 배터리 리사이클링 기술을 개발하고 정부에서는 폐배터리를 직접 수거하여 ESS로 재활용하고 있다.<ref> 송기영 기자, 〈[(단독) 폐배터리 재활용 위해 뭉쳤다... 삼성·현대차·SK·LG, 첫 배터리 동맹]〉, 《조선비즈》, 2021-11-11</ref> 사용 원리 또한 친환경적인데 신재생 에너지인 태양광, 풍력 등을 사용해서 미리 저장했다가 필요한 시간대에 사용할 수 있는 방식이다. ESS에 [[에너지관리시스템]](EMS)가 충전 명령을 내리면 교류를 직류로 변환시키는 [[PCS]]는 충전 명령을 받는다. 이때 PCS는 BMS와 통신하여 배터리가 충전되도록 명령을 내리고 PCS는 [[발전소]]에서 공급되는 전류를 직류로 변환하여 배터리를 공급한다. 반대로 충전한 전기가 수용가가 방전하기 원하면 EMS, PCS, BMS 순으로 방전 명령 과정을 거처 방전을 하게 된다.<ref> 주식회사대건소프트, 〈[https://m.blog.naver.com/PostView.naver?isHttpsRedirect=true&blogId=dgs505&logNo=220700296965 (ESS란> part5)’ESS(Energt Storage System: 에너지저장장치)의 원리‘한번 알아볼까요?]〉, 《네이버 블로그》, 2016-05-04</ref> | ||
| + | ===사물배터리=== | ||
| + | 스마트워치, 스마트밴드 등 [[사물인터넷]](IoT) 기술을 접목한 사물들은 대부분 무선이다. 따라서 이러한 사물인터넷을 활용한 기기들에는 배터리가 필수적으로 필요하다. 그러면서 새로 주목받기 시작한 것이 바로 [[사물배터리]](BoT; Battery of Things)이다. 사물배터리 시대는 말 그대로 일상 생활 곳곳에 배터리가 사용된 환경을 말한다. 특히 스마트폰, 태블릿PC, 각종 웨어러블 기기와 같은 IT 제품이 사물배터리 시대를 확실하게 열었다. 여기에 더해 최근에는 non-IT기기인 전동공구, 전기자전거 등에도 배터리가 사용되고 있다. 특히 매년 성장을 거듭하는 [[에너지저장장치]](ESS)와 전기자동차 시장에서도 배터리는 필수품이다.<ref>김동규 기자, 〈[http://www.econovill.com/news/articleView.html?idxno=353354 사물배터리(BoT)시대...들어본적 있나요? - 사물인터넷시대 필수품 배터리]〉, 《이코노믹리뷰》, 2018-12-25</ref> 언제 어디서나 자유롭게 정보를 공유하고 사용하기 위해서는 오래 사용할 수 있고 가벼우며 휴대하기 편리해야 한다. 따라서 배터리의 성능, 휴대성, 안정성, 효율성 등이 중요할 수밖에 없게 되었고, 이에 따라 배터리 개발 기술이 주목받고 있다. 배터리를 통해 소비자들은 선이 없는 '무선'의 자유를 여러 IT기기, 생활가전에서 누릴 수 있게 됐다. 또 내연기관이 없는 전기자동차를 통해 환경오염도 줄일 수 있는 등 배터리를 통해 사람들은 생활 모습과 문화에서도 변화를 느끼게 됐다. 최근에는 태양광 연계형 에너지저장장치(ESS) 등도 많이 등장해 신재생에너지의 저장공간으로도 배터리가 사용되고 있다.<ref>한국전력, 〈[https://blog.kepco.co.kr/1879 사물인터넷(IoT)이 아닌 사물배터리(BoT)?]〉, 《한국전력 블로그》, 2020-08-05</ref> | ||
| + | |||
| + | == 기타 용어 == | ||
| + | * '''법률 용어''' : 영미권 법률에서는 배터리(battery)가 '폭행'(구타)을 의미하는 단어이다. | ||
| + | * '''군사 용어''' : 군함의 포대(砲臺)나 포탑(砲塔), 또는 지상의 포대(고정포대 포함)나 포병의 중대 단위 부대인 포대(砲隊)를 지칭한다. 여기서 '중대'를 지칭하는 군사 용어에는 크게 battery(포대), squadron(기병 중대), company(나머지 병과) 등이 있다. | ||
| + | * '''야구 용어''' : 투수와 포수를 묶어서 말할 때 쓰이는 단어이다. | ||
| + | |||
| + | == 동영상 == | ||
| + | <youtube>XMQdzi4mYtg</youtube> | ||
| + | <youtube>iAeGs1r7qxk</youtube> | ||
| + | |||
| + | {{각주}} | ||
== 참고자료 == | == 참고자료 == | ||
| − | * 〈[https://namu.wiki/w/%EB%B0%B0%ED%84%B0%EB%A6%AC 배터리]〉, 2019- | + | * 〈[https://terms.naver.com/entry.nhn?docId=5663051&cid=62802&categoryId=62802 납축전지]〉, 《네이버 지식백과》 |
| + | * 〈[https://ko.wikipedia.org/wiki/%EC%9D%BC%EC%B0%A8_%EC%A0%84%EC%A7%80 일차 전지]〉, 《위키백과》 | ||
| + | * 〈[https://ko.wikipedia.org/wiki/%EC%9D%B4%EC%B0%A8_%EC%A0%84%EC%A7%80 이차 전지]〉, 《위키백과》 | ||
| + | * 〈[https://namu.wiki/w/%EC%9D%B4%EC%B0%A8%20%EC%A0%84%EC%A7%80#s-2.4 이차 전지]〉, 《나무위키》 | ||
| + | * 〈[https://ko.wikipedia.org/wiki/%EC%A0%84%EC%A7%80 전지]〉, 《위키백과》 | ||
| + | * 〈[https://namu.wiki/w/%EC%A0%84%EC%A7%80(%EC%9E%A5%EC%B9%98) 전지]〉, 《나무위키》 | ||
| + | * 〈[https://namu.wiki/w/%EB%B0%B0%ED%84%B0%EB%A6%AC 배터리]〉, 《나무위키》 | ||
| + | * 〈[https://namu.wiki/w/%EB%B0%B0%ED%84%B0%EB%A6%AC%20%ED%8C%A9?from=%EB%B0%B0%ED%84%B0%EB%A6%AC%ED%8C%A9 배터리 팩]〉, 《나무위키》 | ||
| + | * 〈[https://ko.wikipedia.org/wiki/%EB%A6%AC%ED%8A%AC_%EC%9D%B4%EC%98%A8_%EC%A0%84%EC%A7%80 리튬 이온 전지]〉, 《위키백과》 | ||
| + | * 오로라 모바일, 〈[https://blog.naver.com/behappydw/114551121 리튬 이온 배터리 VS 리튬 폴리머 배터리]〉, 《네이버 블로그》, 2010-10-08 | ||
| + | * 삼성SDI, 〈[http://blog.naver.com/PostView.nhn?blogId=sdibattery&logNo=220919777665&parentCategoryNo=&categoryNo=&viewDate=&isShowPopularPosts=false&from=postView (배터리 여행) 배터리의 역사: 동물전기와 볼타전지]〉, 《네이버 블로그》, 2017-01-25 | ||
| + | * Yan Yao, 〈[http://www.ndsl.kr/ndsl/search/detail/trend/trendSearchResultDetail.do?cn=GTB2017002960 마그네슘 전지의 획기적인 발전]〉, 《국가과학기술정보센터》, 2017-08-25 | ||
| + | * 한화토탈, 〈[https://www.chemi-in.com/540 전자기기 시대를 연 배터리의 조상, 볼타전지]〉, 《티스토리》, 2021-04-06 | ||
| + | * 꿈꾸자 인생, 〈[https://i-love-mystory.tistory.com/111 이차전지의 충전과 방전 원리. 이것으로 끝. (리튬이온이차전지 배터리 원리!)]〉, 《티스토리》, 2020-09-25 | ||
| + | * JMmm, 〈[https://m.blog.naver.com/whdals2636/222072683144 '양극재 종류 정리(NCM, NCA, LFP, LCO)']〉, 《네이버 블로그》, 2020-08-27 | ||
| + | * GT허리케인, 〈[http://www.ace.or.kr/bbs/board.php?bo_table=sub8_6&wr_id=34&sca=%ED%95%AD%EA%B3%B5%EA%B8%B0+%EC%A0%84%EC%9E%90%EC%A0%84%EA%B8%B0%EA%B3%84%EA%B8%B0 1.32 니켈카드뮴베터리(Nickel-Cadmium Batteries)]〉, 《항공직업전문학교》, 2018-05-17 | ||
| + | * 몽당버터, 〈[https://blog.naver.com/canjelluv1117/221498116728 기원전 3세기부터 있었다는 '바그다드 전지'에 대한 잡썰]〉, 《네이버 블로그》, 2019-03-26 | ||
| + | * 서인수, 〈[https://www.motortrendkorea.com/sub/view.html?no=3950&cate1Name=ISSUE 배터리가 뭐에요?]〉, 《모터트렌드》, 2019-06-19 | ||
| + | * 최형균 기자, 〈[http://news.bizwatch.co.kr/article/industry/2020/06/05/0017 (전기차 배터리 질주)'차세대' 전고체를 잡아라]〉, 《비즈니스워치》, 2020-06-05 | ||
| + | * 안소영 기자, 〈[https://biz.chosun.com/site/data/html_dir/2020/08/17/2020081701426.html 韓 배터리, 中·日 꺾고 글로벌 '1위' 차지…"향후 2년이 고비"]〉, 《조선비즈》, 2020-08-17 | ||
| + | * 최만수 기자, 〈[https://www.hankyung.com/economy/article/2020081759241 테슬라 '배터리 데이' 주인공은 中 CATL?…긴장한 K배터리]〉, 《한국경제》, 2020-08-17 | ||
| + | * 김혜민 기자, 〈[https://news.sbs.co.kr/news/endPage.do?news_id=N1005943967 K 배터리, 유럽 · 중국 따돌리고 '제2 반도체' 될까]〉, 《SBS뉴스》, 2020-08-23 | ||
| + | * 최지희 기자, 〈[https://biz.chosun.com/site/data/html_dir/2020/09/29/2020092902380.html 너도 나도 배터리 생산… 어제의 거래처가 오늘의 경쟁자로 돌변]〉, 《조선비즈》, 2020-10-05 | ||
| + | * 박태준 기자, 〈[https://www.etnews.com/20201016000119 현대차 투자받은 '마카롱'·'코드42' 전기차 배터리 리스사업 추진]〉, 《전자신문》, 2020-10-18 | ||
| + | * 이하나, 〈[http://tago.kr/story/ev.htm 전기자동차는 무엇일까요?]〉, 《타고》, 2020-11-23 | ||
| + | * 이성정, 〈[http://tago.kr/story/battery.htm 배터리의 역사와 종류]〉, 《타고》, 2020-12-01 | ||
| + | * ECO 전도사, 〈[https://m.blog.naver.com/PostView.naver?isHttpsRedirect=true&blogId=dsjang650628&logNo=221686313770 배터리 관리 시스템 (Battery Management System, BMS) 이란?]〉, 《네이버 블로그》, 2019-10-23 | ||
| + | * 주식회사대건소프트, 〈[https://m.blog.naver.com/PostView.naver?isHttpsRedirect=true&blogId=dgs505&logNo=220700296965 (ESS란> part5)’ESS(Energt Storage System: 에너지저장장치)의 원리‘한번 알아볼까요?]〉, 《네이버블로그》, 2016-05-04 | ||
| + | |||
| + | == 같이 보기 == | ||
| + | * [[사물배터리]] | ||
| + | * [[전기자동차]] | ||
| + | |||
| + | {{배터리|추가 필요}} | ||
| + | {{배터리 회사}} | ||
| + | {{4차 산업혁명}} | ||
2024년 6월 13일 (목) 09:51 기준 최신판

배터리(battery)는 전기를 담아두는 부품을 말한다. 배터리는 넓은 범위에서는 전지, 좁은 범위에서는 2차전지인 축전지를 뜻하는 말이다. 휴대용 전자기기의 발달로 인해 배터리는 일상에 밀접한 용어가 되었다. 스마트폰에 이어, 전기자동차, 드론 등의 확산에 따라 배터리 산업이 폭발적으로 성장하고 있다. 사물인터넷(IoT)에 빗대어 사물배터리(BoT)라는 용어도 생겨났다. 전 세계 배터리 제조의 대부분은 한국, 중국, 일본의 3개국이 장악하고 있으며, 2020년 초 기준으로 한·중·일 3개국의 시장점유율 합계는 93.8%로 압도적이다. 국가별로는 1위 한국 34.5%, 2위 중국 32.9%, 3위 일본 26.4%이다.[1] 세계 1위의 전기자동차용 배터리 생산 업체는 2019년 중국 CATL이었으나, 2020년 한국 엘지화학이 1위로 올라섰다.
| [타고] 1개월 단위로 전기차가 필요할 때! 타고 월렌트 서비스 |
목차
개요[편집]
배터리는 전기 장치에 전원을 공급하기 위해 물리적 또는 화학적 작용을 통해 전기 에너지를 발생, 공급시키는 장치이다. 가장 흔하게 볼 수 있는 화학전지는 두 가지 금속의 이온화도 차이에서 오는 전위차를 이용한다. 이온의 양이 많을수록 흘려보낼 수 있는 전하의 양도 많기 때문에 같은 종류인 전지의 용량은 크기에 거의 비례한다. 배터리는 충전 가능 여부에 따라 충전이 불가능한 1차전지와 충전이 가능한 2차전지로 나뉜다. 1차전지는 전지 내의 전기화학 반응이 비가역적이기 때문에 한 번 쓰고 버려야 하는 일회용 전지를 말한다. 1차전지는 전지 내에 전류를 흘려줌으로써 방전 시에 일어난 화학 반응을 역으로 되돌리는 것이 불가능하다. 화학반응자들(리튬 전지에서의 리튬과 같은 원소들)은 전지에 역방향의 전류를 걸어 준다고 해서 본래의 위치로 되돌아가지 않으며, 따라서 전지의 용량이 회복되지도 않는다. 1차전지는 양극과 음극 중 어느 한쪽, 또는 양쪽 모두를 소진함으로써 수명을 다한다.
2차전지(축전지)는 외부의 전기 에너지를 화학 에너지의 형태로 바꾸어 저장해 두었다가 필요할 때에 전기를 만들어내고 재사용할 수 있는 장치를 말한다. 주로 쓰이는 2차전지는 납 축전지, 니켈-카드뮴(NiCd), 리튬 이온 전지(Li-ion), 리튬 이온 폴리머 전지(Li-ion polymer) 등이 있다. 2차전지는 1차전지가 있어야 충전이 가능하기 때문에 2차라는 이름이 붙었다. 2차전지는 1차전지에 비해 가격이 비싸지만 한 번 쓰고 버리는 1차전지에 비해 2차는 재사용할 수 있어 경제적이고 환경친화적이다. 1차전지는 장기간 에너지를 보존해야 하는 경우에 적합하다. 2차전지를 사용하면 자연 방전에 의한 손실이 장치 자체를 유지하는데 필요한 손실보다 커짐에 따라 비경제적이고 수일에서 수주 내에 교환해야 한다. 비축전지는 전지를 구성하는 양극, 음극, 전해질과 같은 구성 원소들을 분리해서 보관하고 있다가 전지를 써야 할 때 즉시 결합하여 사용하는 방식으로, 수십 년 이상의 긴 시간 동안 에너지를 보존하기 위해 제작된다. 이러한 전지는 비싸지만, 군수품 등에 이용될 수 있는데, 군수품은 장시간 보관하다가 급히 사용하는 경우가 많기 때문이다.[2][3][4]
어원[편집]
과거에는 일본식 표현인 밧데리(バッテリー)라고 불렸다. 로케트 밧데리라는 회사의 영향으로 밧데리라는 말이 널리 쓰이다가 워크맨 시절에 건전지, 충전지, 껌전지 등으로 순화되어 불리더니, 리튬 이온 배터리팩이 널리 쓰이면서 '배터리'란 용어로 바뀌어 쓰이게 되었다. 하지만 여전히 밧데리라는 표현도 종종 쓰인다. 배터리의 어원은 사실 '포병부대'에서 비롯되었다. 프랑스어가 어원이며 '때리다'는 뜻의 'battre'에서 포병부대라는 뜻의 'batterie'가 나왔다. battle(배틀)과 같은 어원을 가진다. 벤자민 플랭클린이 정전기를 담는 라이덴 병(Leyden jar)의 성능 향상을 위해 4개를 한 부대로 지정하며 배터리라 불렀는데. '같은 기능을 하는 조직의 모음'이란 뜻으로 썼으나 사람들은 전기공급장치라 읽게 된 것이 오늘날까지 이어지게 된 것이다.[5][6]
등장배경[편집]
1780년경 이탈리아 볼로냐 대학교의 생물학 교수였던 루이지 갈바니(Luigi Aloisio Galvani, 1737~1798)는 개구리를 해부하다가 개구리의 뒷다리에 황동 철사를 대었더니 꿈틀거리는 것을 목격했다. 개구리 다리가 어떤 자극을 받으면 전기가 흘러 근육이 움직인다며, 그 에너지를 동물전기라고 이름 짓고 1791년 발표하였다. 갈바니가 주장한 동물전기를 본 이탈리아의 알레산드로 볼타(Alessandro Volta)가 동물전기에 의문을 품고 있다가 1800년 실험을 통해 동물전기의 오류를 증명하였다. 이 과정에서 전기가 생기는 원리를 발견하고 1800년 구리와 아연을 이용해 세계 최초의 전기 저장 장치인 볼타전지가 탄생하게 되었다.
한편 1932년 독일의 케네디(Kennedy)가 이라크 바그다드 지역에 있는 후유트라브 유적에서 기원전 3세기(약 2000년 전)부터 사용된 것으로 보이는 바그다드 전지를 발굴했다. 바그다드 전지는 중앙부에 쇠막대를 박아놓은 구리 통을 도자기로 된 항아리가 감싸는 구조를 하고 있다. 구리 통에 쇠막대가 충분히 잠기게끔 전해질을 넣고 둘을 전선으로 연결하면 전기가 흐르게 할 수 있었다. 전해질로는 술이나 식초 등을 넣은 것으로 추정된다. 볼타전지와 같은 원리로 작동하는 바그다드 전지는 금이나 은을 도금하는 용도로 사용되었을 것으로 추정하고 있다.[7][8]
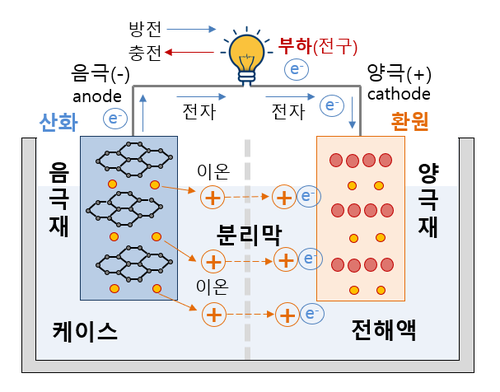
원리[편집]
2차 전지를 설명하기 전 기본적으로 1차 전지의 원리를 이해하는 것이 좋다. 최초의 1차 전지인 볼타 전지(voltaic cell)를 통하여 알아보자면 볼타 전지는 두 서로 다른 금속인 아연(Zn)과 구리(Cu)을 사용하게 되는데 묽은 황산에 아연판과 구리판을 넣어두고 아연판의 경우 이원화가 잘 이루어져 묽은 황산(H2SO4)과 같은 전해액에 아연판을 두게 되면 아연은 황산에 녹아 양이온이 되고, 아연판에 전자만 남게 된다. 이 같은 현상을 산화라고 하며 아연판에 남게 된 전자는 전선을 타고 넘어가 음전하를 띄게 된다. 이때 전자가 이동함에 따라 전기가 발생되는 것이다. 구리판으로 넘어가는 전자들은 황산 용액에 남아 있는 수소이온(H+)과 반응하여 수소 기체(H2)가 만들어지면서 아연에서 온 전자는 모든 반응을 마치게 된다.[9] 본래 이론적으로는 한쪽 판이 다 녹는다면 화학반응이 일어나지 않아 전기를 생성하지 못하는데, 볼타전지는 분극현상 때문에 아연이 다 녹지 않아도 전기를 생성하지 못하는 경우가 있다.
2차 전지는 충전과 방전으로 나뉜다. 방전원리는 1차 전지와 유사한 방법으로 화학반응을 통해 전기 에너지를 얻는다. 2차 전지 중 가장 많이 쓰이는 리튬이온배터리로 원리를 설명하면 음극에는 이온화가 쉬운 리튬(Li)이 있는데 마찬가지로 전해액에 녹아서 리튬금속이 이온화가 되어 리튬이온(Li+)과 전자(e-)로 분리된다. 리튬이온은 전해질을 타고 분리막을 지나 양극으로 이동하고 전자는 전선을 타고 양극으로 이동한다. 전자와 리튬이온이 양극에 있는 산화코발트(CoO2)와 만나게 되면 화학결합을 일으켜 리튬코발트산화물(LiCoO2)이 만들어진다. 그렇게 음극의 리튬이 모두 양극으로 넘어와 리튬코발트 산화물이 되면 완전방전 상태에 이른다. 완전방전 상태에서 충전기라는 외부 에너지를 배터리에 주입하게 되면 양극재에서 화학반응을 일으켜 리튬코발트산화물은 다시 리튬이온, 전자, 산화코발트로 분리된다. 이후 다시 왔던 방식과 동일하게 리튬이온은 양극에서 음극으로 전해액을 통해 분리막을 지나 이동하고, 전자는 다시 전선을 따라 양극에서 음극으로 이동한다. 이때는 전자가 이동하여도 전류는 발생하지 않는데 방전 때와 같이 자발적인 움직임이 아닌 충전기가 외부 에너지를 통하여 억지로 음극으로 밀어주는 상황이기 때문이다.[10] 그렇게 리튬이온과 전자는 다시 음극에 저장됨으로써 리튬코발트산화물이 모두 분해되어 전자와 리튬 이온이 음극 도착하면 완충 상태라고 볼 수 있다.
구성요소[편집]
음극재[편집]
음극재는 배터리 충전 속도와 수명을 결정하는 요소이기도 하는데 전자를 전지 충전 시 저장하였다가 방전 시 내어주는 역할을 한다. 음극재는 안정적인 구조와 저렴한 가격이 장점인 흑연을 주로 사용한다. 흑연은 층상구조로 충전 시 리튬이온이 이 층상구조 사이에 안정적인 구조로 쌓이면서 약간의 부피팽창이 이뤄진다. 리튬이온이 흑연층을 반복하여 지나다니면 음극의 부피가 계속해서 변하고 흑연 구조에 미세한 변화를 발생시키면서 수명이 감소하는데, 흑연은 비교적 체적 팽창이 작아서 사이클 수명이 길다. 이러한 흑연에도 천연흑연과 인조흑연이 나누어지는 데 천연흑연의 경우 용량이 350~360 mAh/g로 높은 편이지만 수명이 짧고, 인조흑연은 수명이 길지만 320~340 mAh/g로 용량이 작은 편이다. 그리하여 천연흑연은 저렴한 가격의 기기에서 주로 사용되고, 인조흑연은 오래 쓰이는 전기자동차나 스마트폰에 쓰이고 있다. 아무래도 배터리는 대용량이 목적이 됨에 따라서 흑연을 대체할 소재가 개발이 되고 있는데 그중 실리콘(Si)이 주목을 받고 있다. 실리콘은 흑연보다 10배 이상의 에너지 용량을 가지고 있고 충방전 속도가 빠르다고는 하지만 흑연보다 체적팽창이 매우 높아서 수명이 짧고, 비용이 비싸서 상용화 단계까지는 일러 연구가 진행되고 있다.[11]
양극재[편집]
양극재는 2차 전지를 구성하는 가장 중요한 요소로 배터리에서 양극재가 차지하는 비용만 40%가 된다. 양극재는 배터리의 용량과 평균 전압을 결정하는 요소로 에너지 밀도를 끌어올리기 위해서는 양극재를 이루는 양극활물질이 중요하다. 통상적으로 양극활 물질에는 니켈(Ni), 코발트(Co), 알루미늄(Al), 망간(Mn) 4개의 물질을 조합하여 NCA, NCM, LMO, LCO, LFP와 같은 배터리를 만들어 낸다.[12] LCO(리튬코발트산화물)의 경우 리튬배터리의 원조격으로 많이 사용되고 있는 양극재이다. 리튬, 코발트, 옥사인으로 구성되어 있는데 그중 코발트가 핵심원료로 니켈, 구리 광산 등에서 부산물로 얻을 수 있어서 세계적으로 채굴량이 적고, 전 세계 코발트 60% 이상이 아프리카 콩고 민주 공화국에서 생성되는데, 내전 등 정세 불안으로 코발트 공급이 불안해지면서 그 가격 또한 치솟고 있다. 코발트의 사용이 한정적으로 사용할 수밖에 없게 되자 양극재에 사용하는 코발트를 줄이는 쪽으로 개발이 진행되고 있다. 예를 들어 NCM(니켈코발트망간) 같은 경우에는 원래 비중이 1:1:1이었으나 니켈의 함량을 극대화하고 비싼 코발트 원료를 줄여 니켈의 비율이 60% 이상으로 구연된 하이니켈(high-nickel)이 개발되고 있고, 이를 통해서 니켈이 60%, 코발트와 망간이 각각 20%인 NCM622로부터 시작하여 NCM712, NCM811, NCM9½½가 있다. 코발트가 들어가 들어가지 않은 것도 있다 LFP는 LCO에 코발트 대신 인산철이 들어간 LFPO 구성으로 FPO로 불리는 양극재이다.[13] 중국에서 주력으로 개발하고 있으며 코발트와 니켈 등 고가 금속이 들어 있지 않아서 가격이 저렴하지만 부피가 커서 사용하기가 까다로운 편이다.
전해액[편집]
전해액은 리튬이온이 이동할 수 있는 통로의 역할로 염(Salt), 용매(Solvent), 첨가제(Additive) 3가지의 핵심 구성요소로 이루어져 있다. 염의 경우 전해액이 통로 역할을 할 수 있는 이유이기도 한데, 용매에 쉽게 용해되거나 해리가 잘 돼야하며 해리가 된 이온들이 잘 이동이 될 수 있어야 한다. 보편적으로는 이온이동과 용해도 화학적 안전성이 다른 염에 비해 우수한 인산, 불소로 구성된 LiPF6이 대표적인 염이다. 용매는 염을 잘 용해시켜 리튬이 원활하게 이동할 수 있도록 도와주는 역할로 용해도가 높아야 되는 특성상 이온 화합물을 분리시키는 유전상수가 높아야 한다.[14] 하지만 리튬의 원활한 이동을 위해서는 낮은 점도를 가지고 있어야 하는데 유전상수가 높을 수록 점도가 높아져서 이온이 원활하게 이동하지 못할 수도 있다. 때문에 용해도와 점도을 균형 있게 조합해야 최고의 이온전도도가 확보가 가능하다. 또한, 만일 전해액이 물로 이루어져 있고, 수분과 만나면 반응하는 리튬이 양극이나 음극에 존재할 경우 안전상 문제가 발생할 수 있기 때문에 화학적 반응이 적은 용매를 사용해야 한다. 첨가제는 양극이나 음극의 표면에 보호막을 형성하는 역할로 소량으로 첨가되는 물질이다. 때문에 첨가제는 양극용과 음극용으로 나누어져 각각의 역할을 수행한다. 양극 보호 첨가제는 양극의 구조를 안정화시키거나 표면을 보호하여 열화를 억제하고 발열을 개선하거나 과충전을 방지하고, 음극용 첨가제는 용매보다 먼저 분해되어 음극에 튼튼한 막을 형성하고 발열을 줄이거나 배터리 용량을 유지하는 역할을 한다.[15]
분리막[편집]
분리막은 양극과 음극을 물리적으로 분리하는 요소로 폴리올레핀(PO)계열의 폴리에틸렌(PE), 폴리프로필렌(PP)과 같은 절연소재의 얇은 막으로 이루어져 있다. 양극과 음극은 셀안에서 직접 접촉을 하게 되면 도선을 통하여 전류가 흐르지 않거나 리튬 이온의 움직임이 증가하여 불이 날 수도 있기 때문에 분리막이 필요하다. 실제로 2016년 갤럭시 노트 7의 전지 폭발과 2020년 현대차 코나 EV 화재사고의 원인을 분리막 품질 문제라고 추정하고 있는 것을 보아 분리막은 화재와 폭발과 연관이 있음을 확인할 수 있다. 그렇다고 해서 분리막이 완벽히 음극과 양극을 나누고 있는 것이 아니다. 분리막 표면에 미세한 기공이 존재한다. 전지는 이온이 음극과 양극을 자유롭게 이동해야 하는데 분리막으로 인해 완전히 막히게 된다면 화학적 반응이 일어날 수가 없다. 때문에 이온이 이동할 통로를 제공하는 선에서 미세한 기공을 확보하는 것이다. 이 미세한 구멍은 건식과 습식 두 방식으로 나뉘어 만들어진다. 건식분리막은 기계적인 힘으로 필름을 당겨서 기공을 만드는 방식이고, 습식은 기본 필름에 첨가제를 추가하여 화학적으로 기공을 만드는 방식이다. 각 방식은 장단점을 가지고 있는데 건식은 물리적으로 분리막을 늘려서 기공을 확보하는 것이기 때문에 기공의 사이즈의 균일성은 떨어지고 강도가 약하지만 간단한 방식이기 때문에 저렴한 비용으로 제조가 가능하다. 습식분리막은 기공 사이즈가 일정하고 강도가 강해서 고용량, 고출력 등 고사양을 요구하는 셀에서 많이 사용된다.[16] 이렇게 만들어진 기공은 열에 의해서 변형이 일어나기도 하여 문제가 발생하는데, 고분자 분리막의 열악한 열적 특성을 개선하기 위해 코팅을 하여 다층구조를 이루는 형태를 하고 있다. 이로 인해 고온 안전성이 뛰어나긴 하지만 다층구조로 인하여 두께가 증가하고 에너지 밀도가 감소한다는 단점이 있어 이를 극복하고자 다양한 시도를 하고 있다.
케이스[편집]
배터리 모양에도 원통, 직사각형의 얇고 넓은 형태, 두껍고 각진 형태로 여러 형태가 있다. 그 모양은 배터리 케이스에 따라서 결정이 되는데 단순 모양만 바뀌는 것이 아닌 모양에 따라 특성도 달라지게 된다. 원통형 케이스는 흔히 볼 수 있는 AA 건전지와 같은 형태로 오랜 역사를 지니고 있고 그에 따른 관련 기술이 다량 축적되어 안정성이 높은 편이다. 또한 고용량, 고에너지를 갖추고 있어서 주로 전력이 많이 필요한 제품에 탑재가 된다. 대신 원통형 배터리 같은 경우에는 여러 개를 사용할 경우에 빈 공간이 생겨 공간의 효율성이 떨어진다는 단점을 가지고 있다. 각형 케이스는 과거에 탈착식 스마트폰에서 많이 보던 배터리를 생각하면 되는 데 원통형에 비하여 한정적인 공간에서 더 많은 배터리를 사용할 수 있다는 점이 장점이다. 마찬가지로 단점이 있는데 파우치 형과 비교하면 에너지 밀도가 낮다. 제조 방식에서 양극재와 음극재, 분리막 등을 돌돌 말아서 제조하고 있기 때문에 각진 케이스에 그렇게 말아놓은 젤리롤을 넣게 되면 모서리에 빈틈이 생겨 내부공간을 완벽하게 채울 수 없기 때문이다. 이를 개선하기 위해 층층이 쌓는 방식인 스테킹 방식을 도입하고 있다.[17] 마지막으로 파우치 형은 앞서 말한 스테킹 방식과 같이 층층이 쌓는 방식으로 제조되어 배터리의 빈 곳이 거의 생기지 않는다. 때문에 다양한 크기와 형태로 배터리를 만들 수 있어서 업체의 다양한 요구사항에 대응이 가능하다. 단, 생산단가가 높고 다른 배터리에 비하여 내구성이 떨어진다.
종류[편집]
납축전지[편집]
납축전지는 납과 황산을 전극과 전해질로 사용하는 전지로서, 충전 방전을 통해 반복해 사용할 수 있는 2차전지이다. 납축전지는 1859년 프랑스의 플랑테(Planté)가 개발한 가장 오래된 형태의 2차전지로 현재 자동차에 널리 활용되고 있다. 이산화납 전극과 납 전극이 황산 전해질에 담겨 있는 구조를 하고 있다. 하나의 단위 전지에서 2V의 전압이 생성되는데, 일반적으로 6개의 단위 전지를 직렬로 연결해 전체 납축전지를 구성하므로 전체적으로 12V의 출력 전압을 얻을 수 있다. 구형 납축전지는 밀폐 상태가 완벽하지 않아 사용 시간이 지남에 따라 황산을 보충해 주어야 했지만, 현재 시판되는 납축전지는 내부가 완전히 밀폐되어 황산 보충의 필요성이 없고 누출의 위험도 거의 없다. 충전 과정에서는 방전 반응의 역반응이 각각의 전극에서 일어난다. 방전 반응의 전체 반응은 아래와 같고, 황산납 전극이 이산화납 및 납 전극으로 전환된다. 납축전지는 다른 2차전지에 비교해 경제적이지만 전지의 용량에 비교해 무거운 것이 단점이다. 납을 사용하기 때문에 환경 오염의 문제가 있다는 단점도 있다. 황산의 누출 위험성만 없다면 다른 2차전지들보다 안정적이다. 황산은 수십 년 동안 전 세계적으로 산업적으로 생산되고 사용되는 화학 물질 중 생산량 1위를 차지하고 있는데 축전지에 사용되는 양도 상당할 것이다. 납축전지는 자동차의 시동 및 조명 등 전자기기의 전원으로 널리 사용되고 있다. 골프용 카트, 지게차 등 전지의 무게가 중요하지 않은 용도로도 활용되고 있다. 산업용으로는 전력저장시스템(ESS), 전자기기 및 통신설비의 예비 전원 등으로 활용되고 있다. 전지의 무게가 문제 되는 용도에서는 최근 리튬이온전지로 대체되는 추세에 있다.[18]
니켈 수소 배터리[편집]
니켈 수소 배터리는 니켈 카드뮴 배터리를 개선한 배터리이다. 음극에 니켈, 양극에 수소 흡장 합금을 사용하고 전해질로는 80바 이상의 압력으로 압축된 수소를 사용하는데 단위 부피당 에너지 밀도가 니켈 카드뮴 배터리의 두 배에 가까워 고용량으로 만들 수 있다. 지나치게 방전되거나 충전돼도 성능이 크게 떨어지지 않고 자연적으로 충전 용량이 줄어드는 기억효과(memory effect)도 적어 휴대전화나 노트북, 핸디캠 등에 널리 사용됐다. 단위 부피당 용량이 커서 초창기 전기자동차나 하이브리드 자동차에도 두루 쓰였다. 1990년대 중반까지 니켈 카드뮴과 니켈 수소 배터리 시장을 주도한 건 일본이었다. 당시 일본의 시장 점유율은 70%를 넘었다. 세계 최초의 혼합형 자동차 토요타 프리우스가 니켈 수소 배터리를 사용했다. 니켈 수소 배터리에도 단점이 있다. 기억효과가 니켈 카드뮴 배터리보다 적긴 하지만 전혀 없진 않아서 완전히 방전하고 충전하지 않으면 용량이 줄어든다. 오래 사용하지 않으면 자연적으로 방전되기도 한다. 주행거리가 무엇보다 중요한 전기차에 이건 치명적인 단점이다. 배터리 용량이 자연적으로 줄어든다는 건 그만큼 주행거리가 줄어든다는 것을 의미하기 때문이다. 그래서 이를 개선한 리튬 이온 배터리가 등장했다.
니켈 카드뮴 배터리[편집]
니켈 카드뮴 배터리에 있는 활성 물질은 충전된 양극판, 양극에 수산화니켈 그리고 충전된 음극판, 음극에 스펀지 카드뮴이다. 전해액은 증류수에 순수한 수산화칼륨을 중량으로 20%~34%의 농도에 수산화칼륨 용액이다. 소결된 니켈 카드뮴 배터리는 비교적 판격자 구조물을 형성하는 얇은 소결된 니켈 모체를 갖고 있다. 격자 구조물은 고도로 다공성의 것이며 활성 양성물질과 활성음성 물질로 주입한다. 그때 판은 고운 망사 그물망에 니켈분말을 소결시킴으로써 형성된다. 소결된 모체에 활성 물질을 처리 중에 다른 변이는 화학적으로, 또는 열로 활성 상태로 전환하고 그 다음에 형성된다.
전반적으로, 주입과 형성의 이들의 순환에서 수많은 단계가 있다. 얇은 소결된 강판 셀은 매우 고율 충전 서비스와 방전 서비스에 이상적으로 적합하게 된다. 포켓 판 니켈 카드뮴 배터리는 도금한 강판을 구멍이 난 니켈의 포켓 안으로 또는 관 안으로 내리누른 양성 활성 물질 또는 음성 활성 물질이 있다. 활성 물질은 활성 물질 발산이 충분히 배제되도록 금속집전장치에 접촉으로 안전하게 갇힌다. 판은 순환 서비스 필요조건에 따르는 두께로서 아주 다양하게 설계한다. 니켈 카드뮴 배터리의 전형적인 개로 셀 전압은 약 1.25[V]이다. 충전전류가 니켈 카드뮴 배터리에 가해질 때, 음극판은 산소를 빼앗기고 금속성 카드뮴을 형성하기 시작한다. 양극판의 활성 물질, 즉 수산화니켈은 더 고도로 산화시키게 된다. 이 과정은 충전전류가 가해지는 동안 또는 모든 산소가 음극판에서 제거되고 오직 카드뮴만이 남아 있을 때까지 지속한다. 충전순환의 끝단으로 향하여, 셀은 가스를 방출한다. 이것은 또한 만약 셀이 과충전되었다면 일어날 것이다. 이 가스는 음극판에서 수소 그리고 양극판에서 산소로 전해액에 있는 물의 분해작용으로 발생한다. 온도뿐만 아니라 충전하는 동안에 사용된 전압은 언제 가스 발생이 일어날 것인지를 결정한다. 니켈 카드뮴 배터리를 완전히 충전하기 위해, 약간의, 그러나 근소한, 가스 발생은 일어나야 한다. 따라서 약간의 물이 사용될 것이다. 화학반응은 방전하는 동안에 반대로 된다. 양극판은 천천히 음극판에서 되찾은 산소를 포기한다. 이 과정은 화학에너지에서 전기에너지의 전환으로 귀착한다. 방전하는 동안에, 판은 전해액의 다수를 흡수한다. 재충전에서, 전해액의 높이는 올라가고, 완전충전에서, 전해액은 그것의 가장 높은 높이에 있게 될 것이다. 그런 까닭에, 물은 오직 배터리가 완전히 충전되었을 때에만 추가시켜야 한다. 니켈 카드뮴 배터리는 보통 황산납 배터리와 교체할 수 있는 것이다. 니켈 카드뮴 배터리로 황산납 배터리를 교체할 때, 배터리 실은 깨끗하게 하고, 건조하고, 그리고 이전의 배터리로부터 산의 모든 흔적에서 제거한다. 배터리 실은 씻어내어야 하고 암모니아 용액 또는 붕산 용액으로 중화시켜야 하고, 완전히 건조되도록 하고, 그 다음에 내알칼리성 바니시로 도장한다. 배터리 배수조직에 있는 대는 배터리 통기장치를 연결하기 전에 중량으로 3% 붕산과 물의 용액으로 흠뻑 적셔야 한다.[19][20]
리튬 이온 배터리[편집]
리튬 이온 배터리는 방전 과정에서 리튬 이온이 음극에서 양극으로 이동하는 배터리이다. 충전 시에는 리튬 이온이 양극에서 음극으로 다시 이동하여 제자리를 찾게 된다. 리튬 이온 배터리는 충전 및 재사용이 불가능한 1차전지인 리튬 배터리와는 다르며, 전해질로서 고체 폴리머를 이용하는 리튬 이온 폴리머 배터리와도 다르다. 리튬 이온 배터리는 에너지 밀도가 높고 메모리 효과가 없으며, 사용하지 않을 때도 자가방전이 일어나는 정도가 작기 때문에 시중의 휴대용 전자 기기들에 많이 사용되고 있다. 이 외에도 에너지 밀도가 높은 특성을 이용하여 방산업이나 자동화 시스템, 그리고 항공산업 분야에서도 점점 그 사용 빈도가 증가하는 추세이다. 그러나 일반적인 리튬 이온 배터리는 잘못 사용하게 되면 폭발할 염려가 있으므로 주의해야 한다.
리튬 이온 배터리는 크게 양극, 음극, 전해질의 세 부분으로 나눌 수 있는데, 다양한 종류의 물질들이 이용될 수 있다. 상업적으로 가장 많이 이용되는 음극 재질은 흑연이다. 양극에는 층상의 리튬 코발트 산화물과 같은 산화물, 인산철 리튬과 같은 폴리 음이온, 리튬 망간 산화물, 스피넬 등이 쓰이며, 초기에는 이황화 티타늄도 쓰였다. 음극, 양극과 전해질로 어떤 물질을 사용하느냐에 따라 전지의 전압과 수명, 용량, 안정성 등이 크게 바뀔 수 있다. 최근에는 나노기술을 응용한 제작으로 전지의 성능을 높이고 있다. 전지의 용량은 mAh 또는 Ah로 표시하는데, 휴대전화에 사용하는 전지는 3,000~4,000mAh가 가장 많이 쓰이며, 스마트폰에는 1,500~5,000mAh도 사용된다. 노트북에 사용되는 전지는 2,400~5,500mAh가 가장 많이 사용된다.[21]
리튬 폴리머 배터리[편집]
리튬 폴리머 배터리는 리튬 이온 배터리의 뛰어난 성능은 그대로 유지하면서 폭발 위험성이 있는 액체 전해질 대신 화학적으로 가장 안정적인 폴리머 상태의 전해질을 사용하는 배터리다. 폴리머 전해질을 사용하고 있어 누액과 폭발의 위험성이 없을 뿐만 아니라, 3mm 정도의 얇은 두께와 소형으로 제작하는 것이 가능해 디자인 특성도 뛰어나다. 최근 모바일 기기의 디자인이 중시되면서 MP3, 핸드폰, 스마트폰, 태블릿PC 등 대부분의 모바일 기기에 채택되고 있으며 빠르게 그 활용 분야를 넓혀가고 있다. 장점으로는 높은 에너지 저장 밀도를 가지고 있어 같은 크기에 더 많은 용량이 들어간다. 환경을 오염시키는 중금속을 사용하지 않아 환경 친화적이다. 폴리머 상태의 전해질 사용으로 높은 안정성을 가지고 있다. 다양한 형상의 설계가 가능하다. 단점으로는 제조공정이 복잡하여 가격이 비싸다. 폴리머 전해질로 액체 전해질보다 이온의 전도율이 떨어진다. 저온에서의 사용특성이 떨어진다.[22]
금속 공기 배터리[편집]
금속 공기 배터리는 1868년에 1차전지로 개발되었으며 에너지 밀도가 매우 높아 보청기나 미군의 군용 배터리로 쓰인다. 금속의 산화 반응을 통해 전기 에너지를 얻는 원리이며 아연 공기 배터리가 제일 많이 쓰인다. 원리가 단순하고 높은 에너지 밀도를 가지기 때문에 2차전지로서의 활용성이 활발히 연구되고 있다. 리튬 이온 배터리를 대체할 차세대 배터리로 주목받고 있으며 관련 특허도 상당하다. 한국에서는 삼성SDI, 현대자동차, LG화학 순으로 관련 특허를 많이 가지고 있다. 리튬이 산화할 때 발생하는 에너지는 휘발유의 에너지 밀도와 비슷한 수준이다. 하지만 휘발유는 쓸수록 줄어들어 가벼워지는 반면에 금속 공기 배터리는 오히려 산소를 흡수하여 점점 무거워지므로 배터리로서의 에너지 밀도는 많이 떨어진다. 무게 증가 및 전기에너지 변환 효율을 고려한 리튬 공기 배터리의 최대 에너지 밀도는 3.5kWh/kg 수준으로, 리튬 이온 배터리의 약 10배이다. 다만 내연기관의 낮은 효율을 생각하면 실상 리튬 공기 배터리의 무게당 가용 에너지는 휘발유와 비슷하다고 볼 수 있다. 물론 이는 기술개발이 완료되어 이론상 완벽히 구현되었을 때의 이야기이다. 아직은 산화-환원 과정을 거치면서 금속의 변형이 발생하기 때문에 수명이 짧고, 효율, 방전율도 낮아서 반응성 높은 촉매의 개발 등 풀어야 할 과제가 많다.[23]
마그네슘 배터리[편집]
마그네슘 배터리는 인화성이나 폭발 위험이 있는 전통적인 리튬 이온 배터리와 달리 현대 생활에 안전하게 공급할 수 있는 가능성을 제공하고 있다. 그러나 에너지 저장 능력은 제한적이다. 연구팀은 최근 네이처 커뮤니케이션스지에 배터리 음극의 새로운 설계 발견과 저장 용량의 대폭적인 증가, 그리고 마그네슘 염화물 결합이 마그네슘을 호스트 안으로 삽입하기 전에 깨져야 한다는 기존의 결과를 뒤집는다고 보고했다. 마그네슘 이온은 호스트에 삽입하기가 어렵다고 알려져 있다. 우선, 염화 마그네슘 결합을 끊는 것은 매우 어렵다. 또한 생산된 마그네슘 이온은 호스트에서 매우 천천히 움직이며, 이로 인해 배터리의 효율이 저하된다. 새로운 배터리는 마그네슘 모노 클로라이드를 티타늄 다이설파이드와 같은 호스트에 삽입하여 에너지를 저장한다. 염화 마그네슘 결합을 유지함으로써 음극이 전통적인 마그네슘 배터리보다 훨씬 빠른 확산을 나타냈다. 연구팀은 기존 마그네슘 배터리의 경우 100mAh/g이었던 것에 비해 새로운 배터리는 400mAh/g의 저장 용량을 가지고 있다고 보고했다. 상업용 리튬 이온 배터리는 음극 용량이 약 200mAh/g이다. 리튬 배터리의 경우 3~4 볼트와 비교하여 새 배터리의 전압은 약 1V로 낮다. 높은 에너지 밀도와 결합한 고전압은 리튬 이온 배터리를 표준으로 만들었다. 그러나 리튬은 값이 비싸고 덴드라이트(dendrite) 성장으로 알려진 상태인 내부 구조의 파괴를 일으킬 수 있다. 이는 배터리 발화의 원인이 된다. 지구에 풍부한 자원인 마그네슘은 저렴하고 덴드라이트를 형성하지 않는다. 그러나 지금까지는 더 나은 음극과 더 효율적인 전해질의 필요성으로 인해 문제가 발생하고 있다. 이를 해결하기 위해 마그네슘 염화물 결합을 끊고 마그네슘만을 삽입하는 대신 티타늄 다이설파이드를 팽창시켜 마그네슘 클로라이드가 삽입되도록 하였다. 염화 마그네슘 결합을 유지하면 음극이 저장할 수 있는 전하가 두 배가 되었다. 마그네슘 모노 클로라이드 분자는 너무 커서 종래의 방법을 사용하여 티타늄 다이설파이드에 삽입할 수 없다. 연구진은 초기 연구를 바탕으로 이산화타이타타늄의 틈을 유기 기둥을 사용하여 300%까지 확장하여 개방형 나노 구조를 만들었다. 개구부는 여전히 작았고 0.57 나노 미터에서 1.8 나노 미터로 증가했지만 염화마그네슘이 삽입될 수 있다. 결합한 이론 모델링, 분광 분석 및 전기 화학 연구 마그네슘 염화물 결합의 절단 없이 마그네슘 모노 클로라이드 양이온의 빠른 확산 동력을 밝혔다. 대용량은 실온에서도 탁월한 속도와 사이클링 성능을 수반하며 다원자가 이온 배터리를 위한 다양한 효과적인 인터칼 레이션 호스트의 가능성을 열어준다. 연구팀은 더 높은 전압의 호스트에 다양한 다원자 이온을 삽입하여 결국 전기자동차를 위해 저렴한 가격으로 고에너지 배터리를 만들 수 있을 것으로 기대하고 있다.[24]
용융염 배터리[편집]
용융염 배터리는 용융염 즉, 액체 염화나트륨(소금)을 전해질로 사용하는 배터리이다. '열 배터리'나 '액체 금속 배터리'라고도 부른다. 2차 세계대전 중 독일 과학자 게오르크 오토 에르프에 의해 발명되었는데, 당시에는 재충전이 불가능한 열 배터리로, 배터리에 500도 이상의 열을 가하여 전해질 역할을 하는 소금과 애노드 역할을 하는 금속, 캐소드 역할을 하는 금속이 액화되면서 에너지를 방출하는 방식이었다. 이런 방식의 열 배터리는 주로 알루미늄 제련 공장에서 사용되는데, 이는 열 배터리가 막대한 에너지 밀도를 지닌데다 고압의 전력을 출력해낼 수 있어, 알루미늄 전기분해 제련법에 사용되기에 적합하였기 때문이다. 이외에 유도미사일 탑재용 배터리로 사용되기도 한다. 재충전이 가능한 용융염 배터리는 1960년대부터 연구되고 있었다. 배터리용 소금의 용융점은 98도로 사실 그리 높은 온도가 아니기에, 애노드와 캐소드 역할을 하는 금속만 잘 찾는다면 상대적으로 낮은 온도에서도 작동이 가능한 배터리를 개발할 수 있다. 즉 충전 및 방전 과정에서 발생하는 열만으로도 소금의 액체 상태를 유지할 수 있게 하면 되는 것이다. 특히 태양광 발전의 대중화로 고용량의 전력을 저장할 수 있는 배터리 기술의 필요성이 대두되는 상황에서 용융염 배터리는 이에 대한 해법이 될 수 있다. 실제로 미국 MIT에서 상용화가 가능한 용융염 배터리의 개발에 성공하였다. 현재 기술로 컨테이너 크기만한 공간에 2MWh의 전력을 저장할 수 있다. 용융염 배터리는 휴대성이 아닌 경제성과 에너지 밀도에 초점을 맞춘 배터리이다.[23]
활용[편집]
4차 산업혁명[편집]
산업혁명의 변천을 보면 그 단계에 따라 에너지의 변화가 있다. 인류는 새로운 에너지원을 사용하는 방향으로 발전해왔다. 인간과 자연의 노동력에서 석탄 에너지, 전기 에너지로 에너지가 변해왔으며 또 에너지의 공급과 소비 형태 측면에서도 전력망이 보급되면서 먼 거리까지 에너지를 보낼 수 있게 되어 많은 사람들이 더욱 편리하게 에너지를 사용하게 되었다. 4차 산업혁명의 '모든 것이 서로 연결된 상태'가 가능하려면 필요한 것이 바로 배터리이다. 에너지를 지속적으로 공급받아야 하거나 소진 시 바로 보충해야 하는 시공간적 제약을 극복해주는 것이 배터리이기 때문이다. 예를 들어 인공지능 로봇의 경우 플러그가 꽂혀 있지 않은 상태에서 고작 10분 정도만 움직일 수 있다면 그것은 무용지물일 것이다. 인공지능 로봇이 빅데이터를 통한 자가 학습을 하려면 24시간 로봇이 켜져 있어야 한다. 웨어러블 디바이스, 로봇, 드론 등이 인간의 삶에 도움이 될 만큼 충분히 움직일 수 있으려면 플러그 없이 오랜 시간 에너지를 공급받아야 한다. 결국 저장장치인 배터리가 그 해결책이 된다. 시공간의 제약을 극복한 초연결 사회의 현실화는 고용량, 고효율 배터리 기술이 좌우하게 될 것이다. 스마트폰, 자동차, 집, 학교, 공장 등 세상의 모든 것이 연결되는 초연결, 초지능의 4차 산업혁명 시대에는 초연결의 핵심 기술인 배터리에 주목해야 할 것이다.[25]
전기자동차[편집]
전기자동차는 전기모터를 핵심동력으로 사용하는 자동차이다. 전기차의 종류로는 전기모터만으로 구동되는 '배터리만 이용하는 전기차'(BEV, Battery EV)와 전기플러그가 있어 전기를 외부에서 충전하는 '플러그인 하이브리드 전기차'(PHEV, Plug-In Hybrid EV)가 있다. 전기차는 전기모터를 동력으로 자동차가 곧바로 움직이므로 내연기관 자동차와 달리 엔진, 변속기와 같은 복잡한 동력전달계통이 필요 없다. 엔진에서 발생된 동력을 자동차휠에 전달해 주는 주요 동력전달 장치로는 내연기관의 경우 변속기와 클러치가 사용되고 있으나, 전기차는 변속기를 사용하지 않고 모터에서 생산된 동력을 일정 속도로 감속해 주는 감속기만이 이용된다. 전기차 시스템에는 재충전이 가능한 2차전지가 이용되며 전기차의 성능 가격에 배터리는 가장 큰 영향을 미친다. 전기모터 또한 배터리를 통해 구동력을 발전시키고, 배터리 관리시스템(BMS)으로 배터리의 충전 방전 조절, 전압 전류 온도 감시, 냉각 제어 등을 수행한다. 실제로 볼보자동차는 2019년부터 순수 전기차와 플러그인 하이브리드, 소형 가솔린 엔진과 대형 전기 배터리를 결합한 이른바 '마일드 하이브리드'만을 출시할 것으로 발표했다.
배터리팩[편집]
전기차 산업이 발달되면서 전기차에 들어가는 배터리의 양이 적게는 수 십 개에서 많게는 수 천 개까지 들어가는데 수많은 배터리를 셀(Cell) 단위를 모듈(Module) 단위로 모으고 모듈들을 팩(Pack) 형태로 만들게 된다. 그리하여 전기차는 최종적으로 배터리가 하나의 팩 형태로 들어간다. 보통의 배터리팩은 모듈과 냉각시스템, BMS로 구성되어 높은 용량과 배터리의 신뢰성 안전성을 지닌다. 모듈의 경우에는 여러 개의 셀이 열과 진동 등 외부 충격으로부터 보호될 수 있도록 하나의 프레임안에 셀을 여러 개로 묶어서 보관하게 된다.[26] 이렇게 하여 충격에 보호는 되겠지만 모듈의 사용은 그만큼 공간을 더욱 사용하게 되어 에너지의 밀도가 낮아지는 문제점을 가져온다. 그리하여 중국은 셀투팩(CTP, Cell To Pack)이라는 기술을 개발하여 모듈 없이 셀에서 바로 팩으로 넘어가게끔 하였다. 그리하여 부품 수도 줄어 비용 절감의 효과도 생기고, 공간 활용률이 적어도 20%가 높아져서 테슬라 모델3, 폭스바겐 아이디 등의 모델에 납품하고 있다.[27] 냉각시스템은 배터리가 과열되는 것을 방지하는 시스템으로 공기를 이용한 공랭식, 물을 이용한 수랭식, 기름을 이용한 유랭식으로 각각 특징이 존재한다. 공랭식은 가장 간단한 방식이지만 그많큼 효율이 적고, 수랭식은 효율은 좋지만 물을 사용하기 때문에 물이 얼어버린다든지 물에 의한 부식이 생겨 문제를 발생시킨다. 때문에 기름을 사용하는 방식인 유랭식을 사용하여 이러한 문제를 해결하는 방식도 있다. 배터리팩을 구성하는 요소 중에 가장 중요한 것은 BMS이다. BMS의 핵심 역할은 에너지 효율을 높여 배터리의 수명을 연장시키는 것에 있다. 여러 셀을 사용하는 배터리팩은 셀 간 밸런싱이 맞지 않는 경우가 생길 수 있다. 그리하여 배터리 시스템이 충방전 때 최대 에너지를 채워놓고, 사용할 수 없게 할 수도 있으며 셀 밸런싱을 통하여 최대 에너지를 최적화하여 사용하게끔 관리한다.[28] 뿐만 아니라 온도관리, 배터리 수명과 잔존 용량을 확인하여 탑승자에게 직접 수치화하여 보여주어 사고를 미연에 방지할 수도 있고, 직접 고장을 찾아내기도 하여 그 상태가 심하면 직접 off 하여 제어하기도 한다.[29]
ESS[편집]
전 세계적으로 각종 환경 문제와 더불어서 지구온난화가 지속되고, 그 원인인 석탄과 석유등 화석 에너지의 사용을 줄이기 위해 신재생에너지의 기술 개발이 전 세계적으로 이루어지고 있는데 전력사업에서는 신재생에너지로 ESS의 전망을 기대하고 있다.[30] ESS란 에너지 저장 장치로 전력을 충전했다가 필요할 때 방전 에너지를 출력하는 장치로 쉽게 말해서 배터리라고 볼 수 있다. ESS를 만드는 방식은 전기자동차의 폐배터리를 이용해서 친환경적이라고 할 수 있다. 전기자동차는 5~10년, 주행거리 15~20km를 사용하게 되면 배터리 성능이 초기 대비 70~80% 수준으로 용량이 떨어지면서 교체를 하거나 폐기를 하게 된다. 이때 나온 폐배터리는 리튬과 코발트 니켈로 이루어져 환경적으로 문제가 되고, 화재의 문제가 될 수 있기 때문에 앞으로 많아질 전기차에 대응하여 배터리의 폐기를 고려해야 했다. 그리하여 배터리 리사이클링 기술을 개발하고 정부에서는 폐배터리를 직접 수거하여 ESS로 재활용하고 있다.[31] 사용 원리 또한 친환경적인데 신재생 에너지인 태양광, 풍력 등을 사용해서 미리 저장했다가 필요한 시간대에 사용할 수 있는 방식이다. ESS에 에너지관리시스템(EMS)가 충전 명령을 내리면 교류를 직류로 변환시키는 PCS는 충전 명령을 받는다. 이때 PCS는 BMS와 통신하여 배터리가 충전되도록 명령을 내리고 PCS는 발전소에서 공급되는 전류를 직류로 변환하여 배터리를 공급한다. 반대로 충전한 전기가 수용가가 방전하기 원하면 EMS, PCS, BMS 순으로 방전 명령 과정을 거처 방전을 하게 된다.[32]
사물배터리[편집]
스마트워치, 스마트밴드 등 사물인터넷(IoT) 기술을 접목한 사물들은 대부분 무선이다. 따라서 이러한 사물인터넷을 활용한 기기들에는 배터리가 필수적으로 필요하다. 그러면서 새로 주목받기 시작한 것이 바로 사물배터리(BoT; Battery of Things)이다. 사물배터리 시대는 말 그대로 일상 생활 곳곳에 배터리가 사용된 환경을 말한다. 특히 스마트폰, 태블릿PC, 각종 웨어러블 기기와 같은 IT 제품이 사물배터리 시대를 확실하게 열었다. 여기에 더해 최근에는 non-IT기기인 전동공구, 전기자전거 등에도 배터리가 사용되고 있다. 특히 매년 성장을 거듭하는 에너지저장장치(ESS)와 전기자동차 시장에서도 배터리는 필수품이다.[33] 언제 어디서나 자유롭게 정보를 공유하고 사용하기 위해서는 오래 사용할 수 있고 가벼우며 휴대하기 편리해야 한다. 따라서 배터리의 성능, 휴대성, 안정성, 효율성 등이 중요할 수밖에 없게 되었고, 이에 따라 배터리 개발 기술이 주목받고 있다. 배터리를 통해 소비자들은 선이 없는 '무선'의 자유를 여러 IT기기, 생활가전에서 누릴 수 있게 됐다. 또 내연기관이 없는 전기자동차를 통해 환경오염도 줄일 수 있는 등 배터리를 통해 사람들은 생활 모습과 문화에서도 변화를 느끼게 됐다. 최근에는 태양광 연계형 에너지저장장치(ESS) 등도 많이 등장해 신재생에너지의 저장공간으로도 배터리가 사용되고 있다.[34]
기타 용어[편집]
- 법률 용어 : 영미권 법률에서는 배터리(battery)가 '폭행'(구타)을 의미하는 단어이다.
- 군사 용어 : 군함의 포대(砲臺)나 포탑(砲塔), 또는 지상의 포대(고정포대 포함)나 포병의 중대 단위 부대인 포대(砲隊)를 지칭한다. 여기서 '중대'를 지칭하는 군사 용어에는 크게 battery(포대), squadron(기병 중대), company(나머지 병과) 등이 있다.
- 야구 용어 : 투수와 포수를 묶어서 말할 때 쓰이는 단어이다.
동영상[편집]
각주[편집]
- ↑ 안소영 기자, 〈韓 배터리, 中·日 꺾고 글로벌 '1위' 차지…"향후 2년이 고비"〉, 《조선비즈》, 2020-08-17
- ↑ 〈전지〉, 《나무위키》
- ↑ 〈일차 전지〉, 《위키백과》
- ↑ 〈이차 전지〉, 《위키백과》
- ↑ 〈배터리〉, 《나무위키》
- ↑ 〈전지〉, 《위키백과》
- ↑ 삼성SDI, 〈(배터리 여행) 배터리의 역사: 동물전기와 볼타전지〉, 《네이버 블로그》, 2017-01-25
- ↑ 몽당버터, 〈기원전 3세기부터 있었다는 '바그다드 전지'에 대한 잡썰〉, 《네이버 블로그》, 2019-03-26
- ↑ 한화토탈, 〈전자기기 시대를 연 배터리의 조상, 볼타전지〉, 《티스토리》, 2021-04-06
- ↑ 꿈꾸자 인생, 〈이차전지의 충전과 방전 원리. 이것으로 끝. (리튬이온이차전지 배터리 원리!)〉, 《티스토리》, 2020-09-25
- ↑ 럭킴, 〈리튬이온 배터리 기초 3.음극재란?〉, 《티스토리》, 2020-05-25
- ↑ JMmm, 〈'양극재 종류 정리(NCM, NCA, LFP, LCO)'〉, 《네이버 블로그》, 2020-08-27
- ↑ 박민규 기자, 〈(ER궁금증) 이차 전지의 핵심, 양극재는 무엇?〉, 《이코노믹리뷰》, 2020-10-03
- ↑ 김동규 기자, 〈(ER 궁금증) 리튬이온 배터리의 ‘혈액’ 전해액〉, 《이코노믹리뷰》, 2019-03-24
- ↑ 〈리튬이온을 위한 베스트 드라이버 ‘전해액’〉, 《삼성SDI》, 2020-11-04
- ↑ 김동규 기자, 〈(ER 궁금증) "너네 둘 못만난다"...배터리 분리막의 ‘숭고한 임무’〉, 《이코노믹리뷰》, 2019-03-31
- ↑ 럭킴, 〈배터리 제조 프로세스 1. 배터리 타입(타우치형, 각형, 원통형)〉, 《티스토리》, 2020-06-25
- ↑ 〈납축전지〉, 《네이버 지식백과》
- ↑ 서인수, 〈배터리가 뭐에요?〉, 《모터트렌드》, 2019-06-19
- ↑ GT허리케인, 〈1.32 니켈카드뮴베터리(Nickel-Cadmium Batteries)〉, 《항공직업전문학교》, 2018-05-17
- ↑ 〈리튬 이온 전지〉, 《위키백과》
- ↑ 오로라 모바일, 〈리튬 이온 배터리 VS 리튬 폴리머 배터리〉, 《네이버 블로그》, 2010-10-08
- ↑ 23.0 23.1 〈이차 전지〉, 《나무위키》
- ↑ Yan Yao, 〈마그네슘 전지의 획기적인 발전〉, 《국가과학기술정보센터》, 2017-08-25
- ↑ 〈4차 산업혁명과 배터리〉, 《삼성SDI㈜ 공식 홈페이지》
- ↑ 〈셀, 모듈, 팩…전기차 배터리 그 속이 궁금하다〉, 《해럴드경제》, 2019-06-08
- ↑ 류정 기자, 〈현대차 물량 휩쓴 中 배터리업체, 머스크도 놀란 기술 갖고 있었다〉, 《조선일보》, 2021-02-22
- ↑ ECO 전도사, 〈배터리 관리 시스템 (Battery Management System, BMS) 이란?〉, 《네이버 블로그》, 2019-10-23
- ↑ 슈어소프트테크, 〈BMS(Battery Managment System)제어기란?〉, 《네이버 블로그》, 2020-03-27
- ↑ 최원창, 〈[1]〉, 《에너지설비관리》, 2017-03-30
- ↑ 송기영 기자, 〈[(단독) 폐배터리 재활용 위해 뭉쳤다... 삼성·현대차·SK·LG, 첫 배터리 동맹]〉, 《조선비즈》, 2021-11-11
- ↑ 주식회사대건소프트, 〈(ESS란> part5)’ESS(Energt Storage System: 에너지저장장치)의 원리‘한번 알아볼까요?〉, 《네이버 블로그》, 2016-05-04
- ↑ 김동규 기자, 〈사물배터리(BoT)시대...들어본적 있나요? - 사물인터넷시대 필수품 배터리〉, 《이코노믹리뷰》, 2018-12-25
- ↑ 한국전력, 〈사물인터넷(IoT)이 아닌 사물배터리(BoT)?〉, 《한국전력 블로그》, 2020-08-05
참고자료[편집]
- 〈납축전지〉, 《네이버 지식백과》
- 〈일차 전지〉, 《위키백과》
- 〈이차 전지〉, 《위키백과》
- 〈이차 전지〉, 《나무위키》
- 〈전지〉, 《위키백과》
- 〈전지〉, 《나무위키》
- 〈배터리〉, 《나무위키》
- 〈배터리 팩〉, 《나무위키》
- 〈리튬 이온 전지〉, 《위키백과》
- 오로라 모바일, 〈리튬 이온 배터리 VS 리튬 폴리머 배터리〉, 《네이버 블로그》, 2010-10-08
- 삼성SDI, 〈(배터리 여행) 배터리의 역사: 동물전기와 볼타전지〉, 《네이버 블로그》, 2017-01-25
- Yan Yao, 〈마그네슘 전지의 획기적인 발전〉, 《국가과학기술정보센터》, 2017-08-25
- 한화토탈, 〈전자기기 시대를 연 배터리의 조상, 볼타전지〉, 《티스토리》, 2021-04-06
- 꿈꾸자 인생, 〈이차전지의 충전과 방전 원리. 이것으로 끝. (리튬이온이차전지 배터리 원리!)〉, 《티스토리》, 2020-09-25
- JMmm, 〈'양극재 종류 정리(NCM, NCA, LFP, LCO)'〉, 《네이버 블로그》, 2020-08-27
- GT허리케인, 〈1.32 니켈카드뮴베터리(Nickel-Cadmium Batteries)〉, 《항공직업전문학교》, 2018-05-17
- 몽당버터, 〈기원전 3세기부터 있었다는 '바그다드 전지'에 대한 잡썰〉, 《네이버 블로그》, 2019-03-26
- 서인수, 〈배터리가 뭐에요?〉, 《모터트렌드》, 2019-06-19
- 최형균 기자, 〈(전기차 배터리 질주)'차세대' 전고체를 잡아라〉, 《비즈니스워치》, 2020-06-05
- 안소영 기자, 〈韓 배터리, 中·日 꺾고 글로벌 '1위' 차지…"향후 2년이 고비"〉, 《조선비즈》, 2020-08-17
- 최만수 기자, 〈테슬라 '배터리 데이' 주인공은 中 CATL?…긴장한 K배터리〉, 《한국경제》, 2020-08-17
- 김혜민 기자, 〈K 배터리, 유럽 · 중국 따돌리고 '제2 반도체' 될까〉, 《SBS뉴스》, 2020-08-23
- 최지희 기자, 〈너도 나도 배터리 생산… 어제의 거래처가 오늘의 경쟁자로 돌변〉, 《조선비즈》, 2020-10-05
- 박태준 기자, 〈현대차 투자받은 '마카롱'·'코드42' 전기차 배터리 리스사업 추진〉, 《전자신문》, 2020-10-18
- 이하나, 〈전기자동차는 무엇일까요?〉, 《타고》, 2020-11-23
- 이성정, 〈배터리의 역사와 종류〉, 《타고》, 2020-12-01
- ECO 전도사, 〈배터리 관리 시스템 (Battery Management System, BMS) 이란?〉, 《네이버 블로그》, 2019-10-23
- 주식회사대건소프트, 〈(ESS란> part5)’ESS(Energt Storage System: 에너지저장장치)의 원리‘한번 알아볼까요?〉, 《네이버블로그》, 2016-05-04
같이 보기[편집]
| ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||

 위키원
위키원