염분
염분(塩分)은 해수 1kg(1,000g)에 녹아있는 염류의 총량을 (g)수로 나타낸 것이다.[1]
목차
개요[편집]
- 염분은 바닷물 1kg에 함유된 고형물의 그램수이다. ‰(퍼밀)의 단위를 사용해왔으나, 최근부터 psu(실용염분)의 단위를 사용한다. 세계 바다의 평균 염분농도는 35‰이다. 염분농도는 해면 증발과 강수와의 차이에 대체로 비례한다. 측정 방법으로는 중량분석법, 비중 측정환산법, 염소적정법, 전도도측정법등이 있다. 전 세계 바다의 평균 염분은 35‰(퍼밀)이다. 보통 비율은 1/100인 퍼센트(%, percent)로 표시하나 바닷물 안의 염류의 양이 적어 1/1000인 퍼밀(‰, permil)로 나타낸다. 즉 염분은 1kg(1000g)의 바닷물 안에 들어 있는 염류의 g수이다. 예를 들어 바닷물 1kg에 50g의 염류가 있다면 50‰, 400g의 염류가 있다면 400‰이다. 최근 해양학에서는 퍼밀(‰) 대신 p.s.u(practical salinity unit, 실용염분단위)를 사용하기도 한다. p.s.u는 단위를 붙이지 않는다.[2]
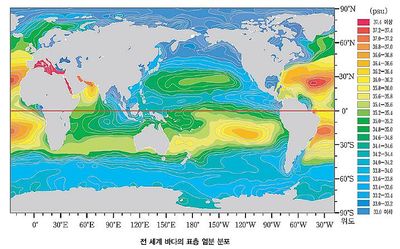
- 염분은 소금기라는 의미로 사용되는 경우가 많다. 과학에서는 염분을 해수 1kg에 녹아 있는 염류의 총량이라는 뜻으로 사용한다. 즉, 염분은 소금(염화나트륨)뿐만 아니라 해수에 녹아 있는 물질의 총량이 어느 정도인지를 뜻하는 말이다. 해수의 염류 중에서 가장 많은 양을 차지하는 염화나트륨(NaCl)은 염소와 나트륨의 화합물이며 식용 소금의 주성분이다. 소금은 짠맛을 내며 무색투명한 결정으로 사람의 체액에 존재하고 삼투압 유지에 중요한 역할을 하므로 사람이 살아가는 데 없어서는 안 되는 아주 중요한 물질이다. 나트륨 이온과(Na+) 염화 이온(Cl-)이 포함되어 있어 물에 잘 녹으며 바닷물 1kg 중 약 27.21g이 들어 있다. 염화나트륨은 바다의 염전이나 육지의 암염 등에서 얻을 수 있다. 염산·수산화나트륨 등의 제조 원료로 사용되고 조미료, 된장, 간장의 원료로 사용되기도 한다. 또한 도자기의 유약, 생리적 식염수, 링거액과 같은 의약품에도 사용된다. 해수에 녹아 있는 염류의 성분비는 일정하지만, 염분은 지역에 따라 조금씩 차이를 보인다. 대부분의 염분은 '증발량-강수량'에 비례하여 나타난다. 증발량이 크고 강수량이 적은 페르시아만에서는 40 ‰ 이상의 염분이 측정되기도 한다. 표층 해수의 위도에 따른 염분 분포를 보면 적도와 고위도 지역에서는 낮게 나타난다. 이러한 지역에서 염분이 낮은 것은 적도 지역은 강수량이 많기 때문이며, 극지방 주변 고위도 지역의 바다는 빙하가 녹은 물에 희석되기 때문이다. 또한, 강물의 영향이 큰 육지 주변 바다의 해수는 먼바다 해수의 염분보다 낮다.
염분의 측정 방법[편집]
- 염분의 측정 방법은 18세기까지만 해도 분석 방법이 정밀하지 않아서 염분 측정이 어려웠지만 19세기 초에 일정 성분비에 대하여 알려지고 정확한 분석 방법이 생기면서 측정 및 분석이 가능해졌다. 가장 표준이 되는 염분 측정 방법은 Mohr-Knudsen 적정법으로 질산은에 의한 염소 적정법이다. 채수병에 바닷물을 담아온 후 바닷물에 가장 많이 포함되어있는 염소의 양을 염화은으로 적정을 하여 염소의 양을 측정한 후, 다른 성분과의 비율로 환산하여 전체의 염분의 양을 측정하는 방법이다.
- 바닷물에 포함된 염분에 양에 따른 전기 전도도의 차이를 이용하여 염분을 측정하기도 한다. 염분이 증가하면 바닷물의 전기 저항이 감소하여 전기 전도도가 증가하게 되는 것을 이용해서 관측 장비로 바닷가에서 수심에 따른 염도를 측정할 수 있다. 또, 다른 방법으로 굴절도와 비중계를 이용한 것이 있다. 굴절도를 이용한 방법은 바닷물에 포함된 염분의 양에 따라 빛이 굴절되는 정도가 변하는 원리를 이용한 것이다. 휴대가 간편하여 수시로 염분을 측정할 수 있고 저렴하지만 정확하지 않은 것이 단점이다. 비중계를 이용한 방법은 바닷물 내의 염분에 따라 밀도가 달라지는 원리를 이용한 것이다. 사용이 편리하고 값이 저렴하지만, 정확도가 떨어지고 온도에 따라 달라질 수 있으므로 보정이 필요하다는 단점이 있다.
염분의 섭취[편집]
- 염분이 없으면 지구의 많은 생물은 목숨을 이어가지 못하기 때문에, 소금은 인간의 생존을 위해 반드시 있어야 하는 것이다. 그러나 불순물 함유량이 많은 소금을 너무 많이 섭취하면 고혈압, 신장병, 심장병을 일으킬 수 있다. 그러나 현재는 염분 과잉 섭취를 두려워한 나머지, 염분을 너무 섭취하지 않아서 혼수상태가 되어 병원에 실려가는 사람이나 사망하는 사람도 나오고 있다. 이 경우, 목숨을 건져도 만성적으로 염분이 부족하면 혈중 나트륨 이온 농도를 낮은 수준으로 일정 범위를 유지하려고 몸이 변화하기 때문에, 염분의 급속한 배출에 따라 오랜 시간 동안 염분을 대량 섭취하는 치료를 실시해야 한다.
- 더운 날씨에 운동할 때나 땀을 흘렸을 때 수분뿐 아니라 염분도 배출되지만, 그와 관련 없이 수분을 보급하면 혈중 나트륨 이온 농도가 낮아진다. 몸은 혈중 나트륨 이온 농도를 일정 범위로 유지하기 위해 땀이나 오줌으로 배출하게 되며, 오히려 수분이 부족하게 되어 열사병이나 경련을 일으킬 수도 있다. 그러므로 높은 온도의 환경에서 일하는 곳에서는 직원에게 염분을 보급하기 위해 식염을 놓곤 한다. 되도록 불순물 함량이 없는 깨끗한 소금을 섭취해야 건강을 유지할 수 있다.
염류와 염분[편집]
- NaCl(염화나트륨)과 MgCl2(염화마그네슘), Na2SO4(황산나트륨), CaCl2(염화칼슘), KCl(염화칼륨)을 합하면 바닷물에 녹아 있는 염류의 약 99%가 된다. 이러한 염류의 상대적 비율은 어느 곳의 바닷물이든 일정하다. 단지 물의 양이 변화하여 염분만 바뀐다. 이는 감자, 고기, 양파를 1:1:1의 비율로 섞어 만든 카레에 섞는 물의 양을 조절하는 것에 비유할 수 있다. 감자와 고기, 양파를 염류로 생각하면 물이 많이 들어갈 경우 물에 비해 염류의 양이 적으니 염분은 낮아지고, 물이 적게 들어가면 염분은 높아진다. 사하라 사막 옆의 바다는 건조하므로 증발되는 물의 양이 많아 염분이 높고, 비가 많이 내리는 적도의 바다는 염분이 낮다. 또한 극지방에서는 물이 얼어 빙하가 되기 때문에 염분이 높다. 세계 바다의 평균 염분은 35‰이지만, 발틱해의 경우 10‰ 이하로 내려가기도 하고 사해(死海)의 경우 200‰의 염분을 보인다.
염분비일정의 법칙[편집]
- 염분비일정의 법칙(the principle of constant proportions)은 바닷물에 포함된 염의 비율(염분 농도)은 달라져도 염들 사이의 상대적 비율은 항상 일정하다는 법칙이다. 염분이라는 개념은 1865년 덴마크의 화학자 포츠해머(Forchhammer, 1794~1865)에 의해 최초로 도입되었는데, 포츠해머는 해수에 녹아 있는 모든 원소를 정량적으로 측정하려고 시도하지 않고 염소, 황산, 마그네슘, 석회, 칼륨 및 소다와 같은 주요 염류를 정밀하게 추정하고자 하였다. 이 과정에서 포츠해머는 다양한 곳에서 채취해 온 해수 샘플에서 주요 염분의 비율이 일정하다는 것을 발견하였는데, 이를 '포츠해머의 원리' 또는 '일정 성분비의 원리'로 불렸다. 1884년 독일의 윌리엄 디트마(William Dittmar, 1833~1892)는 챌린저 탐사(1872~1876)를 통해 채취된 전 세계 해양의 해수 77개 샘플을 정밀하게 분석하였다. 그 결과, 각 해역의 염분농도(‰)는 다르지만 바닷물 속에 들어 있는 각 염(Na+, Cl- 등)들의 비율은 일정하다는 사실을 알아냈다. 이는 전 세계의 바닷물이 골고루 잘 섞이고 있다는 것을 뜻한다. 이로써 포츠해머의 법칙이 증명되었고, '염분비 일정의 법칙'이 확립되었다.
염분 약층[편집]
- 염분 약층(halocline,塩分躍層)은 수심에 따라 염분이 급격히 변하는 층이다. 해양에서 급격하게 염분값이 변하는 층으로, 중위도와 저위도 해역에서 높은 염분의 해수 아래에 차갑고 낮은 염분의 수괴가 위치하며 형성된다. 염분 약층은 일반적으로 '영구적 수온 약층(permanent thermocline)'과 거의 유사한 깊이에 있는데 이는 온도와 염분이 밀도를 결정하기 때문이며, 이러한 수직구조로 형성된 층을 '밀도 약층'이라고 한다. 반대로 낮은 염분의 해수층 아래 높은 염분의 해수가 위치하는 경우에도 염분 약층이 발생할 수 있다. 황해의 경우 한국과 중국으로부터 유입되는 담수의 영향과 여름철 장마로 인한 담수 유입량이 증가함에 따라 표층 해수의 염분이 더욱 낮아지는데 봄, 여름, 가을에는 표층 해수가 태양열에 의해 가열 됨에 따라 계절적인 염분 약층과 수온 약층이 발달한다. 이때 표층에는 고온의 저염의 해수가, 저층에는 차가운 고염의 해수가 위치하여 온도와 염분이 다른 층을 이룬다.
- 염분 약층은 해수의 수직적인 층화에서 중요한 역할을 하는데 온도와 함께 염분이 해수의 밀도를 결정하는 중요한 인자이기 때문이다. 특히 북극해, 베링해, 남극해와 같은 고위도 지역에서 염분 약층이 중요한 역할을 한다. 표층에 존재하는 물이 심층의 해수 보다 실제로 더 차갑지만 저층의 급격한 염분 차이로 인해 염분 약층이 형성되어, 차갑지만 낮은 염분의 해수가 표층에 위치하게 되며, 이렇게 형성된 염분 약층은 차가운 표층수와 상대적으로 따뜻한 심층을 분리하는 역할을 한다. 이 분리로 인해 차가운 표층에서는 얼음이 형성될 수 있으며, 또한 염분약층은 해수 내 이산화탄소가 고위도 지역의 대기로 빠져나가는 것을 제한하기도 한다.
열 염분 순환[편집]
- 열 염분 순환(thermohaline circulation,熱鹽分循環)은 해수의 온도(열)와 염분 차이에 의한 밀도차에 의해 수온약층 아래에서 느리게 흐르는 해수의 흐름이다. 해수의 열 염분 순환은 밀도 분포에 그 원인이 있다. 밀도를 결정하는 중요한 요소는 수온과 염분이다. 해수의 밀도가 균일하지 않을 경우, 밀도가 서로 다른 해수 사이에서는 압력 경도가 발생하여 해수가 이동하게 된다. 해수의 표층이 냉각되어 하층보다 밀도가 커지거나, 증발량이 강수량보다 커 밀도가 증가하면 표층 해수는 연직 방향으로 가라앉는 대류 현상이 나타난다. 이러한 과정을 통해 열 염분 순환(밀도류)이 발생한다. 심층에서 해수의 흐름은 주로 열 염분 순환에 의한다. 열염분순환은 전 수심, 전 위도에 걸쳐 일어나기 때문에 해수 순환에 큰 역할을 한다. 특히 저위도의 남는 에너지를 고위도로 운반하며 심해에 산소를 공급하여 심해 생물의 생존에 크게 기여한다.
절대 염분[편집]
- 절대 염분(Absolute Salinity)은 해수에 용해되어 있는 물질의 질량비로 1kg의 해수를 건조 시켰을 때 측정되는 건조된 염류의 질량(g)을 의미한다. 절대염분이란 해수 질량에 용해된 물질의 질량비로 1kg의 해수를 건조 시켰을 때 측정되는 건조된 염류의 질량(g)을 의미하며 절대염분을 측정하기 위해서는 모든 염류의 총량을 실제로 측정해야 한다. 여기에는 가장 많은 양을 차지하는 염화이온과 소듐(염화나트륨, NaCl), 황산염이온과 마그네슘 이온(염화마그네슘(MgCl2))과 황산마그네슘(MgSO4)), 칼슘과 칼륨이온 (황산칼슘(CaSO4), 황산칼륨(K2SO4) 등) 그리고 중탄산염(HCO3)등이 포함되며 이 같은 주요 이온 외에도 규소, 망간, 알루미늄, 철 등의 다양한 미량 원소가 포함되어있다. 염분의 양에 따라 전기전도도가 다르게 나타나는 점을 이용한 전기전도도에 의한 염분 측정 방법이 가장 일반적으로 사용된다. 그밖에 해수 내 염소의 양을 염화은으로 적정하여 염분비 일정의 법칙을 이용할 수 있으며, 비중계에 의한 밀도를 측정함으로써 염분을 환산할 수 있다. 그리고 액체에 녹아 있는 물질의 양에 따라 빛이 굴절하게 되는데 염분이 높을수록 꺾이는 각도가 더 커지게 되는 원리를 이용하는 굴절계를 이용할 수 있다.
염분계[편집]
- 염분계(salinometer,鹽分計)는 바닷물의 염분을 측정한다. 측정 방법으로는 직접전도율을 측정하는 방법과 유도기전력을 이용하는 방법이 있으며, 실험 방법으로는 퍼올린 물에서 측정하는 실험실용과 측정기를 물속에 가라앉혀 측정하는 현장형이 있다. 현재 가장 정밀도가 높고 사용하기 편리한 것은 바닷물의 전도도를 측정해서 염분을 구하는 장치이다. 이것에는 직접전도율을 측정하는 방법과 유도기전력(誘導起電力)을 이용하는 방법(유도염분계)이 있는데, 많이 사용되는 것은 후자이며 측정정밀도는 ±0.003‰이다. 선박 위나 실험실에 설치하여 퍼올린 물을 1개씩 측정하는 실험실형과, 내압용기(耐壓容器)에 들어있는 측정기를 직접 물속에 가라앉혀 연속적으로 측정하는 현장형이 있다.
염류[편집]
- 염류(鹽類)는 해수에 녹아있는 여러 가지 성분이다. 바닷물 1000g에 들어있는 염류의 양을 g수로 나타낸 것을 염분이라고 하고 단위는 실용염분단위(psu, practical salinity unit)를 쓴다. 염류 중 가장 많은 것은 짠맛이 나는 염화 나트륨(일명 소금)이고 두 번째로 많은 것은 쓴맛이 나는 염화 마그네슘(일명 간수)이다. 외에 황산 칼슘, 황산 칼륨 등이 있다. 염류가 바닷물 속에 든 양은 바다에 따라 다르지만, 염류 안에서 각 염류들이 이루는 비율은 거의 같은데 이를 염분비 일정의 법칙이라 한다. 염분비 일정의 법칙은 염소: 55%, 나트륨:30.6%, 황산염: 7.7%, 마그네슘: 3.7%, 칼슘: 1.2%, 칼륨: 1.1%이다.
사해[편집]
- 사해(Dead Sea,死海)는 이스라엘과 요르단에 걸쳐 있는 염호(鹽湖)이다. 요르단 강이 흘러드나, 물이 빠져나가는 곳은 없고 유입량과 같은 량의 증발이 일어난다. 염분은 표면에서 해수의 5배인 200‰ 정도로 생물이 살지 못하여 사해라는 이름이 붙었다. 표면 면적 810㎢. 최대깊이 378m, 평균 깊이 118m. 대함몰지구대에 있기 때문에, 호면은 해면보다 395m 낮아 지표상의 최저점을 기록한다. 이스라엘과 요르단에 걸쳐 있으며 북으로부터 요르단강이 흘러들지만, 호수의 유출구는 없다. 이 지방은 건조기후이기 때문에 유입수량과 거의 동량의 수분이 증발하여 염분농도가 극히 높아 표면수에서 200‰(해수의 약 5배), 저층수에서는 300‰이다. 따라서 하구 근처 외에는 생물이 거의 살지 않으며, 사해라는 이름도 이에 연유한다.
동영상[편집]
각주[편집]
- ↑ 〈염분〉, 《위키백과》
- ↑ 〈염분(salinity,鹽分)〉, 《두산백과》
참고자료[편집]
- 〈염분〉, 《위키백과》
- 〈소금〉, 《나무위키》
- 〈염류〉, 《위키백과》
- 〈염분(salinity,鹽分)〉, 《두산백과》
- 송은범 기자, 〈제주 바다에 ‘저염분 물 덩어리’ 밀려온다〉, 《동아일보》, 2024-07-29
- 강규민 기자, 〈땀 많이 흘리는 여름철 염분 보충 잊지 마세요〉, 《파이낸셜뉴스》, 2024-06-06
- 고경주 기자, 〈라면 국물에 절여진 한라산…“염분으로 식물 멸종돼 간다”〉, 《한겨레신문》, 2024-04-01
같이 보기[편집]

 위키원
위키원